CT 鉴别异位寂静型嗜铬细胞瘤与局限性巨大淋巴结增生症的价值
2021-09-18聂秀利韩金花刘芳兵
聂秀利,韩金花,刘芳兵,袁 芬
(1.山东大学附属济南市中心医院医学影像中心,山东 济南 250013;2.山东省青岛市中心医院放射科,山东 青岛 266042;3.南京中医药大学附属医院/江苏省中医院放射科,江苏 南京 210000)
典型的嗜铬细胞瘤(pheochromocytoma,PHEO)根据其临床表现和实验室检查易明确诊断,但部分寂静型PHEO 无明显代谢产物增加,仅表现为影像学异常,因无症状,易误诊,在应激状况下寂静型PHEO 可出现血压急骤波动甚至心血管事件,因此对此病认识非常重要。巨大淋巴结增生症,又称卡斯尔曼病(Castleman’s disease,CD)是一组较少见的、发病原因不明的慢性淋巴组织增生性疾病。CD 可分为局限性巨大淋巴结增生症(localized castleman’s disease,LCD)和多中心巨大淋巴结增生症(multicentric Castleman’s disease,MCD)2 种类型,一般表现为良性病理过程,但其可能增加淋巴瘤的患病概率,甚至部分可转化为浆细胞瘤、Kaposi 肉瘤等[1],故一经发现应手术切除。寂静型PHEO 与LCD 的影像学表现有一定重叠,易误诊,以往文献多侧重于对两者的CT 征象单独进行分析[2],较少系统比较两者的鉴别诊断要点。回顾性分析青岛市中心医院和济南市中心医院2009 年1 月至2020 年1 月经手术病理证实的20例腹部异位寂静型PHEO 和17例LCD 患者的CT 资料,探讨两者的CT 特征及差异。
1 资料与方法
1.1 一般资料 20例腹部异位寂静型PHEO(PHEO组)中,男9例,女11例;年龄20~81岁,平均(50.7±13.7)岁。17例LCD(LCD组)中,男7例,女10例;年龄19~73岁,平均(44.7±10.4)岁。PHEO组中8例因腹痛就诊,4例因腹泻、腹胀就诊,其余8例因CT 检查偶然发现病灶。LCD组中10例常规体检无特异症状,4例因自己扪及包块就诊发现;2例有腹痛、腰酸不适和不规则腹泻;1例自诉上腹部不适、消瘦就诊;16例透明血管型,1例混合型。
1.2 仪器与方法 患者均于术前行CT 平扫及动态增强扫描。采用Philips 16 层螺旋CT 机和 Brilliance iCT 256 层螺旋CT 机扫描。扫描范围从膈顶至髂嵴。扫描参数:120 kV,140~160 mAs,层厚3 mm,层距5 mm,矩阵512×512。增强扫描采用高压注射器经前臂静脉注射对比剂(碘浓度350 mg/mL)60~80 mL,流率3.0~4.0 mL/s,动脉期30~35 s、静脉期60~75 s、延迟期150~180 s。扫描结束后,原始数据自动重建,重建层厚1 mm,并传输至PACS。
1.3 图像分析 由2 名具有5 年以上工作经验的医师进行独立阅片分析和测量,意见不一致时由第3位医师(具有20 年以上CT诊断经验)决定结果。分析2组病灶位置、形态、内部囊变/坏死、钙化、边界、强化程度、强化方式、病灶周围血管、病灶内血管和子灶。测量最大截面的长径,于病灶质地较均匀的区域勾画圆形ROI(80~120 mm2),避开坏死囊变、钙化及较大的血管影;测量病灶最大截面的平扫CT值、3 期增强扫描CT值,测量3 次取平均值,计算病灶的最高绝对强化值,最高绝对强化值=增强扫描后最高期CT值-平扫CT值,分析强化模式。
1.4 统计学分析 使用SPSS 13.0 软件进行数据分析,2 名医师测量结果使用组内相关系数检验(ICC)行一致性检验,>0.75 为一致性良好。计量资料满足正态分布行独立样本t 检验,以表示,计数资料用χ2检验及Fisher 确切概率法。以P<0.05 差异有统计学意义。
2 结果
2组病灶的形态、钙化、强化程度、发病位置和病灶内血管差异均无统计学意义(均P<0.05)。PHEO组病灶内囊变/坏死、边界清楚、不均匀强化较LCD组多见,且差异均有统计学意义(均P<0.05)。LCD组病灶周围血管及子灶较PHEO组多见,且差异有统计学意义(均P=0.014)(表1,图1~3)。
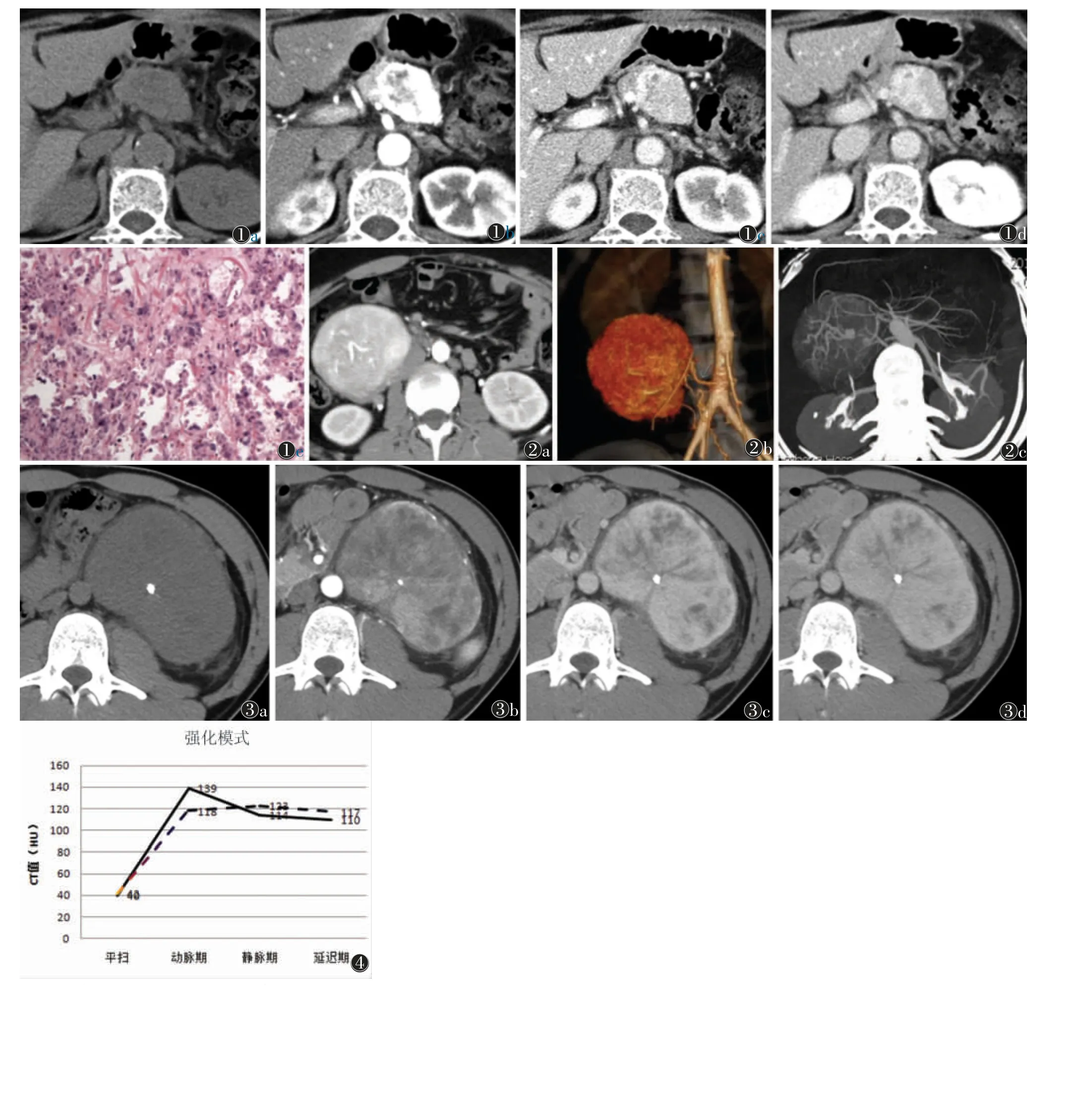
图1 女,61岁,寂静型嗜铬细胞瘤,体检发现 图1a CT 平扫示腹膜后胰腺下方类圆形病灶,最大截面5.2 cm×3.6 cm,边界清楚,内见片状低密度坏死区 图1b CT 增强扫描动脉期实质部分可见明显强化 图1c,1d 静脉期及延迟期低密度区呈向心性强化,实质部分平扫、动脉期、静脉期及延迟期CT值分别为42、220、134、132 HU,强化模式为快速上升、缓慢下降 图1e 病理切片示肿瘤以间质成分为主,内见大量玻璃样变成分(HE 染色,低倍放大)图2 男,27岁,局限性巨大淋巴结增生症,体检发现 图2a CT 增强扫描示病灶位于大血管旁者,被迂曲粗大供血滋养动脉包绕,动脉期显著强化 图2b 三维重建更有利于观察肿瘤周围血管结构 图2c MIP 可显示丰富的回流静脉网及丰富的侧支血管图3 男,31岁,局限性巨大淋巴结增生症 图3a~3d分别为CT 平扫及增强扫描动脉期、静脉期及延迟期图像,CT值分别为39、73、112、121 HU,示左肾前下方巨大软组织密度影,边界毛糙,最大截面9.1 cm×8.8 cm,增强扫描明显强化,其内见钙化灶及不强化斑片影,肿物周围脂肪间隙密度增高,可见条索影,左肾及周围肠管受压移位,该肿物由腹主动脉及肋间动脉、腰动脉分支供血,引流静脉汇入左侧髂总静脉图4 强化模式示意图,嗜铬细胞瘤呈速升缓降型(实线);巨大淋巴结增生症呈速升平稳型(虚线)④
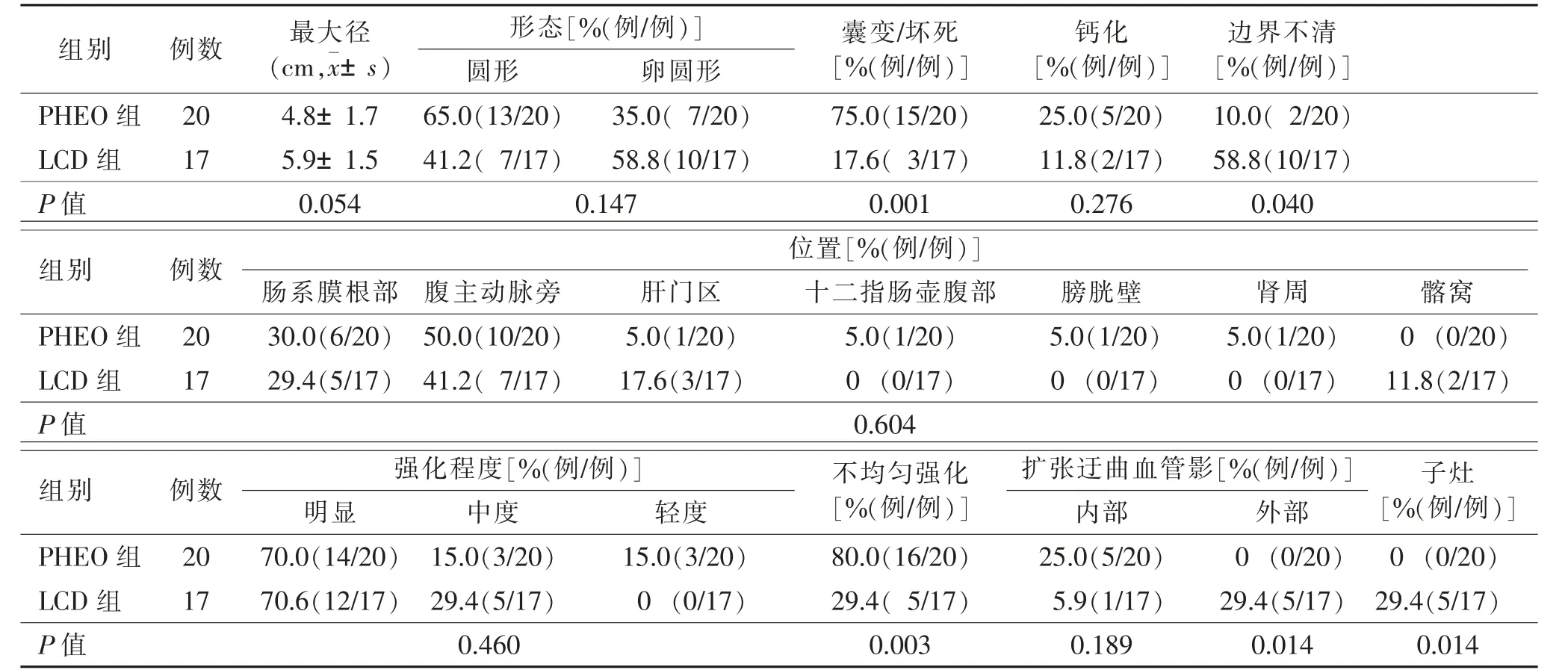
表1 2组病灶的CT 特征比较
2 名医师对2组最大径、平扫及动脉期、静脉期、延迟期CT值测量的结果一致性良好,分别为0.83、0.82、0.86、0.77、0.76。2组的最大径、平扫CT值、3 期增强扫描CT值和最高绝对强化值CT值差异均无统计学意义(均P>0.05,表2)。PHEO组强化模式似速升缓降型,而LCD组为速升平稳型(图4)。
表2 2组病灶各期CT值(HU,)
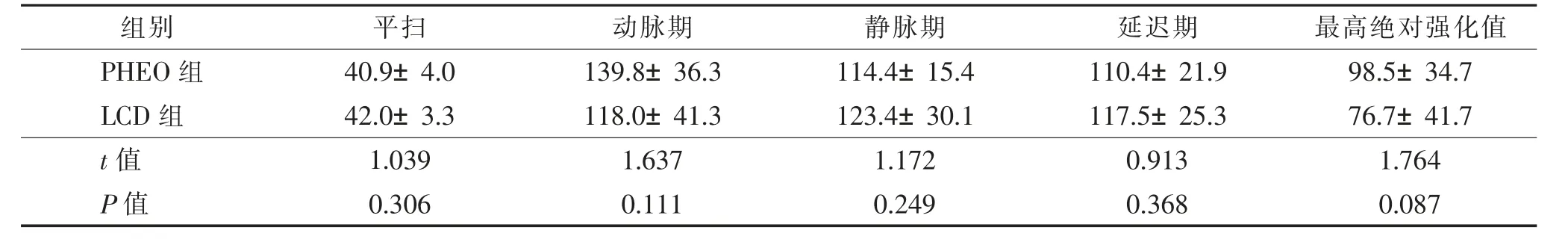
表2 2组病灶各期CT值(HU,)
3 讨论
3.1 腹部异位寂静型PHEO 和LCD 的临床特点 约10%的PHEO 为寂静型,国内较少例数的报道提示寂静型比例为10.2%~37.2%[2]。由于无典型症状,寂静型PHEO 误诊、漏诊常见。寂静型PHEO 包括隐匿功能性和无功能性。隐匿性PHEO 平时无高血压,严重应激状态如手术、感染、外伤等状况,会出现血压骤升或骤降;无功能性PHEO 指即使应激状态下,血压无波动,实验室检查无异常。术前无法判断隐匿性或无功能性,疑诊PHEO 患者,需进行充分术前评估与术前准备,以避免术中剧烈的血压波动[3]。异位PHEO 主要沿后正中线腹主动脉两侧分布[4],其中腹主动脉旁、右侧肾门区域最好发,膀胱壁也可发生。本组中,PHEO 发生于腹主动脉旁10例,肠系膜根部6例,肝门区、十二指肠壶腹部、膀胱壁、肾周各1例,与文献[5]结果相符。PHEO 可发生于任何年龄,无性别差异,本组中男9例,女11例,平均年龄(50.7±13.7)岁。LCD 大体上男女发病比例均等,各年龄均可发病,本组中,男7例,女10例,平均年龄(44.7±10.4)岁。LCD 根据病理学特点分为3型:透明血管型、浆细胞型和混合型。其中,透明血管型LCD 最常见,通常无任何症状,实验室检查正常,好发于纵隔淋巴结,腹盆腔、腹膜后等亦可发生[6-7],手术切除为主要治疗手段,预后良好。本组发生于腹主动脉旁7例,肠系膜根部5例,肝门区3例,髂窝2例,与文献[8]报道相符。腹部寂静型PHEO 与LCD的发病位置差异无统计学意义,且临床表现无特征性,均表现为腹腔单发软组织肿块,18例因CT 检查偶然发现,4例为扪及腹块就诊,10例因腹痛就诊,4例因腹泻、腹胀就诊,1例自诉上腹部不适、消瘦就诊,实验室检查对诊断帮助不大,诊断困难。PHEO 有潜在恶性,术后可能复发和转移。LCD 与PHEO 的治疗及预后不同,因此准确诊断及鉴别诊断有重要的临床意义。
3.2 PHEO 和LCD 的CT 征象 有功能的PHEO 病灶体积小,密度均匀。寂静型PHEO 病灶体积大,呈圆形或卵圆形,边界大部分清楚锐利,内部多坏死、囊变、出血,常有斑片状、点状及线状分布的钙化灶,约10%表现为较大厚壁囊性肿块,长径大、坏死程度高。唐钢琴[9]研究表明,无功能性PHEO 体积较大,密度不均匀,坏死及囊变发生率高。本组中,PHEO病灶最大径均值(4.8±1.7)cm,边界清楚(18/20),呈圆形(13/20)、卵圆形(7/20),可见程度不等的囊变/坏死(15/20)、钙化(5/20)。
本研究中LCD组直径(5.9±1.5)cm,圆形7例,卵圆形10例,与PHEO组比较差异均无统计学意义。研究报道,LCD 病灶密度较为均匀,内极少伴出血及坏死,但中心纤维瘢痕状低密度及粗大的向外周放射状生长的树枝样钙化较具有特征性[10]。LCD组17.6%(3/17)出现坏死,与PHEO组比较差异有统计学意义;11.8%(2/17)出现钙化灶,与PHEO组比较差异无统计学意义;LCD组肿块边缘模糊占58.8%(10/17),与PHEO组比较,差异有统计学意义。
PHEO 细胞间血窦丰富,有富血供的特征,动脉期呈显著不均匀强化,静脉期和延迟期强化不同程度降低;少数患者动脉期呈轻中度强化,静脉期和延迟期持续强化[11-12]。本组中,强化不均匀占80.0%(16/20),明显强化14例,中度强化3例,轻度强化3例,强化模式似速升缓降型,5例动脉期瘤体内可见血管。LCD 的CT 强化特点与病理分型相关[13]。透明血管型LCD 是一种富血管病变,本组16例透明血管型,动脉期明显均匀强化,动脉期强化高峰时间与主动脉强化高峰时间一致,较大肿块内部增强扫描后可出现裂隙状或放射状CT 低密度,静脉期对比剂廓清缓慢,延迟至平衡期,即动静脉双期呈持续性强化,静脉期对比剂进一步填充和退出,呈速升平台型,存在较多供养血管。LCD 内异常滤泡间区见大量明显的小血管增生(多为毛细血管后微静脉型)、淋巴窦消失和透明变血管穿过外套层进入生发中心,即瘤体内含异常丰富的血管网。CT 增强扫描所见瘤体内的灶状或条状低密度灶,病理证实为较多平行走行的纤维组织及发生玻璃样变性的血管结构,并非缺血坏死。LCD组均匀强化占70.6%(12/17),与PHEO组比较,差异有统计学意义。LCD组3 期增强扫描CT值与PHEO组比较,差异无统计学意义;明显强化12例,中度强化5例,与PHEO组比较,差异无统计学意义,与文献报道[14-15]一致。增强扫描中LCD 病灶可见边缘部粗大滋养血管亦为其特征性表现[16],本研究LCD组29.4%(5/17)肿块周围出 现粗大供血血管,寂静型PHEO 肿块周围无粗大血管,差异有统计学意义;LCD组5.9%(1/17)肿块内出现粗大供血血管,与PHEO组[25.0%(5/20)]比较,差异无统计学意义。腹部LCD 的特点是单发肿块或单发较大肿块周围伴小的子灶[17],本组中,5例LCD 周围发现子灶,与PHEO组比较,差异有统计学意义。
本研究的局限性:回顾性分析时间跨度大,存在一定误差,加之病例由不同CT 机器扫描,影响测量参数存在一定差别;未采用更精确的对比剂追踪扫描模式,导致获取的3 期增强扫描病灶内对比剂峰值可能与实际峰值存在偏差;样本量较小,统计结果可能存在一定的局限性。
综上所述,腹部寂静型PHEO 及LCD 均较少见,二者相比LCD 肿块内密度较均匀,少见囊变/坏死,边界欠清楚,肿块周围可见条索影、模糊影;增强扫描LCD多均匀强化,肿块外部多可见扩张的迂曲血管和子灶,强化模式呈速升平稳型。临床遇到腹部富血供病灶时,应考虑PHEO 与LCD 的鉴别诊断,部分诊断困难的患者,应密切结合临床,必要时行穿刺活检证实。
