自噬在大鼠椎间盘软骨终板退变中的作用*
2021-09-18陈科吕小华林健静孙军营袁正彬周辉叶健文李中杰
陈科 吕小华 林健静 孙军营 袁正彬 周辉 叶健文 李中杰
(1.深圳市人民医院暨南大学第二临床医学院南方科技大学第一附属医院脊柱外科,广东深圳 518020;2.广东医科大学药学院,广东湛江 524023;3.北京大学深圳医院骨科,广东深圳 518036)
椎间盘退变引起的下腰痛在人群中的发病率很高,已成为排名第一的职业性疾病。下腰痛是导致老年人瘫痪的主要原因,严重影响老年人的生活质量,给患者及家属带来沉重的经济负担[1]。但是,有关椎间盘退变的机制仍未完全明确。越来越多的证据表明软骨终板退变是椎间盘退变的始动因素[2]。自噬是真核生物细胞一种高度保守自我吞噬的过程。近年来,有证据显示自噬在椎间盘退变过程中起重要作用[3]。亦有证据表明自噬还参与了椎间盘髓核细胞和关节软骨细胞的代谢过程,从而在椎间盘退变和关节软骨退变中发挥积极作用[4,5]。本研究拟探讨自噬在椎间盘软骨终板细胞代谢中的作用,以进一步揭示椎间盘退变的病理机制。
1 材料与方法
1.1 实验动物和主要试剂
2周龄雄性SD大鼠购于广东省医学实验动物中心[实验动物许可证编号:SYXK(粤)2015-0106],每笼5 只,恒温[(23±2)°C]、恒湿[(50±5)%]、每12 h 光暗循环的条件下适应性饲养2 周后用于后续的原代细胞提取实验。
细胞培养相关试剂购自美国Gibco 公司;重组大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,50 ng/ml,常用于模拟椎间盘退变和/或关节退变炎性细胞所处的环境)购自美国Peprotech公司,巴弗洛霉素(baflomycin A1,Baf,一种常用的自噬抑制剂)、聚集蛋白聚糖(aggrecan)抗体和Ⅱ型胶原酶购自美国Sigma Aldrich公司;tublin抗体购自碧云天生物技术研究所;β-actin 抗体购自美国Cell Signaling Technology 公司,Ⅱ型胶原纤维α1(collagen type Ⅱalpha 1,COL2A1)抗体购自英国ABcam 公司;TRIzol RNA 抽提试剂盒购自美国Invitrogen 公司;RT-PCR 试剂盒和实时PCR 试剂盒购自宝生物工程(大连)有限公司;mRNA 引物委托英潍捷基(上海)贸易有限公司合成。
1.2 大鼠原代腰椎间盘软骨终板细胞的提取
通过颈椎脱臼法将4 周龄的雄性SD 大鼠处死,取其腰椎间盘,然后在解剖显微镜下放大4倍,仔细地将椎间盘的上下软骨终板分离出来,用大量0.1 mol/L磷酸盐缓冲盐水(phosphate buffer saline,PBS)冲洗后,用解剖剪将软骨终板剪成<1 mm3的小块。将剪成小块的软骨终板用0.25%胰酶在37℃消化30 min后,用0.1 mol/L PBS 洗去残留的胰酶,将软骨终板碎块移入一个装有0.2%Ⅱ型胶原酶的试管中消化4~6 h。消化完毕后,用0.1 mol/L PBS 洗去Ⅱ型胶原酶,将细胞培养在含有10%胎牛血清(fetal bovine serum,FBS)的DMEM/F12 培养基中,并添加1%青霉素链霉素抗生素,每隔2~3 d更换一次培养液。
1.3 细胞分组及处理
将细胞分为对照组、Baf组、TNF-α组、TNF-α+Baf组4组。对照组、Baf组、TNF-α组分别采用二甲基亚砜、Baf、TNF-α 作用于细胞24 h;TNF-α+Baf组先用Baf阻断自噬,再用TNF-α作用于细胞24 h。
1.4 RT-PCR检测COL2A1、aggrecan mRNA的表达
1.4.1 总RNA的提取:将6孔板内的软骨终板细胞用PBS反复清洗,加入TRIzol试剂,反复吹打细胞,将裂解液移入一个新的1.5 ml EP管中,室温静止5 min后,再将上述裂解液离心,小心吸取上清液,加入氯仿后离心,吸取上清液,加入异丙醇,离心后倒掉上清液,加入75%乙醇(DEPC水配制)洗涤RNA沉淀,待沉淀干燥后,加入适量DEPC水溶解,测定RNA浓度和质量,分装并保存于-80℃冰箱。
1.4.2 逆转录聚合酶链反应:转录体系为20 μl体系,具体操作步骤如下:1 μg各样本总RNA 10 μl,Prime Script RT Enzyme Mix×Ⅰ1 μl,RT Primer Mix 1 μl,5×Prime Script Buffer 2(for Real Time)4 μl,RNase Free dH2O 4 μl,将上述液体混匀并离心后进行反转录反应,PCR 反应条件设置如下:37℃15 min,85℃5 s,4℃,反应结束后将样本取出,置于-20℃保存。
1.4.3 实时荧光定量聚合酶链反应:从GeneBank 中搜索到大鼠相关COL2A1和aggrecan基因及内参基因GAPDH序列,根据其mRNA 序列,委托英潍捷基(上海)贸易有限公司合成COL2A1、aggrecan 和GAPDH引物(引物名称及序列详见表1)。

表1 引物名称及序列
按下列组分配制PCR反应液(反应液的配制在冰上进行):SYBR Premix Ex Taq™(2×)10 μl,PCR Forward Primer(10 μmol/L)0.5 μl,PCR Reverse Primer(10 μmol/L)0.5 μl,cDNA模板1.0 μl,dH2O(灭菌蒸馏水)8 μl。混匀后按下述三步法扩增:预变性:95℃30 s;PCR 反应(40 个循环):95℃5 s,55℃30 s,72℃30 s;溶解过程:95℃5 s,65℃1 min。各基因mRNA 表达用2-ΔΔCT计算结果来表示。
1.5 COL2A1和aggrecan蛋白表达的检测
1.5.1 细胞蛋白的提取:将6孔板内软骨终板细胞清洗后,加入蛋白裂解液裂解30 min,15 000 r/min(r=7.7 cm)4℃离心15 min,取上清并转移至新的1.5 ml EP 管中,取部分蛋白裂解液用于蛋白浓度测定(BCA 法),按EP 管中裂解液的体积加入适量的5×蛋白上样缓冲液,将加好上样缓冲液的蛋白裂解液在100℃煮沸5~10 min后4℃冰箱保存。
1.5.2 蛋白质印迹法检测:用湿转的方法将蛋白转移至用甲醇激活的PVDF 膜或者NC 上,用5%脱脂奶粉室温封闭90 min,TBST洗膜,10 min/次,共3次,将膜加入按适当的比例用一抗稀释液稀释的COL2A1、aggrecan、tubulin 和β-actin 抗体,在4℃摇床上孵育过夜,第二天用TBST 洗膜,10 min/次,共3次,二抗室温孵育60min后用TBST洗膜,10min/次,共3 次,感兴趣的蛋白条带用ECL 化学发光液发光,应用图像分析软件以内参为对照对相应的条带进行定量分析。
1.5.3 细胞免疫荧光染色检测:将24孔板内爬附在小圆玻片上的软骨终板细胞用0.1 mol/L PBS反复清洗3次(5 min/次),用预冷的4%多聚甲醛在4℃固定细胞30 min,PBS在摇床上洗涤细胞,5 min/次,共3次,用0.2%的Triton X-100 室温下细胞膜打孔20 min(摇床上),PBS 洗涤细胞,5 min/次,共3 次,10%山羊血清室温下封闭1 h,PBS洗涤细胞,5 min/次,共3次(摇床上),然后加入一抗稀释液稀释的一抗COL2A1(1∶200)、aggrecan(1∶200),4℃过夜,去除一抗,PBS洗涤细胞,5 min/次,共3次(摇床上),室温避光孵育荧光标记的二抗1 h,去除二抗,再次用PBS洗涤细胞,5 min/次,共3次(摇床上避光),用Dapi 复染细胞核5~10 min,去除Dapi染液,用PBS洗涤细胞,5 min/次,共3次(摇床上避光),防淬灭剂封片,荧光显微镜下观察。
1.6 统计学方法
应用SPSS11.5 统计学软件进行统计学分析。所有实验至少重复3 次。数据经统计学分析均符合正态分布,以表示。多组间比较采用单因素方差分析,进一步组间两两比较采用LSD检验或SNK检验。以P<0.05为差异有统计学意义。
2 结果
2.1 自噬对大鼠腰椎间盘软骨终板细胞COL2A1 和aggrecan mRNA表达的影响
Baf 组、TNF-α 组和TNF-α+Baf 组COL2A1、aggrecan mRNA表达量均较对照组减少,且差异均有统计学意义(P<0.05);TNF-α+Baf 组COL2A1、aggrecan mRNA表达量均较Baf组、TNF-α组减少,且差异均有统计学意义(P<0.05);Baf组与TNF-α组COL2A1、aggrecan mRNA表达量差异均无统计学意义(P>0.05),见表2。这表明自噬对大鼠腰椎间盘软骨终板细胞分泌的COL2A1、aggrecan mRNA具有保护作用。
表2 各组COL2A1和aggrecan mRNA表达量的比较()

表2 各组COL2A1和aggrecan mRNA表达量的比较()
注:△P<0.05,与对照组比较;▲P<0.05,与Baf组、TNF-α组比较
2.2 自噬对大鼠腰椎间盘软骨终板细胞COL2A1 和aggrecan蛋白表达的影响
2.2.1 蛋白质印迹法检测结果:Baf 组、TNF-α 组和TNF-α+Baf组COL2A1、aggrecan 蛋白表达量均较对照组减少,且差异均有统计学意义(P<0.05);TNF-α+Baf 组COL2A1、aggrecan 蛋白表达量均较Baf 组、TNF-α 组减少,且差异均有统计学意义(P<0.05);Baf 组与TNF-α组COL2A1、aggrecan 蛋白表达量差异均无统计学意义(P>0.05),见图1和表3。这表明自噬对大鼠腰椎间盘软骨终板细胞分泌的COL2A1、aggrecan蛋白具有保护作用。
表3 各组COL2A1和aggrecan蛋白表达量的比较()

表3 各组COL2A1和aggrecan蛋白表达量的比较()
注:△P<0.05,与对照组比较;▲P<0.05,与Baf组、TNF-α组比较

图1 各组COL2A1和aggrecan蛋白的蛋白质印迹法分析结果
2.2.2 细胞免疫荧光染色结果:细胞免疫荧光染色结果显示,COL2A1 蛋白主要分布于椎间盘软骨终板细胞质中,在软骨终板细胞的自噬被阻断后,细胞分泌的COL2A1 蛋白较对照组明显减少(图2)。Aggrecan 蛋白主要分布于椎间盘软骨终板细胞质中,在软骨终板细胞的自噬被阻断后,细胞分泌的aggrecan 蛋白较对照组明显减少(图3)。这从另一个角度证实自噬对大鼠腰椎间盘软骨终板细胞分泌的COL2A1、aggrecan蛋白有保护作用。

图2 细胞免疫荧光染色检测自噬对大鼠腰椎间盘软骨终板细胞COL2A1蛋白表达的影响
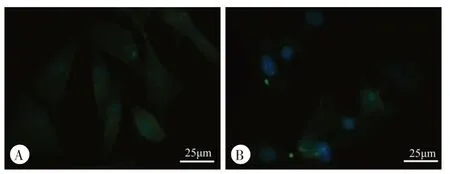
图3 细胞免疫荧光染色检测自噬对大鼠腰椎间盘软骨终板细胞aggrecan蛋白表达的影响
3 讨论
颈肩痛、下腰痛在人群中的发病率为80%~90%,严重影响人们的身心健康,而椎间盘退变疾病是引起颈肩痛、下腰痛的重要原因[6]。目前,针对椎间盘退变疾病的临床治疗策略包括物理治疗、抗炎药物治疗和外科手术治疗[7,8]。众所周知,外科手术治疗仅限于手术解除压迫、缓解症状,不能从根本上阻止椎间盘退变的发生与发展,且外科手术治疗本身有术后复发、邻近节段退变加速、手术节段机械物理特性改变等很多并发症[9,10]。而生物学治疗是一种潜在的能从根本上阻止椎间盘退变发生、发展,且恢复椎间盘正常功能与生物力学特性,使患者避免外科手术之苦的新的治疗方法。但是,由于椎间盘退变的发病机制仍不清楚导致椎间盘的生物治疗进展缓慢。软骨终板是一个饱含水分的生物组织,位于椎间盘的上下缘,是椎间盘获取营养的主要通道[11,12]。越来越多的证据表明软骨终板退变是椎间盘退变的始动因素[2]。尽管有证据表明软骨终板细胞过多的凋亡在软骨终板退变中起着重要作用,然而软骨终板退变的潜在分子机制仍不清楚[13]。
自噬是真核生物中细胞一种高度保守自我吞噬过程,与细胞凋亡密切相关[14]。细胞通过吞噬分解细胞内不重要的成分提供能量来抵御细胞遭受到的不良刺激,但是过度的自噬往往会导致细胞凋亡[15,16]。近年来,一些证据显示自噬在椎间盘退变过程中起重要作用[17]。与此同时,也有证据表明椎间盘软骨终板细胞内存在着自噬现象,且可能在软骨终板退变中起重要作用[18,19]。
本研究通过RT-PCR、蛋白质印迹法、细胞免疫荧光染色等方法证实软骨终板细胞存在自噬现象,且自噬对大鼠腰椎间盘软骨终板细胞分泌的COL2A1和aggrecan有保护作用,提示自噬对大鼠腰椎间盘软骨终板细胞具有保护作用,进而可能在椎间盘软骨终板退变乃至椎间盘退变的过程中发挥着积极的作用。
有研究表明自噬保护细胞的可能机制有:①通过自我吞噬从而抑制细胞凋亡来保护细胞;②通过减少分泌对细胞有害的物质来保护细胞。另外,也有研究显示:过多的自噬会导致另外一种细胞死亡方式——自噬性细胞死亡。在椎间盘退变中自噬的作用亦有争议:有研究表明,椎间盘软骨终板细胞在遭受应激情况下,通过提高自噬来抑制细胞凋亡,进而保护椎间盘软骨细胞,进而可能在椎间盘退变中发挥保护作用[18,20],然而也有研究表明,随着年龄增加或其他刺激因素的存在,椎间盘内细胞自噬增加,自噬性细胞死亡导致椎间盘退变,可能在椎间盘退变中有着有害作用[21-23]。大多研究认为自噬在椎间盘退变中可以抑制椎间盘细胞凋亡,对椎间盘退变起着保护作用。也可能在椎间盘退变不同阶段,自噬起的作用不同。
除了细胞凋亡会影响椎间盘退变外,椎间盘软骨终板细胞代谢异常导致的细胞外基质改变也是椎间盘退变的重要表现[24,25]。COL2A1 和aggrecan 是软骨细胞代谢过程中细胞外基质的重要组成部分,COL2A1和aggrecan等细胞外基质的减少代表着椎间盘的退变,而TNF-α是退变椎间盘中最常见的炎性因子,常用作体外刺激椎间盘或软骨细胞的刺激因子,以模拟体外椎间盘退变或软骨退变[26,27]。
已有研究表明自噬参与了椎间盘髓核细胞和关节软骨细胞的代谢过程,自噬激活可以增加髓核细胞、软骨细胞Ⅱ型胶原和aggrecan 分泌,抑制基质金属蛋白酶(matrix metalloproteinase)-13分泌,从而在椎间盘退变和关节软骨退变中发挥积极的作用[24,28]。最近有研究表明,自噬可以抑制循环牵张力对软骨终板细胞钙化的影响,从而在软骨终板钙化中发挥积极的作用,提示自噬极有可能参与了椎间盘软骨终板细胞的代谢过程,并在其中起重要作用[19,29]。这些实验的结论与本实验结果相似,进一步印证了本研究结果,提示自噬在椎间盘软骨终板退变乃至椎间盘退变的过程中发挥着积极的作用。
亦有研究报道与本研究结果不完全一致。有研究结果显示,在炎性因子存在的情况下,自噬对软骨细胞或椎间盘髓核细胞分泌的COL2A1和aggrecan有保护作用,而在没有炎症因子参与作用下,干预自噬对软骨细胞或椎间盘髓核细胞分泌的COL2A1和aggrecan的保护作用不明显[30-32]。本课题组分析认为,一方面这些研究的结果大都是在关节软骨细胞或椎间盘髓核细胞上得出的,虽然椎间盘软骨终板细胞在很多方面与关节软骨细胞或髓核细胞非常相似,但是不完全一样,导致同样的环境或条件,细胞反应不完全一样。另一方面,这些研究的自噬抑制剂用的是3-MA,而本研究采用的是Baf,这也可能是导致结果不完全一致的原因。本研究结论需要后续更多的实验数据支持。
当然,本研究也存在一些缺点。首先,本研究所得到的数据均是来自于体外,体外细胞所处的环境与体内不同,甚至有比较大的差别,因此体外的结果不一定能完全代表体内。另外,本实验中抑制自噬主要用自噬抑制药物来实现的,进一步的基因沉默技术可被用来证实本研究结论。第三,再做相关研究时,本课题组可以设多几个对照组,将文献中其他自噬抑制剂也设立相应对照组,同时可另外设立自噬促进剂,以及设立自噬基因过表达技术来进一步验证上述结论。第四,本课题组在做细胞外基质时可增加一些观察指标譬如MMP-3、MMP-9和ADAMTS4 等,模拟椎间盘退变的炎性因子除了TNF-α 外,还可以采用白细胞介素-1β(interleukin-1β,IL-1β)来进一步验证上述结论。
总之,本研究结果证实,自噬对大鼠腰椎间盘软骨终板细胞分泌的COL2A1 和aggrecan 有保护作用。本研究为试图通过调节自噬来抑制椎间盘退变提供新的发展方向,为椎间盘退变的生物学治疗提供新的潜在的治疗靶点。
