不同频次调髓中药对人脐带间充质干细胞的作用
2021-09-18陈祖祥葛彦志范梦强严莉严波单乐天童培建
陈祖祥 葛彦志 范梦强 严莉 严波 单乐天,3 童培建*
(1.浙江中医药大学附属第一医院骨伤科,杭州 310053;2.浙江中医药大学第一临床医学院,杭州 310053;3.杭州市第九人民医院骨科,杭州 311225)
人脐带间充质干细胞(human umbilical cord-derived mesenchymal stem cells,huc-MSCs)可促进受损组织再生[1],近年来已成为再生医学中极具吸引力的治疗工具。但是研究发现只有少量的移植细胞能够到达靶组织且早期凋亡率极高[2-4]。调髓中药是治疗髓病的主要药物,且多数以补益肝肾为主[5]。有多项研究表明调髓中药可以调控MSCs的增殖活力与分化潜力[6,7]。有研究通过对历代治髓方剂中的调髓中药进行频次统计,将调髓中药分为不同频次[5]。本研究拟比较不同频次调髓中药对huc-MSCs的作用。
1 材料与方法
1.1 主要材料与试剂
α-MEM 培养基购自美国Gibco 公司,胰蛋白酶(0.25%)购自美国Thermo Fisher 公司,TRIzol 试剂、逆转录试剂盒购于日本Takara 公司,2×SYBR购于美国BImake 公司,胎牛血清(fetal bovine serum,FBS)购自中国CellMax 公司,CCK-8试剂盒购于美国BImake 公司,细胞培养板购自德国Eppendorf 公司,Transwell 小室购自美国Corning 公司,肉桂、肉苁蓉、当归、川芎、白术与何首乌配方颗粒购自中国华润三九公司。
1.2 Huc-MSCs的分离培养与鉴定
本研究经杭州市第九人民医院伦理委员会审批。人脐带组织取自杭州市第九人民医院,经产妇知情同意后,采集产妇产后废弃的脐带组织,4 h内处理,脐带切成<2 cm3体积,用磷酸盐缓冲盐水(phosphate buffer saline,PBS)洗涤3次。去除表皮组织和血管内皮后,将组织浸入含10%FBS的α-MEM培养基中,在37℃和5%二氧化碳下孵育。培养基每2 d或3 d更换一次。将分离的细胞作为huc-MSCs收集并重悬于含10%FBS的α-MEM培养基中,在细胞融合后进行传代。取第二代huc-MSCs,用PBS重悬细胞,密度为1×106/ml,并分别与CD34、CD73、CD90、CD105等抗体一起孵育。在室温下孵育30 min后,将每个细胞悬浮液以2000 r/min(r=14 cm)离心5 min。取出上清液,加入100 μl PBS,将细胞沉淀重悬,采用流式细胞仪进行分析。
1.3 CCK-8法检测细胞活力
将培养至第三代的huc-MSCs以4×103/孔的密度接种于96 孔板上,每孔200 μl α-MEM 培养基,在细胞培养箱中贴壁培养24 h。将肉桂、肉苁蓉、当归、川芎、白术和何首乌配方颗粒用不含FBS的α-MEM 培养基以10、50、100、200、400、600、800、1000 μg/ml 的浓度进行稀释。移除huc-MSCs培养基,加入稀释后的不同浓度的含6种药物的α-MEM培养基,在培养箱中继续培养24 h。24 h 后,移除所有培养基,每孔加入200 μl 10%的CCK-8 溶液,并在37℃孵育2 h,直到颜色变成橙色,使用酶联免疫检测仪测定每孔在450 nm 处的吸光度(optical density,OD)值,重复操作3次。
1.4 细胞划痕实验
取对数生长期的huc-MSCs 接种在6 孔板(3×105/孔)中,将细胞分为对照组、肉苁蓉组、川芎组3 组。细胞融合达到80%~90%之后,用10 μl 枪头垂直于培养皿底部水平划痕,PBS 清洗细胞2次,洗去划下的细胞。对照组加入不含FBS的α-MEM培养基,肉苁蓉组、川芎组分别加入含1000 μg/ml肉苁蓉、川芎的α-MEM 培养基。在倒置显微镜下于3 个不同的时间点(0 h、12 h 和24 h)对细胞进行观察和拍照。划痕面积用Image J 1.47 软件计算。每个实验重复3 次。划痕愈合率=(0 h 划痕面积-12 h/24 h划痕面积)/0 h划痕面积×100%。
1.5 Transwell迁移实验
在带有Transwell小室(孔径8 μm)的24孔板中进行Transwell迁移实验。收集对数生长期的huc-MSCs,用PBS 洗涤,并以2×105/ml 的密度重悬于无FBS 的α-MEM 培养基中。将细胞分为对照组、肉苁蓉组、川芎组3 组,然后将200 μl 的huc-MSCs 悬液装入Transwell的上腔室,对照组在下腔室加入600 μl的无FBS的α-MEM培养基,肉苁蓉组、川芎组在下腔室分别加入600 μl的含1000 μg/ml肉苁蓉、川芎的α-MEM培养基。37℃孵育24 h后,取出小室清洗,通过上腔室膜的细胞用4%多聚甲醛固定15 min,并用0.1%的结晶紫溶液染色20 min,PBS清洗3遍,重复实验3次,用显微镜对不同区域的细胞进行拍照、计数。
1.6 qPCR检测huc-MSCs相关mRNA的表达
将培养至第3代的huc-MSCs分为对照组、肉苁蓉组、川芎组3组。对照组用不含FBS的α-MEM培养基培养24 h,肉苁蓉组、川芎组分别用含1000 μg/ml 肉苁蓉、川芎的α-MEM 培养基培养24 h。各组细胞培养完成后加入TRIzol 试剂,再加入氯仿(TRIzol 试剂体积的1/5)剧烈振荡,再静置5 min,以12 000×g离心15 min,取上清液并加入等量异丙醇,混匀后静置10 min,再以12 000×g离心10 min。去上清,再加入乙醇(75%)清洗,干燥沉淀后,加入RNase-free水溶解,提取总RNA。使用All-in-one cDNA 反转录试剂盒合成cDNA,再用SYBR Green qPCR Master Mix 试剂盒 检测CDC25A、CCNA2、E2F1、E2F2、MMP-2、TWIST1、VITMENTIN、PCNAmRNA 表达,目标基因序列见表1,各基因mRNA表达量用2-ΔΔCt计算结果来表示。

表1 qPCR引物序列
1.7 统计学方法
采用SPSS 19.0统计学软件进行统计学分析。计量资料经统计学分析均符合正态分布,以表示。多组间比较采用单因素方差分析,进一步组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 huc-MSCs鉴定结果
流式细胞术检测结果显示,huc-MSCs 低表达CD34,高表达CD73、CD90、CD105,阳性率均高于90%,见图1。这表明本研究分离培养的huc-MSCs具有较高的纯度。

图1 huc-MSCs鉴定结果
2.2 不同浓度不同频次调髓中药对huc-MSCs 活力的影响
huc-MSCs经处理24 h后,不同浓度的肉桂、肉苁蓉、当归均能显著增强huc-MSCs活力,其中肉苁蓉的促增殖作用最强。较低浓度的川芎、白术、何首乌对huc-MSCs具有促增殖作用,但是随着浓度的增加,它们的促增殖作用一直在降低,在1000 μg/ml时,川芎不利于huc-MSCs 增殖,表现出一定的细胞毒性。从400 μg/ml 浓度开始,高频调髓中药肉桂、肉苁蓉、当归的促增殖作用大于低频调髓药物川芎、白术、何首乌,且差异均有统计学意义(P<0.05 或0.01,表2)。后续实验选用两组药物中相对具有代表性的肉苁蓉和川芎进行实验,并且均采用1000 μg/ml的浓度。
表2 不同浓度不同频次调髓中药对huc-MSCs活力的影响(n=3,,OD450)
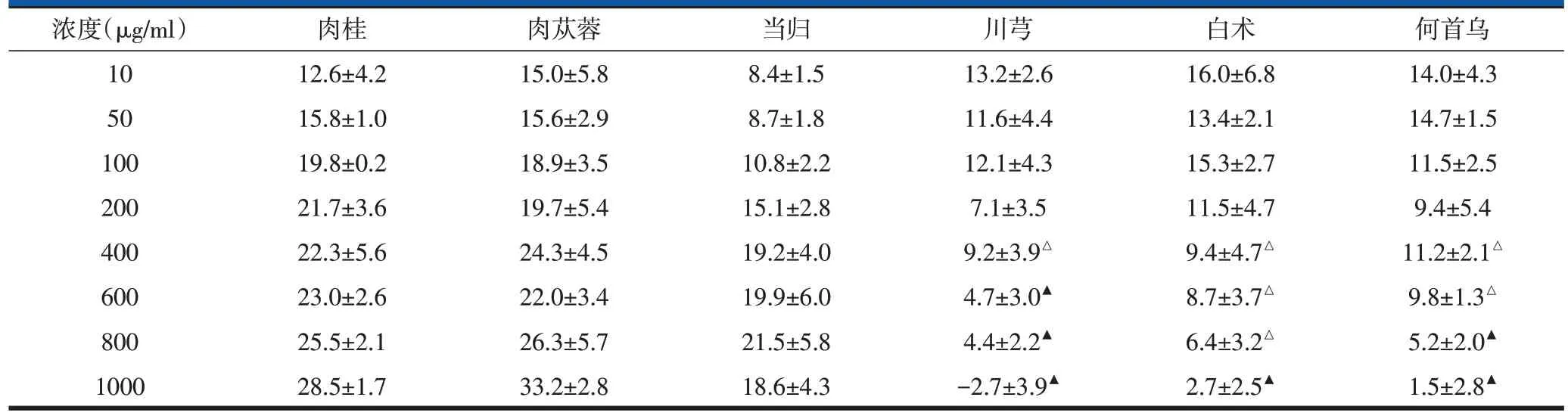
表2 不同浓度不同频次调髓中药对huc-MSCs活力的影响(n=3,,OD450)
注:△P<0.05,▲P<0.01,与肉桂组、肉苁蓉组、当归组比较
2.3 肉苁蓉和川芎对huc-MSCs迁移能力的影响
划痕实验结果显示,与对照组相比,在处理12 h、24 h 后,肉苁蓉组划痕两侧细胞密度逐渐增大,空白面积逐渐减少,划痕愈合率均增加,且差异均有统计学意义(P<0.05 或0.01),尤其是24 h 时,肉苁蓉组的划痕几乎全部消失;而处理12 h、24 h后,川芎组划痕愈合率均较对照组降低,且差异均有统计学意义(P<0.05或0.01)。
Transwell 实验结果显示,处理24 h 后,肉苁蓉组细胞迁移数量、细胞迁移率均较对照组增加,但是川芎组细胞迁移数量、细胞迁移率均较对照组降低,且差异均有统计学意义(P<0.01)。见图2、图3和表3。
表3 肉苁蓉和川芎对huc-MSCs迁移能力的影响(n=3,)
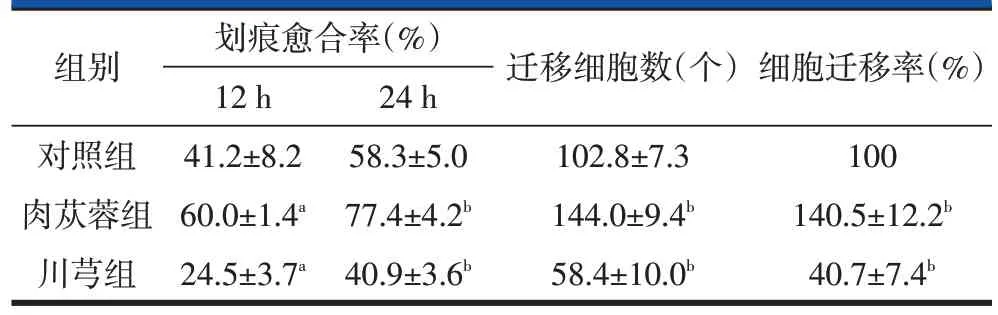
表3 肉苁蓉和川芎对huc-MSCs迁移能力的影响(n=3,)
注:aP<0.05,bP<0.01,与对照组比较

图2 肉苁蓉和川芎对huc-MSCs迁移能力影响的划痕实验结果
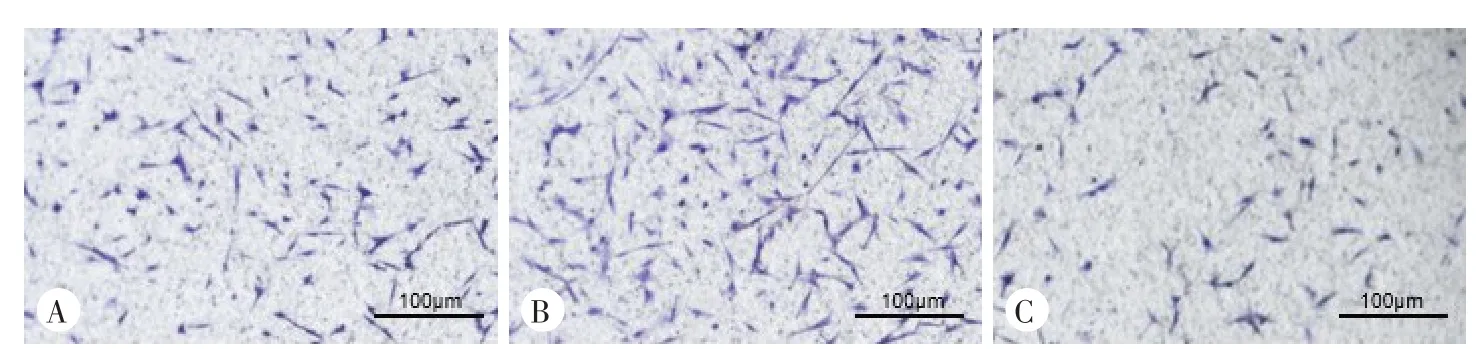
图3 肉苁蓉和川芎对huc-MSCs迁移能力影响的transwell迁移实验结果(结晶紫染色)
2.4 肉苁蓉和川芎对huc-MSCs相关mRNA表达的影响
qPCR 结果显示,与对照组相比,处理24 h 后,肉苁蓉 组huc-MSCsCDC25A、CCNA2、E2F1、E2F2、MMP-2、TWIST1、VITMENTIN、PCNA的mRNA表达量均增加,且差异均有统计学意义(P<0.05 或0.01);川芎组huc-MSCsE2F1、E2F2、MMP-2的mRNA表达量均降低,且差异均有统计学意 义(P<0.05 或0.01),而CDC25A、CCNA2、TWIST1、VITMENTIN、PCNA的mRNA 表达量与对照组比较差异均无统计学意义(P>0.05)。见表4。
表4 肉苁蓉和川芎对huc-MSCs相关mRNA表达量的影响()

表4 肉苁蓉和川芎对huc-MSCs相关mRNA表达量的影响()
注:△P<0.05,▲P<0.01,与对照组比较
3 讨论
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有高度的自我更新与多向分化能力的细胞[8],可以从骨髓、脂肪、脐带等多种组织中分离出来[9,10],在人体生长、发育和生殖过程中起始动作用[11],在临床上具有十分广阔的应用前景。huc-MSCs与其他来源的MSCs 相比具有数量多、扩增能力强、强大的免疫调节能力等特点[12],而且由于它具有较低的免疫原性,因此成为同种异体移植的更好的候选物[13,14]。但是大部分的临床疗效仍不理想,这主要是因为MSCs 移植到体内后存活率很低,并且还很难归巢到靶组织[15]。因此,当前有大量研究都将重点放在如何增强MSCs的疗效上[16]。自体血清干细胞(platelet rich plasma,PRP)中加入激活剂使PRP释放细胞内的多种生物活性分子[17,18],能够促进MSCs 增殖、迁移等[19-22]。血小板裂解物含有丰富的生长因子,也能够促进MSCs 增殖、迁移、分化等[23],并且联合应用血小板裂解物和huc-MSCs可以明显加强huc-MSCs治疗骨关节炎的疗效[24]。
传统中草药作为我国巨大的宝藏,具有巨大的应用价值。研究发现许多中草药能够增强MSCs 功能。梅花鹿骨骼和甜瓜籽提取物鹿瓜多肽能够促进huc-MSCs增殖、迁移以及抗炎因子肝细胞生长因子(hepatocyte growth factor,HGF)、前列腺素E2(prostaglandin E2,PGE2)和肿瘤坏死因子-α诱导蛋白6(tumor necrosis factor-α inducible protein 6,TSG6)的分泌[25]。丹参提取物丹参酮Ⅱa 能够增强huc-MSCs迁移、归巢、再生修复和免疫调节的生物学特性[26]。调髓中药作为治疗髓病的主要药物,对于MSCs 具有调控作用,它们不仅可以促进MSCs 增殖,抑制其凋亡,也可以促进骨髓MSCs分化[27,28]。
本研究的目的在于比较不同频次调髓中药对huc-MSCs的作用。首先本课题组选用了肉桂、肉苁蓉、当归3味高频调髓中药和川芎、白术、何首乌3味低频调髓中药进行细胞活力测定,结果发现,肉桂、肉苁蓉、当归可以显著促进huc-MSCs 增殖,然而川芎、白术和何首乌的促增殖作用随着浓度的增加逐渐降低,当浓度达到1000 μg/ml 时,川芎对huc-MSCs 增殖具有抑制作用,并且从400 μg/ml 浓度开始,高频调髓中药的促增殖作用明显高于低频调髓药物。后续实验中本课题组选用了两种频次调髓中药中具有代表性的肉苁蓉和川芎。虽然细胞增殖能力决定了最终可分化为靶细胞的MSCs 数量,但是MSCs 迁移能力决定了MSCs 归巢到靶组织的数量[29]。因此本研究进行了细胞划痕和Transwell 迁移实验,结果表明肉苁蓉可以促进huc-MSCs 迁移,而川芎抑制huc-MSCs 迁移。进一步的qPCR结果显示肉苁蓉对huc-MSCs 的作用主要与细胞周期进程相关基因(CDC25A、CCNA2、E2F1、E2F2)[30]和细胞迁移相关基因(MMP-2、TWIST1、VITMENTIN)[31]以及与细胞增殖相关基因PCNA[32]有关;而川芎对huc-MSCs 的作用主要与E2F1、E2F2、MMP-2有关。
综上所述,本研究发现不同频次的调髓中药在体外对于huc-MSCs 的作用不同。高频调髓中药对huc-MSCs的促增殖能力高于低频调髓中药,并且高频调髓中药可以促进huc-MSCs 迁移,而低频调髓中药抑制huc-MSCs 迁移。这些体外研究结果提示在体内不同频次的调髓中药可能对于huc-MSCs 也具有不同的作用。因此本课题组下一步研究将会探讨不同频次调髓中药在体内对于huc-MSCs 的作用。此外,本研究选取的药物有限,需要进一步扩大不同频次的调髓中药进行实验验证。
