缺氧诱导因子1α 在乳头状肾细胞癌中的表达及其与预后的关系
2021-09-18芮文斌吴瑜璇王浩飞汪成合
芮文斌,徐 达,祝 宇,吴瑜璇,王浩飞,汪成合,袁 菲
(上海交通大学医学院附属瑞金医院a.泌尿外科;b.病理科,上海 200025)
乳头状肾细胞癌(papillary renal cell carcino- ma,PRCC)是起源于肾小管上皮细胞的恶性肿瘤,Mancilla-Jimenez 在1976年因其乳头状结构提出了PRCC 的命名,才将其独立出来。PRCC 占肾细胞癌的7%~15%,根据其肿瘤细胞特点主要可分为嗜碱型(Ⅰ型)和嗜酸型(Ⅱ型)2 个亚型。大多数实体肿瘤存在缺氧或处于缺氧环境,这与肿瘤恶变、侵袭、转移以及化疗耐药有关[1-3]。缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)由HIF-1α 和HIF-1β 组成,在肿瘤低氧适应性反应中起着关键作用[4]。HIF-1ɑ 是肾透明细胞癌患者预后的重要指标,HIF-1ɑ 表达阳性预示其生存率低。本研究收集我院收治的83 例PRCC 患者的临床资料,观察其肿瘤组织中HIF-1ɑ 的表达情况和微血管密度(microvessel density,MVD),并分析患者的预后及相关影响因素。
资料与方法
一、资料
1.临床资料:回顾分析我院1996年10 月至2015年2 月收治的83 例PRCC 患者的临床资料。患者年龄为33~76 岁,平均年龄为55.13 岁;男性58 例,女性25 例,发病时间1~13 个月;肿瘤位于左侧肾者有47 例,位于右侧肾者有36 例。83 例患者均接受手术治疗,术前均未接受任何抗肿瘤治疗,术后3 例患者接受肿瘤浸润淋巴细胞免疫治疗;21 例患者接受干扰素或白细胞介素2 免疫治疗,共6~9 个月;3 例发生肿瘤远处(肺、脑、骨)转移或淋巴转移的患者切除原发肿瘤后,加行靶向治疗(舒尼替尼)至疾病进展或死亡;其余病例术后接受随访观察。
2.标本:取83 例患者经术后病理检查[苏木精-伊红(hematoxylin-eosin,HE)染色]确诊为PRCC 的肿瘤组织,并取15 例癌旁非肿瘤肾组织(手术切缘,病理证实无癌细胞残留)作为对照。所有组织标本均经4%中性甲醛溶液固定后,用石蜡包埋,行4 μm 厚连续切片,贴于涂有0.05%多聚赖氨酸的载玻片上待检。
3.试剂:所用试剂包括兔抗人HIF-1ɑ 多克隆抗体(Santa Cruz 公司,美国)、鼠抗人CD34 单克隆抗体(NCL-L-END,Novocastra,美国)、EnVision TM 抗兔IgG 试剂盒(K4003,DAKO 公司,荷兰)、EnVision TM 抗鼠IgG 试剂盒(K4001,DAKO 公司,荷兰)、苏木精(Biogenex Laboratories,San Ramon,美国)。
二、方法
1.检测方法:采用免疫组织化学(免疫组化)SP法检测HIF-1ɑ 表达情况和CD34 标记的MVD(见图1)。用已知HIF-1ɑ、CD34 阳性的结肠癌组织切片染色结果作为阳性对照,由PBS 代替一抗作为阴性对照。另制备常规HE 染色切片一张,以明确肿瘤类型,并根据肿瘤细胞核大小、形状和核仁是否明显进行Furhrman 核分级。
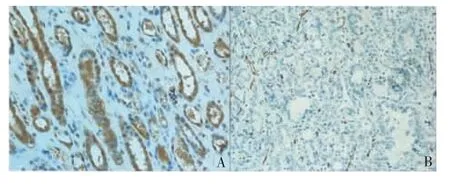
图1 PRCC 的HIF-1ɑ 阳性表达及MVD
2.结果判定:参照文献[5]的方法判定HIF-1ɑ表达结果,以细胞核或以细胞质呈棕黄色为阳性,高倍镜下(400 倍)对每张切片随机选择5 个视野,每个视野计数200 个细胞,共计1 000 个。阳性和阴性根据细胞染色强度和染色细胞所占面积两者积分之和来判断。染色强度积分为,不染色,计0 分;轻度染色,计1 分;中度染色,计2 分;强染色,计3 分;染色面积积分为,无细胞染色,计0 分;<25%细胞染色,计1 分;25%~50%细胞染色,计2 分;>50%细胞染色,计3 分。若以上2 项积分之和>3,则判定为表达阳性;积分之和≤3,则判定为表达阴性。
参照文献[6]的方法,在低倍物镜下选取高血管密度区,之后在高倍镜(400 倍)下计数3 个视野内被CD34 染成棕黄色的血管数,取其平均值作为该例肿瘤组织MVD 的数值。判断时需注意以下几点。①任何染成棕黄色的单个内皮细胞或与邻近微血管肿瘤细胞之间存在明显分离的内皮细胞团,均按独立的微血管计数,是否有血管腔不作为计数微血管的必要条件,分支血管细胞只要不相连也视为另一个微血管;②血管腔直径大于等于8个红细胞或管壁有平滑肌包绕的较大血管不纳入计数范围。
Fuhrman 核分级共分为4 级,1 级为小的细胞核,看不见核仁或核仁不明显;2 级为放大400 倍镜下可以看到核仁;3 级为放大100 倍镜下可见核仁;4 级为在3 级的基础上,出现畸形核、多核的细胞,伴有或不伴有梭形细胞。
3.随访:采用瑞金医院电子随访系统及电话对所有患者进行随访,对于失访的患者,经所在地公安局确认其是否存活或了解准确的死亡日期。
三、统计学方法
所有数据均采用SPSS 22.0 软件进行统计,计数资料采用χ2检验或Fisher 精确检验,计量资料采用Wilconxon 秩和检验,HIF-1ɑ 与MVD 间相关性采用Spearman 相关检验。生存分析数据采用Kaplan-Meier 法(K-M 生存曲线)进行计算,采用单因素和Cox 模型多因素回归分析确定与预后相关的临床因素,以P<0.05 为差异有统计学意义。
结果
一、PRCC 患者的临床特征
83 例患者中,37 例行根治性肾切除,43 例行保留肾单位手术,3 例行减瘤手术。术后随访13~162 个月,平均为68.5 个月。根据TNM 分期,其中T1N0M046 例、T2N0M025 例、T3N0M09 例、T4N1M01 例、T4N1M12 例。根据病理诊断,其中Ⅰ型PRCC患者有49 例,Ⅱ型PRCC 患者为34 例(见图2、表1)。
表1 PRCC 患者的临床特征、肿瘤组织中的HIF-1α 表达及MVD(n, )
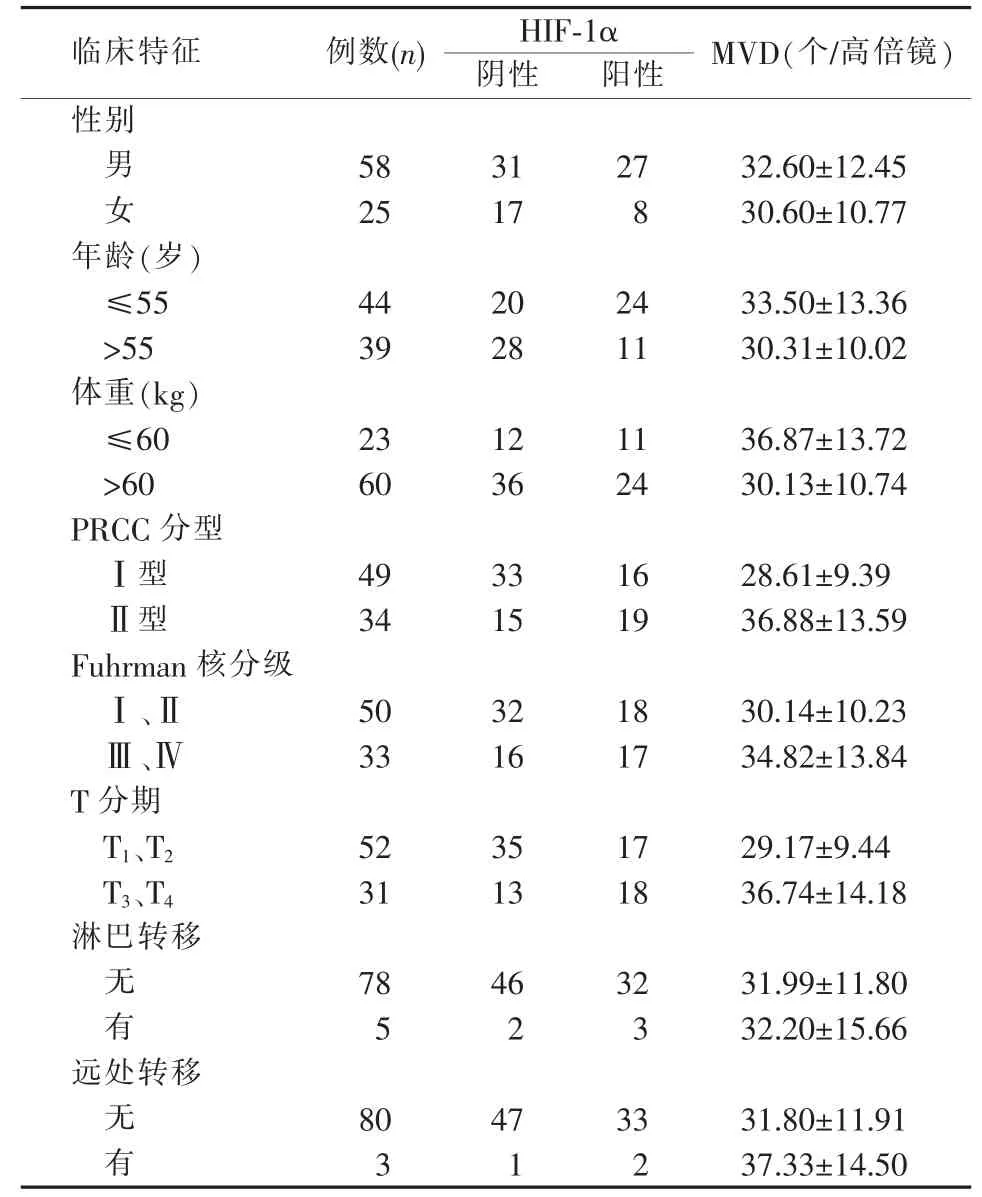
表1 PRCC 患者的临床特征、肿瘤组织中的HIF-1α 表达及MVD(n, )
图2 PRCC 分型
二、PRCC 组织中HIF-1ɑ 的表达及其与MVD间的相关性
HIF-1ɑ 在Ⅰ型和Ⅱ型PRCC 组织中均有表达,但Ⅱ型PRCC 组织中的HIF-1ɑ 阳性率为55.88%,高于Ⅰ型PRCC(32.65%)(P=0.035)。HIF-1ɑ 在癌旁非肿瘤肾组织中不表达(见表2)。
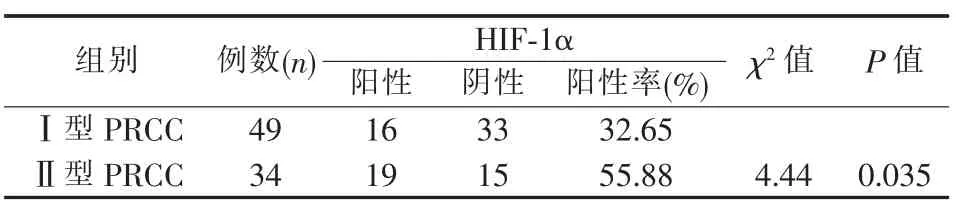
表2 PRCC 组织中HIF-1α 的表达
根据表3 所示,MVD 在Ⅱ型PRCC 组织中最高(36.88±13.59)个/高倍镜,Ⅰ型PRCC 组织中次之(28.61±9.39)个/高倍镜,正常肾组织中最低(14.07±5.95)个/高倍镜,各组间差异有统计学意义(P<0.05)。在83 例PRCC 组织中的HIF-1ɑ 阳性表达率为42.17%(35/83)。经Spearman 等级相关分析发现,HIF-1ɑ 在PRCC 组织中的表达与MVD 呈正相关(相关系数r=0.65,P<0.01)(见表4)。

表3 PRCC 组织及正常肾组织中的MVD

表4 PRCC 组织中HIF-1α 表达与MVD 间的关系
三、预后分析
83 例PRCC 患者的5年生存率为89.16%(74/83),至随访结束共有13 例患者死亡,占所有病例的15.67%,除3 例患者死亡原因不详,余死亡患者的死因均为肿瘤复发或多发转移。肿瘤远处转移部位以肺(41.23%)、骨(32.45%)、脑(16.89%)较常见。
比较Ⅰ型、Ⅱ型PRCC 患者的5年总体生存(overall survival,OS)率发现,Ⅰ型患者的OS 率优于Ⅱ型(87.8%比76.5%,P=0.01)(见图3A)。在PRCC 组织中,HIF-1ɑ 阴性组患者的OS 率高于阳性组(91.67%比74.29%,P=0.004)(见图3B)。而亚型分析显示,在Ⅰ型PRCC 组织中,HIF-1ɑ 阴性组与阳性组间的OS 率相似(93.93%比93.75%);而在Ⅱ型PRCC 组织中,HIF-1ɑ 阴性组患者的OS 率明显高于阳性组(86.67%比57.89%,P=0.03)(见图3C、3D)。采用单因素和多元回归分析确定各临床变量与OS 率间的关系(见表5),单因素分析显示,Fuhrman 核分级、是否存在肿瘤远处转移和HIF-1ɑ表达情况是影响此类患者预后的预测因子。多因素分析显示,Ⅱ型PRCC、Fuhrman 核分级Ⅲ~Ⅳ级、肿瘤发生远处转移及HIF-1ɑ 阳性表达是患者预后不良的因素。
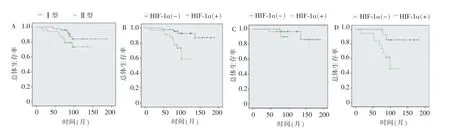
图3 PRCC 患者的总生存率
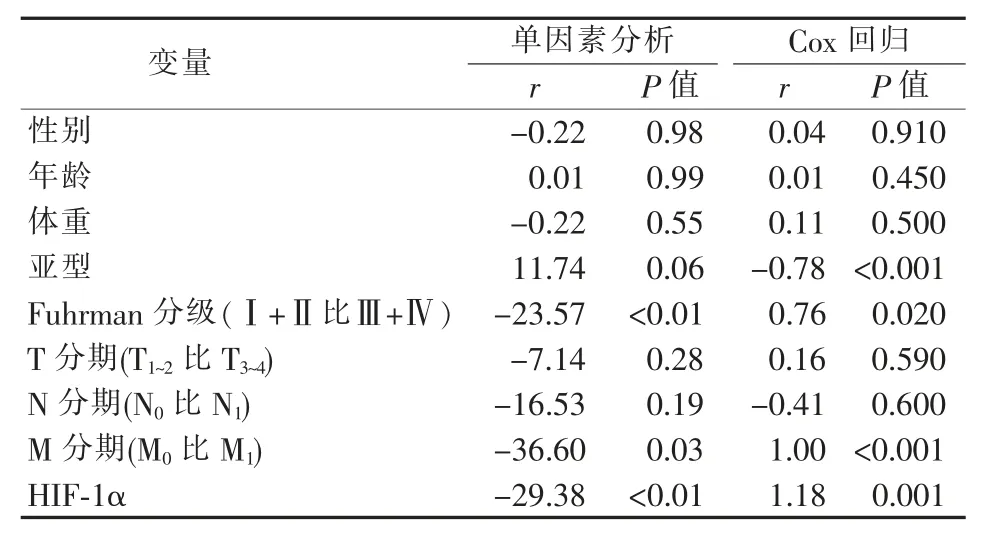
表5 单因素及多因素Cox 回归分析确定临床预后因素
讨 论
一、PRCC 组织中HIF-1ɑ 的表达率
在大多数人类肿瘤组织中,HIF-1ɑ 被认为是启动血管生成的最重要的转录因子,可调节某些因子如血管内皮生长因子、血小板源性生长因子和促红细胞生成素的转录,从而改变血管生成。HIF-1ɑ 在正常肾脏组织中几乎无表达,在肾细胞癌中的平均阳性表达率为70%(17%~97%)[7],在大多数透明细胞肾细胞癌中其表达均显著上调,而在其他类型的肾脏肿瘤中阳性表达率较低[8-9]。Lidgren 等[10]报道,在26 例PRCC 组织中HIF-1ɑ 的阳性表达率为57.69%,且其表达与肿瘤分级有关。目前,关于不同亚型PRCC 组织中HIF-1ɑ 表达情况的研究报道较少。本研究中,PRCC 组织中的HIF-1ɑ 总阳性表达率为42.17%,Ⅱ型PRCC HIF-1ɑ 阳性表达率高于Ⅰ型PRCC,可能提示这2 种亚型PRCC 发生、发展的分子基础不同。Saleeb 等[11]对80 例PRCC(Ⅰ型、Ⅱ型各40 例)进行RNA 测序,获得20 531 个基因,采用聚类分析后显示,Ⅰ型PRCC 发生、发展过程中涉及的主要信号通路为WNT、Hedgehog 和Notch,而mTOR、VEGF 和HIF 信号通路在Ⅱ型PRCC 发生、发展过程中常见。Ooi 等[12]同样指出,在Ⅱ型PRCC 中存在HIF 通路,这也解释了在Ⅱ型PRCC 中HIF-1ɑ 阳性表达率高的可能原因。
二、PRCC 组织中HIF-1ɑ 阳性的预后预测价值
HIF-1ɑ 是肿瘤血管生成的关键调节剂,而MVD 通常用于评估肿瘤血管生成水平,反映肿瘤的侵袭能力。在PRCC 组织中HIF-1ɑ 的表达与肿瘤MVD 呈正相关,相关系数为0.65,说明在Ⅰ型和Ⅱ型PRCC 中,HIF-1ɑ 都参与了肿瘤血管的调控。K-M 生存曲线分析发现,Ⅰ型PRCC 患者的预后好于Ⅱ型,其5年生存率分别为87.8%和76.5%。目前,大多数研究认为,PRCC 患者的预后与其肿瘤分型、肿瘤大小、Fuhrman 核分级及远处转移情况有关[13-14],但也有研究显示出了不同的结果。Chen 等[15]对185 例PRCC 患者进行预后分析,认为TNM 分期和世界卫生组织/国际泌尿病理学会分级与OS显著相关,而肿瘤分型与OS 无关。Ren 等[16]则认为,肿瘤分型和肿瘤分期可作为PRCC 患者预后的独立因素。因此,除了临床病理因素之外,HIF-1 也被作为大多数实体肿瘤预后的预测因子,其过表达通常与预后不良相关[17-20]。HIF-1ɑ 是肾透明细胞癌患者预后的重要指标,HIF-1ɑ 表达阳性预示患者生存率低[21-23]。但也有研究者提出相反观点,认为局部侵袭性透明细胞癌中的HIF-1ɑ 水平明显低于局限性肿瘤,提示HIF-1ɑ 阳性表达与较好的预后相关[10]。目前,HIF-1ɑ 表达是否影响PRCC 的预后尚未明确,本研究采用单因素和多因素分析显示,除Fuhrman 核分级、肿瘤是否存在远处转移之外,HIF-1ɑ 表达情况也是影响患者预后的因素。
多年来,抗血管生成药物一直是转移性肾细胞癌系统治疗的基石。然而,随着时间的推移,新型多激酶抑制剂、免疫靶点抑制剂以及不同的治疗组合层出不穷,要做到精准治疗、个体化治疗,就首先要确定预测患者预后的生物标志物。PRCC 是一种特殊类型的肾细胞癌,其恶性度低,进展缓慢,患者预后较好[24]。但在靶向药物治疗的时代,转移性PRCC患者的OS 率却较肾透明细胞癌患者低[25]。在评估舒尼替尼作为一线药物治疗转移性PRCC 的前瞻性Ⅱ期研究中,舒尼替尼的疗效低于其在治疗肾透明细胞中的疗效[26]。由于PRCC 患者中HIF-1ɑ 的表达情况与其预后相关,抑制与HIF 信号通路相关的分子和(或)HIF 靶基因可能可作为PRCC 的新型治疗方法。
