连作草莓低发病土壤与高发病土壤理化性质及生物学特征差异比较
2021-09-17李梦雅陈莎莎王世梅
李梦雅 陈莎莎 王世梅
摘要: 為探索连作草莓低发病土壤形成的机制,本研究通过对尖孢镰刀菌(Fusarium oxysporum)孢子萌发率以及连作土壤理化性质的测定,结合Real-time PCR及高通量测序对南京郊区多年连作草莓大棚低发病土壤和高发病土壤的理化性质及生物学特征进行比较,分析其微生物群落特征。结果表明,低发病土壤中尖孢镰刀菌孢子萌发率明显低于高发病土壤。二者理化性质亦呈现出不同的变化规律,低发病土壤 pH、EC、总碳含量、总氮含量和总磷含量均高于高发病土壤,低发病土壤的大团聚体(>0.250 mm)比例及土壤过氧化氢酶活性显著高于高发病土壤。Real-time PCR及高通量测序结果显示,低发病土壤中尖孢镰刀菌数量显著低于高发病土壤,且低发病土壤中鞘氨醇单胞菌属(Sphingomonas)、黄杆菌属(Flavobacterium)、类芽孢杆菌属(Paenibacillus)、游动放线菌属(Actinoplanes)等类群的丰度显著高于高发病土壤。因此,低发病土壤的形成与土壤理化性质、土壤中病原菌的数量及潜在有益微生物的种类和丰度密切相关。
关键词: 草莓;低发病土壤;高发病土壤;尖孢镰刀菌;团聚体;土壤酶活性;微生物群落结构
中图分类号: S154.3 文献标识码: A 文章编号: 1000-4440(2021)04-0910-09
Contrast of physicochemical properties and biological characteristics of low disease and high disease soils of continuous cropping strawberry
LI Meng-ya, CHEN Sha-sha, WANG Shi-mei
(Jiangsu Provincial Key Laboratory of Solid Organic Waste Utilization/Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization/Research Center of Resource-saving Fertilizer Engineering Technology, Ministry of Education, Nanjing Agricultural University,Nanjing 210095, China)
Abstract: In order to explore the formation mechanism of low disease soil of continuous cropping strawberries, the low disease soil and high disease soil samples were collected from a greenhouse for continuous cropping strawberry in Nanjing suburb to compare the physicochemical and biological characteristics of the above two kinds of soils and analyze the features of microfloras, based on detection of the spore germination rate of Fusarium oxysporum and physicochemical characteristics of continuous cropping soil, combined with Real-time PCR and high-throughput sequencing. The result showed that, the spore germination rate of F. oxysporum in low disease soils was obviously lower than that in the high disease soils. The physicochemical characteristics of the soils also presented different change rules, the pH value, EC, total carbon content, total nitrogen content and total phosphorus content of low disease soils were higher than those of high disease soils. The proportion of macro aggregates (>0.250 mm) and soil catalase activities in low disease soils were also significantly higher than those in high disease soils. Results of Real-time PCR and high-throughput sequencing indicated that, the number of F. oxysporum in low disease soils was significantly lower than that in high disease soils, while the abundances of Sphingomonas, Flavobacterium, Paenibacillus and Actinoplanes in low disease soils were obviously higher than those in high disease soils. Therefore, the formation of low disease soils is closely related to the physicochemical properties, pathogen abundance and the variety and abundance of potential beneficial microorganism in the soils.
Key words: strawberry;low disease soil;high disease soil;Fusarium oxysporum;aggregates;soil enzyme activity;microbial community structure
由于集约化农业的发展,果蔬连作现象普遍存在。在多年连作条件下,土传病害严重,发病率高的土壤称作高发病土壤(High disease soil,HDS),有的文献称此类土壤为导病型土壤(Conducive soil),而有些土壤,虽然连作多年,但是植物发病率依然较低,此类土壤称作低发病土壤(Low disease soil,LDS),有的文献也称该类土壤为抑病型土壤(Suppressive soil)[1]。低发病或抑病型土壤很早就被发现在世界各地均有所分布,如Cook等[2]在美国西北太平洋地区发现抑制小麦全蚀病病原菌(Gaeumanon-myces graminis var.tritici,禾顶囊壳小麦变种)的土壤、Meng等[3]在美国密歇根州发现抑制马铃薯疮痂病病原菌(Streptomyces scabies, 病原链霉菌)的土壤。为了促进植物健康生长,农业科技工作者会采取各种措施改变土壤性质,其中最绿色环保、可持续发展的方法就是土壤自身调节,低发病土壤就是土壤自身调节最典型的产物。关于低发病或抑病型土壤的形成机制研究尚不深入,文献报道土壤的理化性质如有机质含量、pH、矿物质以及水分、温度等非生物因子均可影响土壤微生物数量与种类,进而影响植物病害的发生[4-5]。Benizri等[6]研究发现土壤微生物群落组成及结构是土壤抑病能力形成的关键,随着连作时间的延长,土壤微生物生态平衡遭到破坏,使得大部分连作土壤转化为高发病土壤[6-7],但仍有少部分连作土壤抗病性依然较强[8]。
草莓根腐病是由于草莓连作引起的根部土传病害,已成为草莓产业发展的主要障碍,其病原菌包括尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)、疫霉(Phytoqhthora fragariae)等,其中尖孢镰刀菌是主要的病原菌[9] 。农业生产上防治草莓根腐病的措施有土壤消毒、轮作等,化学药剂处理对土壤环境有污染,轮作效果好,但难以适应设施农业种植模式的要求[10],生物防控是一项绿色环保的重要技术[11]。2014-2016年我们在南京郊区傅家边农业种植园进行草莓根腐病生物防控田间试验时,发现傅家边多年连作草莓园有高发病大棚,也有低发病大棚。因此,通过采样分析高发病及低发病大棚土壤抑制尖孢镰刀菌孢子萌发的能力,测定土壤理化性质,结合高通量测序技术分析2类土壤微生物区系特征,探讨连作草莓低发病土壤形成的机制,以期为防控草莓连作障碍提供理论依据。
1 材料与方法
1.1 供试土壤
土壤采集于南京傅家边农业生态园,土壤类型为黄棕壤。采集低发病土壤(发病率在10%~15%,草莓连作5~8年),高发病土壤(发病率达60%左右,草莓连作5~10年),各选取3个低发病大棚(LDS-1,LDS-2,LDS-3),3个高发病大棚(HDS-1,HDS-2,HDS-3),每个大棚采集3个混合样,每个混合样由5个相距2 m的2 m×2 m大小的取样点采集的土样组成,采集离草莓根系较近的土壤混合。采样时间为2017年11月底,将采集的新鲜土壤装于无菌牛皮纸袋内带回实验室保存备用。
1.2 供试菌株
草莓根腐病病原菌尖孢镰刀菌(Fusarium oxysporum)Y3由本实验室分离保存[12]。
1.3 连作草莓低发病土壤与高发病土壤对F. oxysporum Y3 孢子萌发的影响
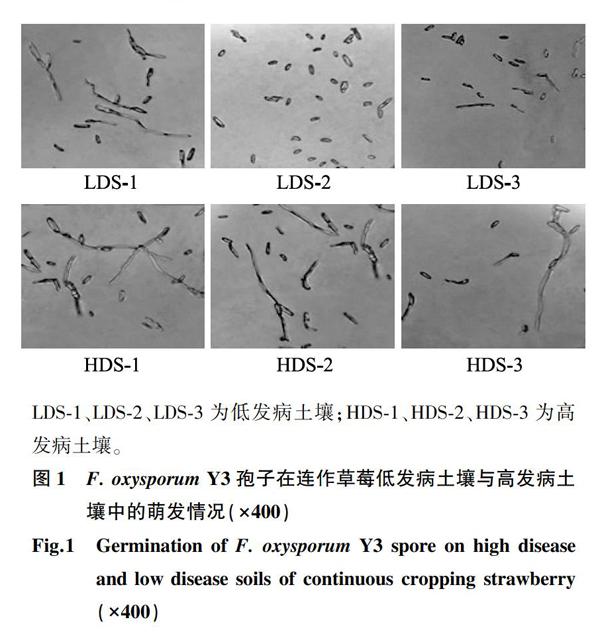
在PDA平板上接种F. oxysporum Y3,28 ℃恒温培养5~7 d,用无菌水洗涤,无菌脱脂棉漏斗过滤,制备Y3 的孢子悬浮液,并调整孢子含量为1×103CFU/ml。取风干后磨碎的土壤样品各30 g于90 mm培养皿中,加入适量无菌水使土湿润,28 ℃平衡3 d。利用真空抽滤装置将50 ml的孢子悬浮液吸附于滤膜(0.45 μm)上,加盖玻璃片后将其埋于土壤平板中间,28 ℃恒温培养24 h后取出玻璃片置于显微镜(×400)下观察Y3的孢子萌发情况,每个处理3次重复,每重复随机观察3~5个不同的视野,统计每100个孢子中的萌发数量,计算萌发率 [13]。
1.4 土壤基本理化性质测定
新鲜土壤样品风干,磨碎,过80目筛,在105 ℃烘干至恒质量。利用Elementar公司元素分析仪通过干烧法测定土壤的总碳(TC)含量、总氮(TN)含量及碳氮比(C/N)。利用消解-钼锑抗分光光度法测定土壤总磷(TP)含量[14],利用电导率测定仪(DDS-307A 型)测定土壤电导率(EC),利用雷磁(E-201-C型)pH计测土壤pH值。
1.5 土壤团聚体分布测定
将采集的土壤样品自然风干,称取40~50 g风干土壤放置自上而下孔径为2.000 mm,0.250 mm和 0.053 mm套筛上,放入水中并全部浸没,静置10 min,随后将其置于湿筛机(FT-3型电动团粒分析器)上,上下振幅為3 cm,频率为1 min 30次,时间为5 min。收集粒径>2.000 mm、2.000~0.251 mm、0.250~0.053 mm、<0.053 mm的4种土壤团聚体并分别转移至铝盒中,105 ℃烘干称质量,计算各粒级团聚体的质量百分比。
1.6 土壤过氧化氢酶(CAT)活性测定
采用土壤过氧化氢酶(CAT)试剂盒测定酶活性,试剂盒购自苏州科铭公司。
1.7 土壤细菌、真菌及尖孢镰刀菌 Real-time PCR扩增
采用MOBIO试剂盒提取土壤样品微生物总DNA并于-20 ℃保存备用。使用Nanodrop 200超微量分光光度计检测土壤DNA含量。采用 TaKaRa公司的SYBR Premix Ex Taq TM试剂盒于ABI(Applied BIO systems)PRISM 7500 Real-time PCR Systems扩增仪上对DNA样品进行Real-time PCR扩增,土壤细菌、真菌及尖孢镰刀菌的通用引物分别参照文献[15]~[17]。反应体系为20.0 μl: SYBR Premix Ex Taq TM(2×)10.0 μl,上下游引物各0.4 μl,ROX Reference Dye Ⅱ(50×) 0.4 μl,模板DNA 1.0 μl,ddH2O 7.8 μl。细菌通用引物USU-F:5′-AACTGGAGGAAGGTGGGGA-3′,USU-R:5′-AGGAGGTGATCCAACCGCA-3′;真菌通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′;尖孢镰刀菌通用引物W106R:5′-GCAGTCGTACGTCATCGACC-3′,W106S:5′-CCATGGCAGATGGCGAGTCA-3′,反应条件:95 ℃ 5 min;95 ℃ 30 s,细菌55 ℃ 30 s(真菌为61 ℃,尖孢镰刀菌为 60 ℃),72 ℃ 1 min,40个循环;72 ℃ 10 min。
1.8 土壤细菌与真菌高通量测序
土壤DNA样品送至上海凌恩生物科技有限公司完成土壤细菌与真菌高通量测序。MiSeq测序流程:基因组DNA提取,设计并合成引物接头,PCR扩增和产物纯化,PCR产物定量和均一化,MiSeq PE文库构建,MiSeq高通量测序。细菌16 S rRNA扩增引物341F:5′- CCTACGGGAGGCAGCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′;真菌ITS 扩增引物ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS2R:5′- GCTGCGTTCTTCATCGATGC-3′。
1.9 数据处理与分析
利用Microsoft Excel 2007软件进行数据处理与物种相对丰度分析,用SPSS20.0统计分析软件进行数据方差分析与差异显著性检验,显著水平设定为P<0.05。采用Qiime 1.7.0 软件计算Shannon、Chao等多样性指数,OTU(Operational taxonomic units)利用R 语言 “vegan”包基于Bray-curits距离进行主成分分析。
2 结果与分析
2.1 连作草莓低发病土壤与高发病土壤对尖孢镰刀菌Y3孢子萌发的影响
将平板置于28 ℃恒温培养箱培养24 h后,观察尖孢镰刀菌Y3孢子萌发情况并计算其萌发率(图1、表1)。高发病土壤中Y3孢子萌发率明显高于低发病土壤,高发病土壤孢子萌发率均高于50%,其中HDS-1最高,达到了75.75%;在低发病土壤中, LDS-2、LDS-3对Y3孢子萌发具有很强的抑制作用,而Y3孢子在LDS-1中萌发率较高,表明LDS-1的抑菌能力下降。
2.2 连作草莓低发病土壤与高发病土壤基本理化性质差异比较
由表2可知,低发病土壤pH与高发病土壤差异不显著。各土壤样品电导率值为400~850 μS/ml,除LDS-1外,低发病土壤电导率显著高于高发病土壤。低发病土壤的总碳含量和总氮含量高于高发病型(LDS-1除外),低发病土壤碳氮比低于高发病土壤。低发病土壤的总磷含量高于高发病土壤且差异显著。
2.3 连作草莓低发病与高发病土壤团聚体粒径分布比较
土壤大团聚体含量的高低能够很好地反映土壤保持和供应养分能力的强弱。由表3可知,低发病土壤大团聚体(>2.000 mm、2.000~0.251 mm)比例高于高发病土壤,而高发病土壤小团聚体比例 (0.250~0.053 mm、<0.053 mm )高于低发病土壤,其中LDS-1的团聚体分布类似高发病土壤,可见低发病土壤团聚体趋向于大粒径,高发病土壤团聚体更趋向于小粒径。但是LDS-1的大团聚体(>2.000 mm 、2.000~0.251 mm )比例显著小于LDS-2及LDS-3,而与HDS-2类似。综合土壤抑菌能力及团聚体粒径分布情况,推测LDS-1趋向高发病型土壤转化。
2.4 土壤基本理化性质、团聚体分布与 F. oxysporum Y3孢子萌发率相关性分析
将6种土壤样品的基本理化性质、团聚体分布和F. oxysporum Y3孢子萌发率进行Pearson相关性分析,结果见表4。总氮含量与F. oxysporum Y3孢子萌发率呈极显著负相关,土壤养分中的总碳含量与大团聚体(2.000~0.251 mm)比例呈显著正相关,EC和总氮含量与大团聚体(2.000~0.251 mm)呈正相关。F. oxysporum Y3孢子萌发率与大团聚体(>2.000 mm、2.000~0.251 mm)呈显著负相关,与小团聚体(0.250~0.053 mm)呈極显著正相关。说明丰富的土壤养分有助于大团聚体的形成及稳定,而且土壤抑菌能力和土壤团聚体组成与稳定也存在较好的正相关性。
2.5 连作草莓低发病土壤与高发病土壤过氧化氢酶活性比较
土壤过氧化氢酶活性是评价土壤抗病性的重要指标。由图2可知,低发病土壤LDS-2、LDS-3过氧化氢酶活性高于高发病土壤,低发病土壤过氧化氢酶活性最高可达到 17.88 μmol/(d·g),是高发病土壤的1.76~2.22倍,说明土壤过氧化氢酶活性增加对土壤抑病有积极作用。
2.6 连作草莓低发病土壤与高发病土壤主要微生物数量比较
由表5可知,低发病土壤细菌数量总体上略高于高发病土壤(HDS-2除外),真菌数量显著高于高发病土壤,而高发病土壤中,尖孢镰刀菌数量显著高于低发病土壤,说明低发病土壤的形成与尖孢镰刀菌数量密切相关。
2.7 连作草莓低发病土壤与高发病土壤细菌及真菌群落结构差异比较
原始序列经过抽提分配之后,18个土壤样品共有843 300条16 S rRNA和811 149条ITS优质序列,经抽平后,在97%相似度水平下16 S rRNA序列共有8 128个OTU,而ITS序列共有1 375个OTU。在97%的相似水平上利用Chao指数和Shannon指数对样品中细菌及真菌物种丰度和多样性进行分析,结果见表6。由表6可知,低发病土壤和高发病土壤细菌和真菌Chao指数及Shannon指数差异均不显著,物种丰富度和物种多样性差异不大。
基于Bray-curits距离的主成分分析结果(图3)表明,低发病土壤与高发病土壤中细菌和真菌群落结构均在第1轴(PCA1)和第2轴(PCA2)存在差异。通过使用方差置换分析发现,二者土壤细菌和真菌群落多样性差异均极显著(P<0.01),说明低发病土壤与高发病土壤细菌和真菌群落结构相似度低。
2.8 连作草莓低发病与高发病土壤细菌及真菌群落组成差异比较
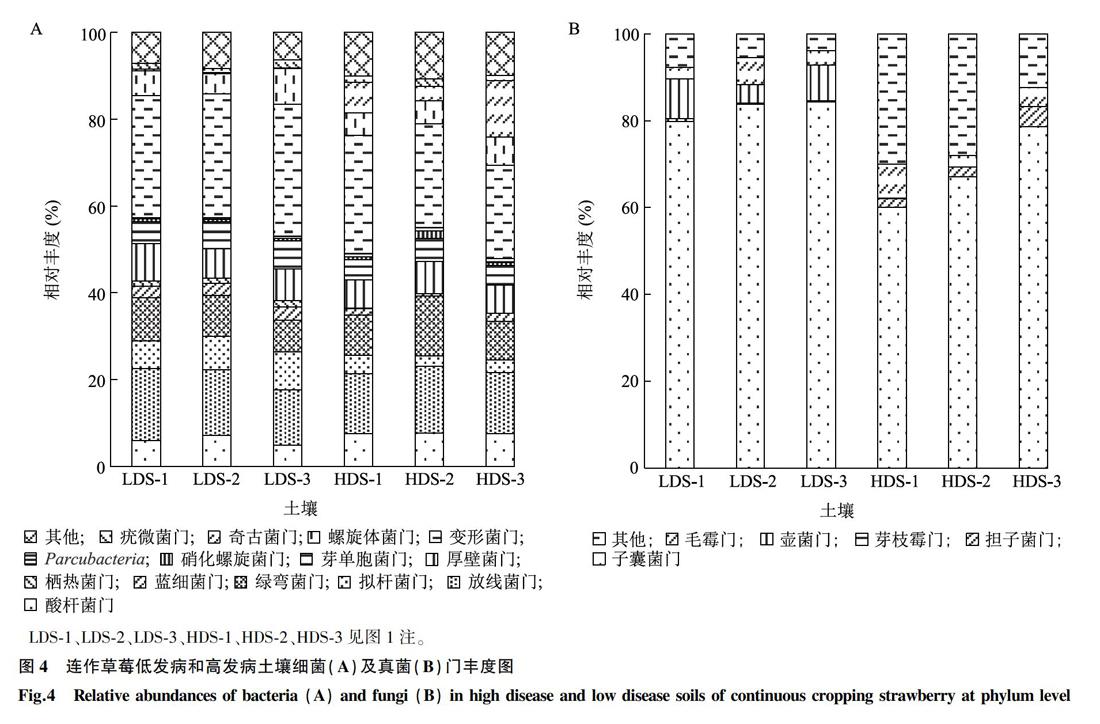
在门分类水平上,样本的优势细菌门及真菌门组成类似,差异主要体现在丰度上(图4)。在细菌门水平,土壤中主要的细菌门类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、奇古菌门(Thaumarchaeota)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes)等,其中丰度最高的是变形菌门,占20%~30%。低发病土壤中变形菌门,拟杆菌门、蓝细菌门,栖热菌门丰度显著高于高发病土壤,而酸杆菌门,奇古菌门丰度低于高发病土壤。土壤中主要的真菌门包括子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)、芽枝霉门(Blastocladiomycota)及毛霉亚门(Mucoromycota),其中子囊菌门丰度最高,占60%~90%。低发病土壤中子囊菌门,壶菌门丰度显著高于高发病土壤,而担子菌门丰度低于高发病土壤。
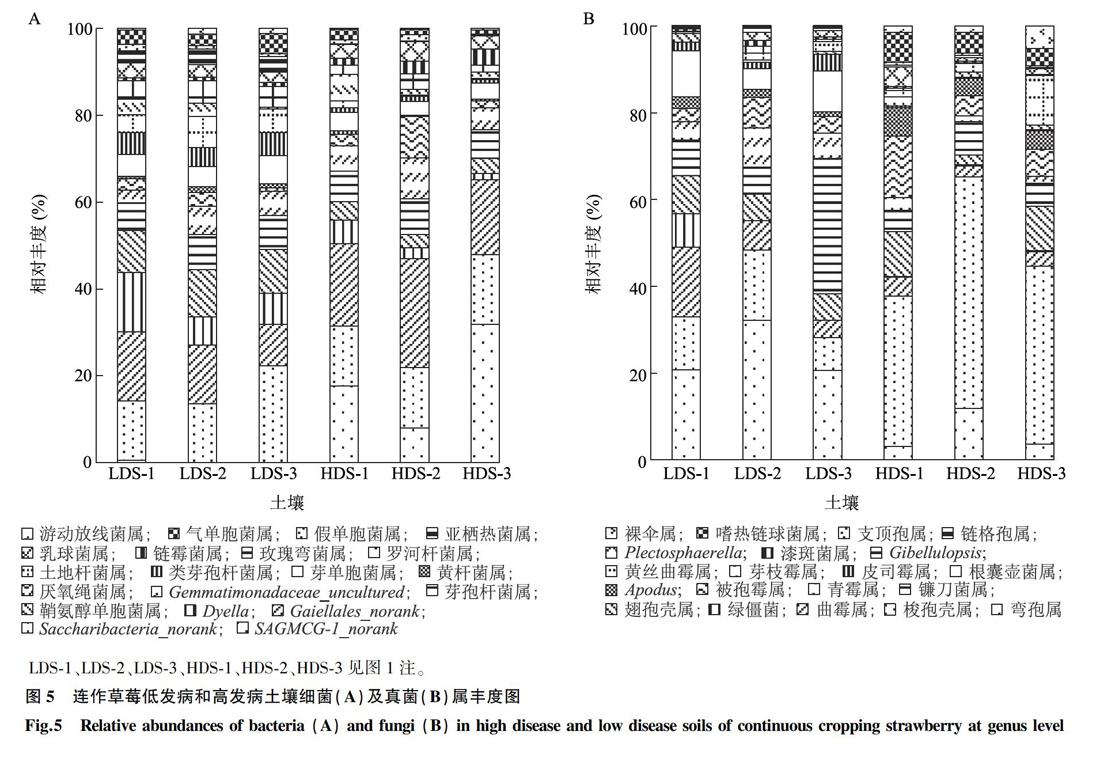
在属分类水平上,优势菌属和相对丰度如图5A所示,丰度较高的是Gaiellales_norank和Saccharibacteria_norank,在低发病土壤和高发病土壤中差异均不显著。低发病土壤中鞘氨醇单胞菌属(Sphingomons)、黄杆菌属(Flavobacterium)、类芽孢杆菌属(Paenibacillus)、游动放线菌属(Actinoplane)、气单胞菌属(Arenimonas)、亚栖热菌属(Meiothermus)、玫瑰弯菌属(Roseiflexus)丰度显著高于高发病土壤,且文献报道鞘氨醇单胞菌属[18-19]、黄杆菌属[20]、類芽孢杆菌属[21]和游动放线菌属[22]属中有益微生物,种群丰富,这些潜在的有益微生物种群可能是抑制土壤发病的重要因素之一,说明土壤的抑病能力形成与有益功能微生物种群及丰度有关。真菌优势菌属和相对丰度见图5B。低发病土壤中丰度最大的是弯孢属(Curvularia)、梭孢壳属(Thielavia)、曲霉属(Aspergillus)和镰刀菌属(Fusarium),约占 50%~60%,且Curvularia、青霉属(Penicillium)、皮司霉属(Pithomyces)丰度显著高于高发病土壤,镰刀菌属的丰度在低发病与高发病土壤中差异不显著。高发病土壤中梭孢壳属、裸伞属(Gymnopilus)、嗜热链球菌属(Mycothermus)丰度显著高于低发病土壤,梭孢壳属所占丰度比例最大,约为 20%~30%。值得注意的是镰刀菌属在LDS-3中丰度是最大的,绿僵菌属(Metarhizium)在LDS-1中丰度最大。
3 讨论
本研究通过试验验证了在低发病土壤中病原菌(尖孢镰刀菌)孢子萌发率显著低于高发病土壤,且低发病土壤与高发病土壤的理化性质亦呈现出不同的变化规律。适宜草莓生长的土壤pH值为5.8~6.5[23],本试验中各土壤样品pH值虽均属于草莓可生长的酸碱范围内,但总体上低发病土壤pH值高于高发病土壤,后者呈现酸化趋势。土壤团聚体的形成受到土壤理化性质及生物学特性的影响[24],土壤粒径分布结果显示,低发病土壤的大团聚体(>0.250 mm)含量显著高于高发病土壤,且土壤抑菌能力与土壤团聚体组成与稳定存在较好的正相关性。土壤中的有机碳,总氮和总磷等是土壤的主要养分,其含量在一定程度上影响了土壤团聚体的形成与稳定[25]。分析发现低发病土壤的EC值、总碳含量、总氮含量和总磷含量均高于高发病土壤,总氮含量与尖孢镰刀菌孢子萌发率呈极显著负相关,土壤的EC和总氮含量与大团聚体呈正相关。这表明低发病土壤中养分含量高于高发病土壤,丰富的土壤养分可促进土壤大团聚体的形成,塑造良好的土壤结构,从而增强土壤抑病作用。
土壤酶活性是反映土壤中各种生物化学综合作用的重要指标之一[26-28]。土壤过氧化氢酶可促进H2O2分解,降低H2O2对土壤中的生物及作物的毒害作用,试验中低发病土壤LDS-2、LDS-3过氧化氢酶活性高于高发病土壤,表明过氧化氢酶活性的增加对土壤抑病有积极作用。需要说明的是,在3个低发病土壤中LDS-1很特殊,其草莓根腐病发病率虽然低于15%,但是病原菌孢子萌发率和土壤团聚体分布均近似于高发病土壤,且LDS-1的过氧化氢酶活性与3个高发病土壤的酶活性亦相当,表明低发病土壤与高发病土壤不是一成不变的,可以转变,LDS-1很有可能正在向高发病土壤转化。
土壤微生物是土壤中最活跃的有机体,而微生物群落结构失衡是导致农作物减产、土壤质量退化的主要原因之一[29-32]。研究发现高发病土壤中尖孢镰刀菌数量显著高于低发病土壤。文献报道土壤中尖孢镰刀菌数量决定着植物枯萎病发生的程度,通常认为该病原菌数量的增长会加重枯萎病病害的发生[33]。沈宗专[34]通过主成分分析发现连作香蕉抑病型(低发病)土壤的细菌与真菌群落结构都明显不同于导病型(高发病)土壤,与本研究结果相似。分析结果表明,在门分类水平上,2类土壤主要菌群种类基本相似,其主要差异表现在菌群的丰度上。在属水平上低发病土壤中含量较高的鞘氨醇单胞菌属丰度显著高于高发病土壤,鞘氨醇单胞菌属是一种解毒菌属,对稠环芳烃、有机氯农药具有独特的降解能力,对有机磷、氨基甲酸酯、除虫酯也有很强的降解作用[18-19]。其次在低发病土壤中具有抗菌作用的功能性微生物类芽孢杆菌属、黄杆菌属和游动放线菌属[20-22]的丰度也显著高于高发病土壤,这些潜在的有益微生物可能是抑制土传病害发生的重要因素,进一步说明土壤抑病能力的形成与有益功能菌群和病原菌的丰度密切相关。研究结果有助于进一步了解低发病土壤形成的机制,为防控土传病害提供理论依据。
参考文献:
[1] 张瑞福,沈其荣. 抑病型土壤的微生物区系特征及调控[J]. 南京农业大学学报, 2012, 35(5): 125-132.
[2] COOK R J, ROVIRA A. The role of bacteria in the biological control of Gaeumannomyces graminis by suppressive soils[J]. Soil Biology and Biochemistry, 1976, 8(4): 269-273.
[3] MENG Q, YIN J, ROSENZWEIG N, et al. Culture-based assessment of microbial communities in soil suppressive to potato common scab[J]. Plant Disease, 2012, 96 (5): 712-717.
[4] 小林纪彦,朱熙樵. 抑病土壤及其抑病机制[J]. 世界农业, 1988(1): 42-43.
[5] 谢卓霖,李 芸,温云跃,等. 抑菌土在作物病害防治中的作用机制与土壤抑菌能力的测定方法[J]. 黑龙江农业科学, 2015(11): 67-70.
[6] BENIZRI E, PIUTTI S, VERGER S, et al. Replant diseases: bacterial community structure and diversity in peach rhizosphere as determined by metabolic and genetic fingerprinting[J]. Soil Biology and Biochemistry, 2005, 37(9): 1738-1746.
[7] 蔡燕飞,廖宗文,章家恩,等. 生态有机肥对番茄青枯病及土壤微生物多样性的影响[J]. 应用生态学报, 2003, 14(3): 349-353.
[8] WELLER D M, RAAIJMAKERS J M, GARDENER B B M, et al. Microbial populations responsible for specific soil suppressiveness to plant pathogens[J]. Annual Review of Phytopathology, 2002, 40: 309-348.
[9] 曾富春,黄 云,赵艳琴,等. 草莓枯萎病菌的生物学特性[J]. 四川农业大学学报, 2006,24(2):156-160.
[10]肖 蓉,邓 舒,张春芬,等. 连作草莓根际土壤特征及修复技术研究进展[J]. 中国农学通报, 2014, 30(19):81-85.
[11]沈 婷,楊 华,王世梅,等. 吸水链霉菌(Streptomyces hygroscopicus)B04固体菌剂对草莓生长及果实品质影响的研究[J]. 农业资源与环境学报,2016,33(1):49-54.
[12]沈 婷,张园园,王 辰,等. 白刺链霉菌(Streptomyces albospinus)CT205菌株固体发酵及防控草莓根腐病的研究[J]. 南京农业大学学报, 2015, 38(4): 596-601.
[13]吴小双,张亚波,吴盼盼,等. 温湿度及土壤类型对土壤中绿僵菌孢子萌发的影响[J]. 中国生物防治学报, 2014(6):766-771.
[14]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000:71-76.
[15]郭 吉,浦跃朴,尹立红,等. 太湖溶藻细菌的分离及评价[J]. 东南大学学报(自然科学版), 2006, 36(2): 293-297.
[16]PITZSCHKE A. Developmental peculiarities and seed-borne endophytes in quinoa: omnipresent, robust bacilli contribute to plant fitness[J]. Frontiers in Microbiology, 2016, 7(482): 2.
[17]张吉祥,凌 键,谢丙炎,等. 甘蓝枯萎病菌1号和2号生理小种的快速检测与鉴定[J]. 植物病理学报, 2014, 44(6): 586-594.
[18]欧阳主才,王奕恒,李小妮,等. 鞘氨醇单胞菌株XJ对农药的降解效能[J]. 华南农业大学学报, 2008, 29(2): 47-49.
[19]CHO O, CHOI K Y, ZYLSTRA G J, et al. Catabolic role of a three-component salicylate oxygenase from Sphingomonas yanoikuyae B1 in polycyclic aromatic hydrocarbon degradation[J]. Biochemical and Biophysical Research Communications, 2005, 327(3): 656-662.
[20]王 曦. 爱媛类芽孢杆菌南京分离株的鉴定及其体内外的抑菌活性[D]. 南京:南京农业大学, 2009.
[21]SANG M K, KIM K D. The volatile-producing Flavobacterium johnsoniae strain GSE09 shows biocontrol activity against Phytophthora capsici in pepper[J]. Journal of Applied Microbiology, 2012, 113(2): 383-398.
[22]李一青,李艳琼,李铭刚,等. 稀有放线菌产生的抗生素[J]. 中国抗生素杂志, 2008, 33(4): 193-197.
[23]张秀刚. 草莓基础生理及其栽培[M]. 北京:中国林业出版社, 1993.
[24]MONREAL C M, SCHULTEN H R, KODAMA H. Age, turnover and molecular diversity of soil organic matter in aggregates of a Gleysol[J]. Canadian Journal of Soil Science, 1997, 77: 379-388.
[25]王清奎,汪思龙. 土壤团聚体形成与稳定机制及影响因素[J].土壤通报,2005,36(3):415-421.
[26]高雪峰,韩国栋,张 功,等. 荒漠草原不同放牧强度下土壤酶活性及养分含量的动态研究[J]. 草业科学, 2007, 24(2): 10-13.
[27]卢维宏,张乃明,张 丽,等. 增效肥料对设施栽培小白菜生长及土壤酶活性的影响[J].南方农业学报,2019, 50(9):2022-2028.
[28]徐 彬,徐 健,祁建杭,等. 江苏省设施蔬菜连作障碍土壤理化及生物特征[J].江苏农业学报,2019,35(5):1124-1129.
[29]INSAM H, MITCHELL C C, DORMAAR J F. Relationship of soil microbial biomass and activity with fertilization practice and crop yield of three ultisols[J]. Soil Biology and Biochemistry, 1991, 23(5): 459-464.
[30]赵 帆,赵密珍,王 鈺,等. 草莓不同连作年限土壤养分及微生物区系分析[J]. 江苏农业科学, 2017, 45(16): 110-113.
[31]祖韦军,潘文杰,张金召,等. 耕作深度与翻压绿肥对植烟土壤微生物功能多样性及酶活性的影响[J].南方农业学报,2020, 51(10):2383-2393.
[32]马 丽,齐红志,闫 明,等. 生物炭对连作障碍条件下土壤微生物和草莓生长的影响[J]. 江苏农业科学,2019,47(17):142-146.
[33]何 欣,黄启为,杨兴明,等. 香蕉枯萎病致病菌筛选及致病菌浓度对香蕉枯萎病的影响[J]. 中国农业科学, 2010, 43(18): 3809-3816.
[34]沈宗专. 抑制香蕉土传枯萎病土壤的微生物区系特征及调控[D]. 南京:南京农业大学, 2015.
(责任编辑:陈海霞)
收稿日期:2020-11-13
基金项目:国家重点研发计划项目(2018YFD0500201);国家自然科学基金项目(41671256)
作者简介:李梦雅(1997-),女,安徽宿州人,硕士研究生,主要研究方向为土壤微生物。(E-mail)2018103126@ njau.edu.cn
通讯作者:王世梅,(E-mail)smwang@njau.edu.cn
