黄河源区建植19年人工草地生物结皮CO2通量与叶绿素荧光参数的变化
2021-09-17孙华方李希来李成一林春英金立群杨鑫光
孙华方,李希来*,李成一,张 静, 林春英,2,金立群,3,杨鑫光
(1.青海大学农牧学院,青海 西宁 810016;2.青海省人工影响天气办公室,青海 西宁 810001;3.湟源县草原站,青海 西宁 812100;4.青海民族大学生态环境与资源学院,青海 西宁 810007)
生物土壤结皮(Biological soil crusts,BSCs)又称生物结皮,是蓝藻、地衣、苔藓、真菌和细菌组成的复杂群落,这些结壳约占地球陆地面积的40%[1-2],被认为是世界上热、冷、干旱和半干旱地区的重要地表组成部分[3-5]。近年来,BSCs因具有较高的碳循环效率受到学者的广泛关注[6-8]。在干旱和半干旱地区,BSCs在生态系统碳固定和释放过程中起着关键作用。研究发现,在半干旱草原生态系统中,BSCs作为主要的碳源,所释放的碳占呼吸释放总量的43%[7],而在沙漠地区,BSCs固碳效果显著,通常被作为重要的碳汇[9-10]。
BSCs碳固定和释放受许多因素影响。根据发育水平和地壳优势类群,可以将BSCs分为藻、地衣和苔藓土壤结皮[11]。不同类型的BSCs碳通量具有差异。研究表明,蓝藻的BSCs碳通量为0.06~0.25 μmol·m-2·s-1[12],显著小于苔藓的碳通量(2.52 μmol·m-2·s-1)[13],这种差异可能跟BSCs自身组成有关。此外,BSCs还能够影响土壤和植被CO2排放。土壤CO2释放是指土壤碳酸盐风化、植物根系自养呼吸、土壤微生物的异养呼吸、菌根的分解代谢和土壤动物的呼吸作用的总和[14]。BSCs能够通过增加环境异质性如增加土壤养分含量和微生物数量对土壤CO2释放产生影响[15-16]。BSCs发育阶段与植被群落特征显著相关。研究表明,苔藓能够显著降低杂类草比例[17]。所以在草地中,不同发育类型的BSCs能够通过影响植物群落结构对草地生态系统CO2通量产生影响。目前BSCs对草地生态系统CO2通量的影响研究较少,不同类型的BSCs CO2通量数量特征和BSCs演替对土壤、植被以及草地CO2通量的影响还不清楚。
光合作用通常被用作衡量植被固碳能力的一个重要指标,在植被碳循环的研究中得到广泛关注。目前,许多学者通过测量植物组织的叶绿素含量来衡量植被光合潜力,但这种传统的方法会破坏植物组织,而叶绿素荧光技术具有快速测定和不对植物造成损伤等优点,逐渐被应用于植物光合生理特性的研究中[18-20]。BSCs叶绿素荧光变化具有不确定性,该过程很大程度上受到近地面小气候和土壤理化性质、土壤基质以及微生物群落组成的影响[21]。研究表明环境因子如污染物、干旱及光辐射是影响BSCs光合能力的关键因子,缺水与强光辐射均能够导致BSCs叶绿素荧光参数显著下降,降低BSCs光合速率[22-23]。此外,BSCs自身发育阶段的不同也会引起叶绿素荧光参数的差异,通常认为发育后期的BSCs具有更高的光合潜力[24]。黄河源退化黑土滩上建植的人工草地内分布着大面积的BSCs,但因局部环境差异如微地形和水热条件等导致BSCs类型和叶绿素荧光过程发生变化,不同类型的生物结皮叶绿素荧光参数变化特征以及关键影响因子还不清楚。
目前草地生态系统碳循环的研究多聚焦于高等维管束植物,植被群落之间的BSCs常被忽略,尤其在高寒地区黑土滩退化草地生态恢复中BSCs方面的研究鲜见报道。由于恢复治理黑土滩建植人工草地局部环境的差异性,导致生物结皮处于不同演替阶段,进一步增加了人工草地BSCs碳循环的复杂性。本研究通过测定黄河源区建植19年人工草地不同类型BSCs的光保护荧光参数Y(NPQ)(Non photochemical quenching,NPQ)、光损伤荧光参数Y(NO)(Fluorescence quenching)、叶绿素初始荧光参数F0(Minimal fluorescence)、最大荧光参数Fm(Maximal fluorescence)、PS Ⅱ最大光化学量子产量Fv/Fm(Optimal/Maximal quantum yield of PS Ⅱ)5个叶绿素荧光参数和植被群落以及土壤CO2通量,分析环境因子对叶绿素荧光参数和CO2通量的影响,以期了解人工草地中不同类型生物结皮的碳释放和碳固定变化规律,为后期评价BSCs对草地碳循环的贡献以及完善草地生态系统碳循环机制提供理论基础。
1 材料与方法
1.1 研究区域概况
研究区位于青海省东南部、果洛藏族自治州东北部阿尼玛卿山区玛沁县(98°45′~100°56′ E,33°43′~35°16′ N,海拔4 100~4 500 m)大武滩(图1)。该区属典型的高原山地地貌,气候类型属青藏高原寒冷气候,冬季长而干寒,夏季短而温湿;年平均气温为—3.9~3.8℃,最低气温达—31.4℃;年降水量 492.7 mm,是青海省降雨最多的地区之一,无绝对无霜期。
图1 试验样地地理位置
研究所用人工草地样地于2000年建成,面积约为1.75 hm2,海拔为3 735 m,由“黑土滩”退化草地机械翻耕并重新播种建成。农艺措施为:深翻—耙平—施肥—撒种—覆土—镇压—围栏封育。所播牧草混播品种有:垂穗披碱草(Elymusnutans)、青海冷地早熟禾(Poacrymophila)和青海中华羊茅(Festucasinensis),混播比例为2∶1∶1。牧草种子由当地草籽繁殖场生产,播量为45 kg·hm-2,施肥量为45 kg·hm-2(磷酸二铵复合肥),使用C-型肉毒素控制高原鼠兔种群数量[25-26]。人工草地建植之前的草地类型属于典型“黑土滩”退化草地,优势种莎草科植物被毒杂草取代,原生植被盖度不足10%,秃斑裸露地大面积存在。该地主要优势植物种为甘肃马先蒿(Ligulariavirgaurea)和铁棒槌(Aconitumpendulum),次要优势种为鹅绒委陵菜(Potentillaanserina)和细叶亚菊(Ajaniatenuifolia)。人工草地生长季内围栏封育不利用,每年12月至次年4月冬季放牧利用,放牧强度是4只羊·hm-2[27]。
1.2 研究方法
1.2.1植被调查方法 2019年8月在青海省玛沁县大武滩选择建植19年人工草地,依据外观形态和颜色等特征判断生物结皮类型,具体详见秦福雯等方法[28]。其中苔藓结皮分布最广泛,在人工草地中占比为40%左右,其次是地衣(占比15%左右),藻结皮和物理结皮分布较少(小于10%)。本文选择物理结皮(Physical Crust)和不同类型生物结皮如藻结皮(Algal Crusts)、地衣结皮(Lichen Crust)、苔藓结皮(Moss Crust)等为研究对象,调查人工草地中分布着不同生物结皮的群落分布特征。利用样方法调查各生物结皮演替阶段的群落结构,调查样方面积为1 m2。随机选择调查样方位置,目测估算样方内植被总盖度、各经济类群盖度,清点样方内各经济类群密度,钢卷尺测定植被高度;将地上生物量刈割并烘干测定干物质量;利用土钻(直径为3 cm)钻取0~10 cm深度土壤,洗去土壤获得0~10 cm土层中的根,烘干获得地下生物量干重。地上地下生物量烘干条件为烘箱65℃条件下将样品烘干48 h至恒重,使用电子天平称量获得地上、地下生物量干重。不同演替阶段的生物结皮(除物理结皮)的植被特征重复调查6次。
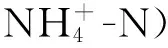
1.2.3BSCs呼吸和叶绿素荧光测定 利用土壤碳通量测量系统LI-8100A红外气体分析仪(美国,IR-GA)原位测定不同生物结皮演替阶段的植被+BSCs+土壤、BSCs+土壤、土壤和物理结皮CO2通量,CO2通量测定时间为上午9:00—11:00[29]。为减小误差,测量时需将气室垂直埋入土壤0.5~1.0 cm,测定90 s,记录CO2通量变化。各测定方法如下:植被+BSCs+土壤CO2通量,直接将气室垂直地面放置,测定CO2通量;BSCs+土壤CO2通量,在确保BSCs完整前提下,将气室内所有维管束植物全部去除,再测定;土壤CO2通量,继续将气室内所有BSCs去除,测定去除维管束植物和BSCs后地表的CO2通量;物理结皮CO2通量,直接将气室垂直地面放置,测定CO2通量。BSCs的CO2通量,利用BSCs+土壤CO2通量与土壤CO2通量的差值估算。利用基础型调制荧光仪Junior-PAM叶绿素荧光仪(德国,WALZ)测定3个演替阶段BSCs的叶绿素荧光参数。测量之前将待测BSCs暗反应20 min,用光强约1 500 μmol·m-2·s-1的饱和脉冲激发叶绿素分子[30],测定180 s,记录光保护Y(NPQ)、光损伤Y(NO)参数、最小荧光Fo、最大荧光Fm和Fv/Fm,注意测定时调节光纤末端距离测定样本1 mm左右。
1.3 数据处理与分析
本文数据利用Excel 2016对数据进行整理;利用SPSS 19.0对不同演替阶段BSCs CO2通量、叶绿素荧光参数、植被和土壤理化性质进行单因素方差分析、多重比较;利用Sigma Plot 14.0绘制不同演替阶段BSCs CO2通量和叶绿素荧光参数分布图;利用R4.0对不同演替阶段BSCs呼吸、叶绿素荧光参数与植被特征、土壤理化性质进行冗余分析,在RDA分析之前,对环境因子进行Hellinger转换,并对R2进行校正,最后绘制图。
2 结果与分析
2.1 不同类型BSCs的CO2通量和叶绿素荧光参数
对不同类型BSCs和植被CO2通量分析发现(图2):藻结皮和地衣结皮对应所处的植被和土壤群落(植被+BSCs+土壤)CO2通量分别为19.91 μmol·m-2·s-1和20.13 μmol·m-2·s-1,显著高于苔藓结皮CO2通量(15.87 μmol·m-2·s-1,P<0.05)。不同类型生物结皮的BSCs+土壤CO2通量变化趋势与植被+BSCs+土壤CO2通量变化相似,均为藻和地衣结皮类型显著高于苔藓(P<0.05)。但对比不同类型的BSCs CO2通量发现,苔藓有较高的CO2通量(10.58 μmol·m-2·s-1),显著高于地衣和藻结皮(P<0.05)。BSCs能够引起土壤呼吸速率发生变化,不同类型生物结皮下的土壤CO2通量不同。对比不同类型结皮下土壤CO2通量发现,所有类型生物结皮均能够提高土壤呼吸强度,其中藻和地衣结皮效果更显著(P<0.05),它们的CO2通量约是物理结皮土壤CO2通量的2倍,而苔藓下土壤CO2通量与物理结皮相近。
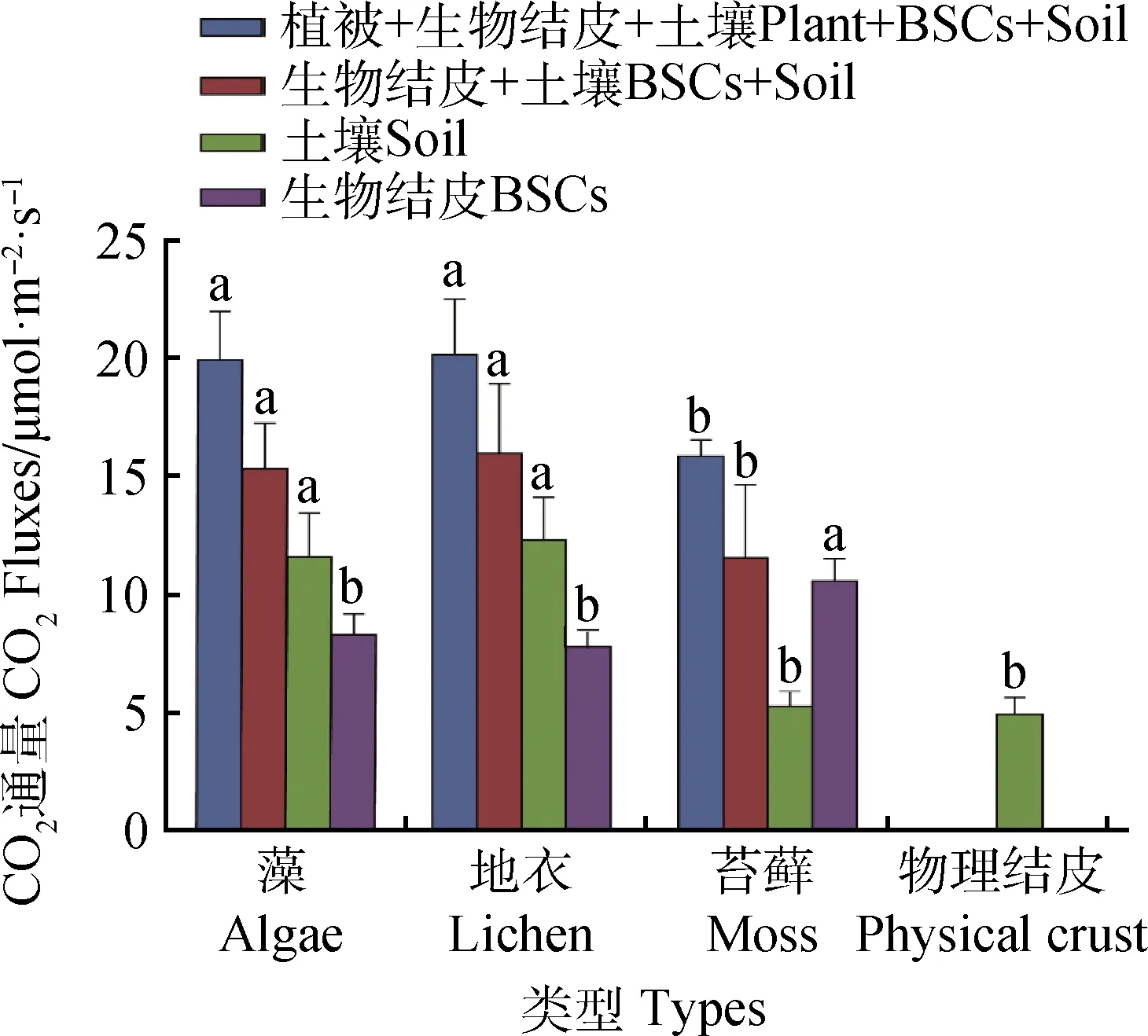
图2 不同类型BSCs CO2通量
图3为不同类型BSCs叶绿素荧光参数变化特征。由图3-I和3-II可知:不同类型BSCs的Y(NO)具有显著差异(P<0.05),其中地衣最高(0.567),苔藓最低(0.246)。不同类型BSCs的Y(NPQ)变化趋势不同,苔藓值最大,为0.605,约是地衣的2.4倍。图3-III和3-IV分别表示不同类型BSCs初始荧光参数(F0)和最大荧光参数(Fm)变化特征,从图中可以看出藻-地衣-苔藓过程中,F0和Fm逐渐增加,苔藓生物结皮的值最大,分别为135.16(F0)和286.5(Fm),显著高于藻和地衣结皮(P<0.05)。图3-V是不同类型BSCs光合潜力(Fv/Fm)大小变化特征,不同类型BSCs的Fv/Fm值排列顺序为苔藓>藻>地衣,彼此之间差异显著(P<0.05)。
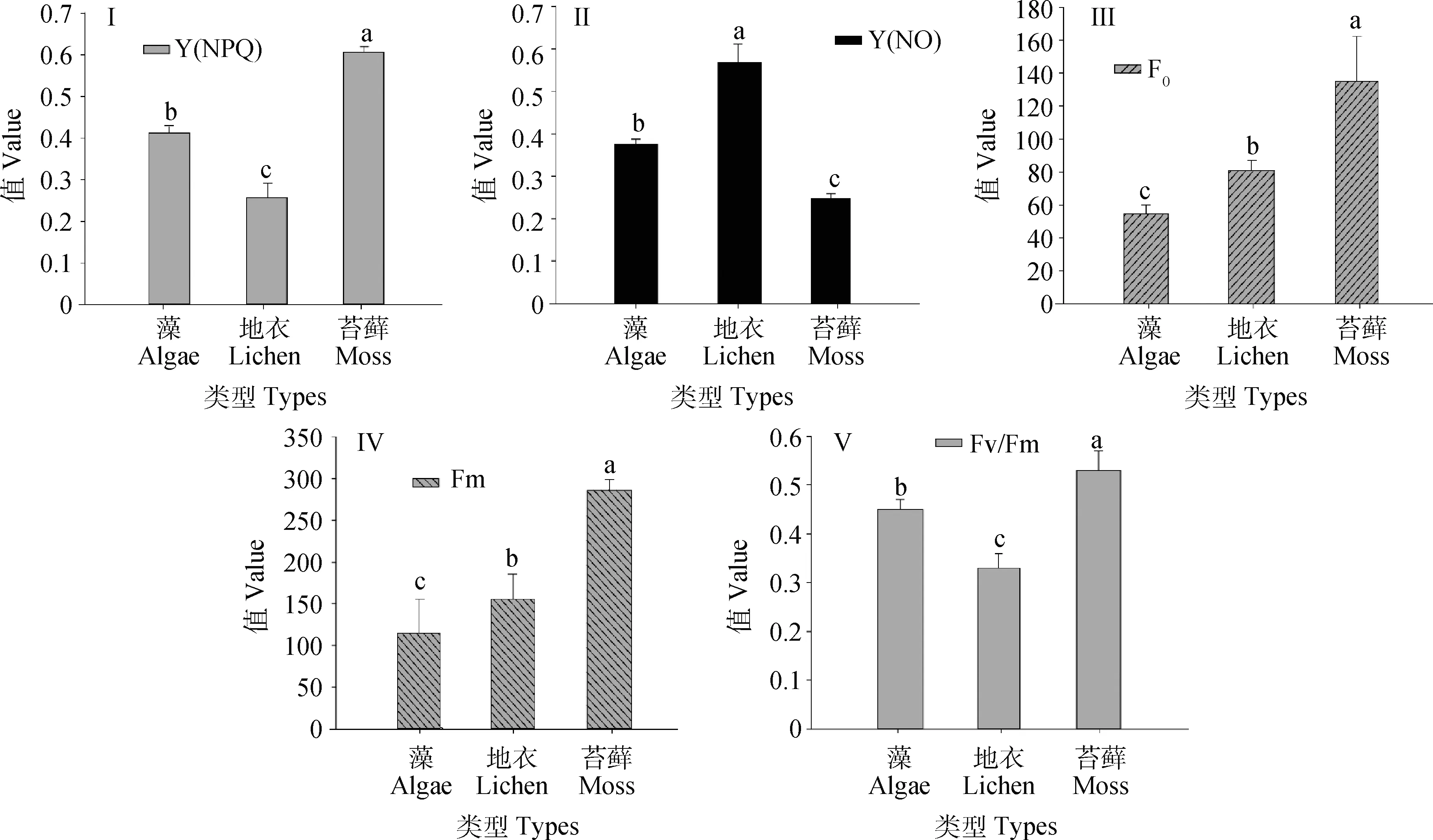
图3 不同类型BSCs叶绿素荧光参数
2.2 CO2通量、叶绿素荧光参数与环境因子关系
表1为不同BSCs阶段植被变化特征,从表中能够看出不同类型BSCs对应所处的植被特征有较大差异。就植被总盖度而言,苔藓阶段植被盖度最高,为72%,地衣阶段植被覆盖度最低,仅为29.17%,各BSCs阶段植被覆盖度差异显著(P<0.05)。分析不同类型BSCs的不同经济类群(禾本科、莎草科、杂类草)盖度和高度发现,就禾本科植物而言,苔藓阶段禾本科植物盖度和高度较其他经济类群大,分别为23%和19.05 cm;就莎草科而言,苔藓阶段莎草科盖度显著高于藻和地衣阶段(P<0.05),但高度没有表现出显著的优势。杂类草在苔藓阶段盖度最大(48.00%),显著高于地衣阶段。对比同一类型生物结皮不同经济类群盖度和高度发现,不同经济类群盖度高度特征表现出一定差异性。各BSCs演替阶段杂草盖度最高,而莎草科植物盖度最低。但各BSCs阶段禾本科植物高度均占优势,均显著高于其他两个经济类群(P<0.05)。就生物量而言,地衣阶段地上和地下生物量最高,分别为293.97 g·m-2和22.8 kg·m-3,其中地上生物量显著高于藻和苔藓结皮(P<0.05)。
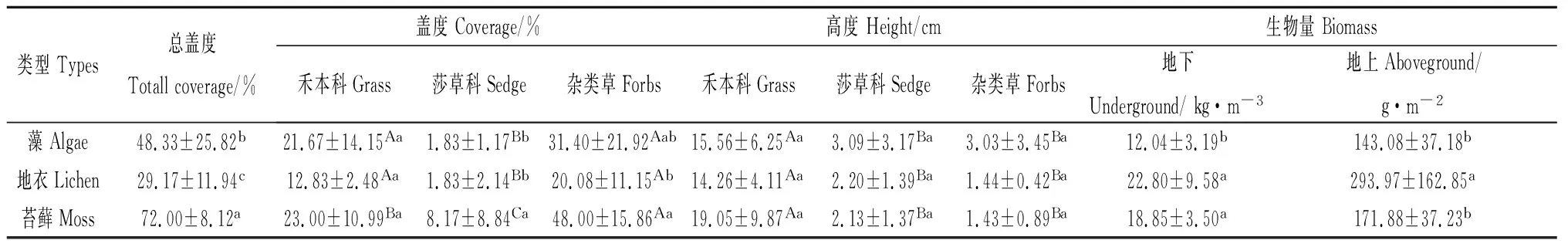
表1 不同BSCs类型植被分布特征
图4为不同类型BSCs阶段不同经济类群植被密度特征图。分析发现,地衣和苔藓阶段禾本科植物密度显著高于藻类阶段(P<0.05)。就莎草科植物而言,藻类和地衣阶段的莎草科植物密度显著低于苔藓时期(P<0.05);而杂类草密度在不同生物结皮阶段差异不显著。通过对比相同阶段生物结皮不同经济类群植物密度发现,各生物结皮阶段的莎草科植物均显著低于禾本科和杂类草植物密度(P<0.05)。

图4 不同生物结皮阶段各经济类群植被密度
不同类型生物结皮土壤理化性质分布特征见表2。由表可得,物理结皮土壤表层温度显著高于生物结皮覆盖下的土壤表层温度(P<0.05),即生物结皮对维持地面温度效果显著,同时对比不同类型BSCs发现,苔藓效果最好。就土壤体积含水率而言,不同类型的生物结皮均显著高于物理结皮表层土壤体积含水率(P<0.05)。苔藓类生物结皮保水能力最强,其覆盖下表层土壤体积含水率最高,为33.53%;地衣次之,藻类结皮效果较差,仅为25.35%。就电导率而言,物理结皮与地衣结皮之间差异显著(P<0.05)。苔藓结皮对改良土壤pH的效果较其他类结皮更好(P<0.05)。各类型生物结皮均能积累土壤养分,但不同类型生物结皮存在一定差异。其中苔藓和地衣对土壤全氮、全磷、铵态氮和速效磷的积累效果较好,而藻类对硝态氮、速效磷积累效果显著。
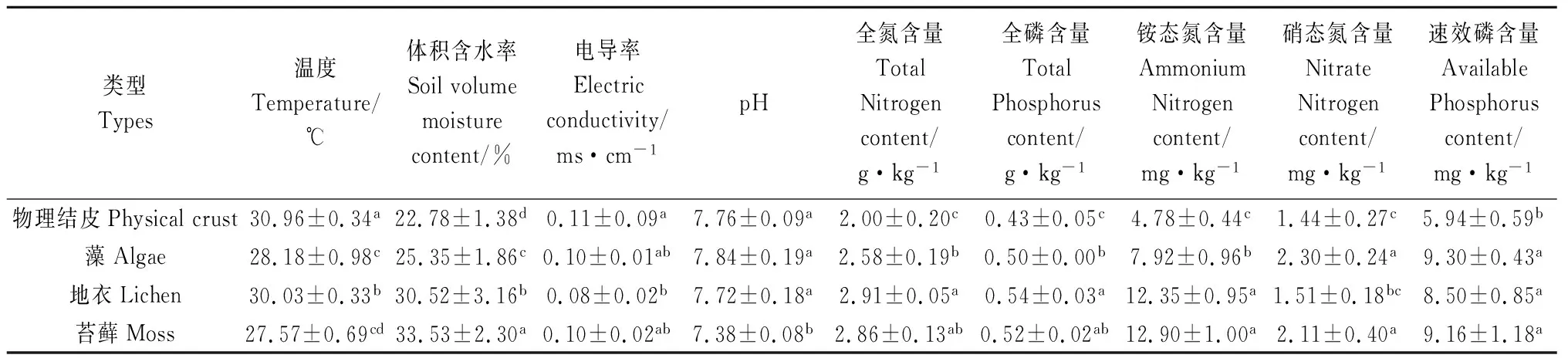
表2 不同BSCs类型土壤理化性质
图5为植被、土壤理化性质和土壤微生物与CO2通量的RDA排序图,从图可以看出RDA模型承载的总方差比例(R2)均达到了70%以上,其中植被—CO2通量RDA模型R2达到了82.91%。说明以上所有模型均能够较好解释环境因子与BSCs CO2通量的关系。植被分布的差异性会引起BSCs的CO2通量发生变化。由RDA排序可知植被中禾本科和杂类草的植被高度为主控因子,CO2通量与禾本科、杂草的植被高度呈现出较强的正相关关系(图5Ⅰ),表明禾本科和杂草植物的长高有助于提高不同BSCs演替阶段各类群的CO2排放速率。土壤理化性质中铵态氮含量与土壤pH为主控因子,其中铵态氮含量与CO2通量呈正相关关系,而土壤pH与CO2通量表现出较强的负相关关系,表明较多的速效养分和较低的土壤pH有利于促进各类群的生长呼吸(图5Ⅱ)。
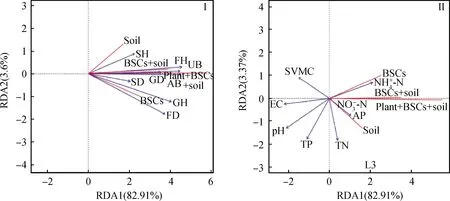
图5 CO2通量和环境因子的RDA排序

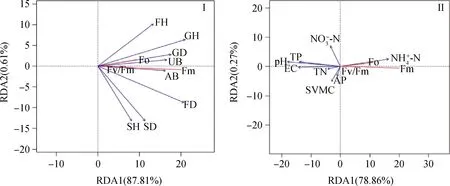
图6 叶绿素荧光参数和环境因子的RDA排序
3 讨论
3.1 不同类型生物结皮CO2通量的变化
不同发育和演替状态以及不同环境下BSCs的优势物种、生理、生化等特征各不相同[8],因此不同类型BSCs的CO2通量不同。一些研究表明,BSCs演替后期的苔藓结皮具有更高的呼吸速率[29,31],本文得出相似结论(图2)。研究表明CO2释放量和释放速率与有机体的生物量显著正相关[32],演替后期的苔藓具有较高的生物量,所以苔藓自身的CO2通量也较大。同时,BSCs也能增加土壤呼吸,但不同类型BSCs对土壤CO2通量的影响具有差异性,这种差异性可能是由于土壤中微生物群落的呼吸活动的不同所致[32]。研究发现,不同BSCs对微生物的积累具有差异性,藻和地衣类下微生物数量更多[33]。土壤微生物是释放土壤CO2的主要贡献者,微生物数量较多导致呼吸加强,土壤CO2释放速率也就较快。因此,藻和地衣结皮覆盖下的土壤会释放更多的CO2。除微生物数量外,外界环境因子也是影响土壤CO2通量的重要因子。与干旱半干旱地区相比,高寒地区人工草地相同演替阶段的生物结皮均具有更高的CO2通量[29,34]。与沙漠地区相比,黄河源区人工草地土壤具有较高湿度和养分含量,有利于促进BSCs物质量的积累,提高BSCs生理生化反应速率,而沙漠地区因受到水分及土壤养分条件的限制,该地区的土壤和BSCs的CO2通量较低。有研究表明水分是影响BSCs生长发育的首要影响因子[35-36],本文通过冗余分析得出不同结论。本文研究结果表明,在土壤理化性质中养分和pH为主要影响因子,可能是因为本试验样区地处黄河源地区,降水较充足,所以该地区水分不是首要限制因子,但土壤养分和pH是影响草地BSCs生长演替的重要驱动因子[37],所以二者可能通过影响BSCs演替对土壤以及BSCs本身CO2释放速率产生影响。
BSCs作为高寒地区人工草地演替过程中出现的重要伴生种,其碳循环功能的发挥与草地植被群落息息相关。冗余分析表明,禾本科植物是影响BSCs CO2通量的主控因子。作为高寒地区人工草地主要优势植物物种,禾本科植物的分布对BSCs和土壤CO2释放具有重要意义,禾本科植物能够通过积累土壤养分以及为BSCs生长提供合适的生存环境来促进BSCs生长发育[38],例如禾本科植物生长过程中能够为BSCs提供散射光以及降低土壤水分蒸发速率,从而缓解BSCs受到的光和干旱胁迫,使BSCs生理和生化活动均处于活跃状态,促进CO2释放。但禾本科植被的生长繁殖也会与BSCs形成竞争关系,如较多禾本科凋落物严重降低了BSCs盖度和厚度,特别是对苔藓影响最大。苔藓类植物体积累生物量的主要途径是光合作用,而较多凋落物使苔藓植物长时间处于遮光状态,不能进行光合作用,最终导致苔藓植物体死亡。生态系统中没有独立关系存在,植被影响BSCs的同时,BSCs也会影响植被生长。研究表明,苔藓阶段有较高的植被总盖度,但该生物结皮阶段植被总CO2通量最低(图2),所以苔藓可能能够影响植被群落结构特征,进而减少草地生态系统CO2的排放。
3.2 不同类型生物结皮叶绿素荧光参数的变化
BSCs光合活性或光和潜力受自身组成的影响[39]。不同类型的BSCs群落光合优势种具有差异性,导致生物结皮光合能力的不同。有研究指出,藻结皮的Fv/Fm约为0.4,而苔藓结皮的Fv/Fm超过0.5,显著高于藻结皮[24],本研究也得出相似结论(图3-V)。这可能是因为藻结皮阶段主要的光合生物是蓝藻(原核生物)和藻类植物[40],而苔藓阶段光合生物主要是苔藓。原核生物蓝藻中,由于缺乏叶绿体结构,光合作用和呼吸中的电子转移都发生在类囊体膜内,两个电子转移链同时共享大量的电子转移中间体,在一定程度上降低了光合电子传递效率[41],导致光合效率降低。而演替后期的苔藓具有独立的呼吸和光合场所,光合电子传递效率较其他类型生物结皮高,所以苔藓阶段光合效率高。
藻类、地衣和苔藓都属于光合生物,这些光合生物主要通过光合色素(如叶绿素和藻蓝蛋白)吸收和转化光能,所以光合色素含量也是影响植被光合作用的关键因子。不同类型的BSCs群落的色素分子不同,故其光能转化效率具有一定差异[42]。研究发现,与演替后期的苔藓类生物结皮相比,藻类结皮中的光合生物量较低,各种光合色素如叶绿素A和B含量也较低,故表现出较低的F0,Fm和Fv/Fm,该结果与Pushkareva等研究结果相似[43]。而在苔藓阶段,苔藓占据光合生物量的90%以上,该阶段的光合生物量和光合体中的光合色素含量显著高于藻类[44],光合能力增强,叶绿素荧光参数如F0,Fm和Fv/Fm增加,显著高于藻结皮(约2倍)。同时,BSCs抗逆性(抗光损害)的强弱也对BSCs光合作用有显著影响。不同类型的BSCs的Y(NO),Y(NPQ)不同。Y(NO)、Y(NPQ)分别是光损伤和光保护重要指标。本文研究表明地衣类结皮具有高的Y(NO)和低的Y(NPQ)值,说明地衣对光调节和抗光损害和忍受强光的能力最差,可能是因为地衣类结皮色素含量最低,而植物的光保护色素如类胡萝卜素含量缺失导致地衣结皮在受到较强的光胁迫时,有机体内没有足够的色素来消除组织内过多的活性氧化物(ROS)[45],地衣结皮受到光损伤,最终引起有机体光合能力下降。苔藓的Y(NPQ)指数显著大于地衣和藻结皮(图3-I),可能是因为苔藓的丝核菌素合成能力的提升,其基内菌丝产生各种水溶性或脂溶性的色素从而增强BSCs抵抗强光胁迫能力[46]。青藏高原地区海拔高,光辐射强度大,BSCs容易受到光胁迫,生理生化活动降低,所以在该地区散射光的形成和利用对BSCs生长演替以及光合等生理作用十分重要。冗余分析发现,在黄河源区人工草地中优势种禾本科植物(表1)的高度是影响BSCs叶绿素荧光参数的主控因子。较高的植被高度能够减小BSCs被太阳辐射直射的机会,有利于BSCs在避免强光胁迫的同时高效的进行光合作用。同时,青藏高原上BSCs对非降水形式的水资源的利用也十分重要,较高的植被有利于凝结水的形成,在非降水时期为BSCs提供充足水资源进行光合作用。研究发现,苔藓本身也能够显著提升土壤湿度(表2),促进自身和禾本科植物生长(表1),能够进一步优化BSCs生长和光合的条件。因此,高寒地区人工草地中禾本科植物与BSCs互利生长。土壤理化性质中,铵态氮以及pH为主控因子(图6Ⅱ)。养分和土壤pH显著影响BSCs生长和演替[47-48],如养分充足有利于苔藓的建植,藻类BSCs更趋向于土壤pH低的地方生长[49],故pH低的地方多分布藻结皮,光合效率较低。
4 结论
高寒地区人工草地中苔藓结皮CO2通量最大,但苔藓阶段植被群落和土壤CO2通量最低,故苔藓有利于减少草地系统碳的外排。苔藓能促进禾本科和土壤养分恢复,地衣有效积累了人工草地地下生物量,而藻类与莎草科植物的恢复息息相关,所以生物结皮有利于促进黑土滩的生态恢复;苔藓较其他类型BSCs具有更大的光合和抗逆潜力;禾本科高度和盖度、铵态氮含量和pH均是BSCs呼吸和光合作用的重要影响因子。综上,生物结皮尤其是苔藓结皮提高了人工草地碳源能力,同时对促进黑土滩退化草地向高寒草甸的演替有积极重要的作用。
