MiR-494通过核转录因子-κB通路对脓毒症大鼠肾损伤的作用机制*
2021-09-17樊晶晶朱一堂
卢 鹏 张 雷 樊晶晶 李 菁 朱一堂
(沧州市中心医院,1 检验科,2 急诊医学部,3 眼功能科,沧州 061001)
脓毒症是临床常见的由感染引起的全身炎症反应综合征,表现为全身炎症反应,常见有尿道感染、脑部感染等[1]。脓毒症通常发生有手术史或者是烧伤患者,约50%脓毒症患者出现肾损伤[2-3]。有研究显示,脓毒症的发病率很高,在重症监护患者中其发病率约为30%,且还在逐年增长[4]。微小RNA(microRNA,miR)是一类内源性小分子非编码RNA,在转录后调控基因的表达。miR-494 是miR 家族中的一员,可能是调控细胞的生长、转移的重要因子[5]。核转录因子-κB(nuclear factor-κB,NF-κB)为一种蛋白因子,与细胞凋亡和基因转录调控有关,能够调控炎症因子、趋化因子及凋亡相关基因[6]。NF-κB 通路参与脓毒症大鼠肾上皮细胞的凋亡和炎症反应的过程[7]。因此,本研究旨在探讨miR-494 通过NF-κB通路对脓毒症大鼠肾损伤的作用机制。
1 材料和方法
1.1 实验动物与分组
45 只健康雄性SD 大鼠购自辽宁动物实验中心,体质量270~330 g。常温下饲养,让大鼠适应7 d 新的环境。将45 只大鼠随机分为脓毒症大鼠模型组(模型组),注射miR-494 inhibitor 脓毒症大鼠模型组(miR-494 inhibitor 组)、假手术组(sham组),每组15 只。
1.2 模型建立与标本采集
3 组大鼠均经10%苯巴比妥钠麻醉后开腹,模型组和miR-494 inhibitor 组大鼠常规脱毛、消毒后,逐层分离皮肤,分离右肾蒂及输尿管,采用1 号丝线,结扎肾蒂和右输尿管,继续分离左肾,采用无创伤性夹钳闭合肾动脉35 min,后逐层关闭腹腔,建模过程中1 只大鼠死亡,假手术组动物打开腹腔,并进行左、右两肾分离肾包膜后即可。miR-494 inhibitor 组在造模成功后大鼠尾部注射miR-494 inhibitor 5 μL,连续注射3 d。第4 天处死3 组大鼠,分离肾。采用甲醛固定60 min,常规脱水、浸蜡、制片,厚度为3~4 μm。
1.3 RT-PCR 检测大鼠肾组织中miR-494 的表达
分别将3 组大鼠的肾组织取出,用TRIzol 裂解研磨后的组织,提取总的RNA,逆转录按照说明书严格进行,将逆转后所得的cDNA 进行荧光反应实验。miR-494 上游引物序列为5'-ACACTCCA GCTGGGAGGTTGTCCGTGTT-3',下游引物序列为5'-CTCAACTGGTGTCGTGGAGTCGGCAATT-3';GAPDH 上游引物序列为5'-CATGAGAAGTATG ACAACAGCCT-3',下游引物序列为5'-AGTCCT TCCACGATACCAAAG T-3'。所有反应严格按照反应的条件进行扩增,95℃变性30 s,60℃退火30 s,72 ℃延伸1 min,共30 个循环。由仪器自带软件获取Ct 值,按公式2-△△Ct计算miR-494 表达量。
1.4 全自动生化分析仪测定大鼠血清生物化学指标
建立脓毒症模型24 h 后,分别取3 组大鼠静脉血2 mL,检测血清肌酐(Scr)和尿素氮(BUN)水平,在笼内收集大鼠尿液,收取上清液,测量24 h 尿蛋白定量(UTP)的含量。
1.5 ELISA 法检测大鼠血清炎症因子水平
将3 组大鼠静脉血进行常规方法取血清,采用ELISA 法检测3 组大鼠血清中肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)水平,取平均值。
1.6 Masson三色法分析大鼠肾组织病理结构
取3 组大鼠肾组织切片,8%甲醛在低温下进行48 h 处理,无水乙醇脱水,二甲苯透明,石蜡切片2 μm。脱石蜡后清水清洗,采用Masson 三色法试剂盒(上海信帆生物科技有限公司)染色,无水乙醇脱水,二甲苯透明,树胶封固。显微镜下观察肾组织病理变化[8]。
1.7 TUNEL 检测肾小管细胞凋亡
取3 组大鼠肾组织浸蜡包埋制做石蜡切片,厚度为2 μm。采用TUNEL 将切片进行染色,每张切片选择不重复的5 个方位用显微镜(×400)进行观察,计数肾小管凋亡细胞数目和细胞总数[9]。肾小管细胞凋亡=凋亡细胞/总细胞×100%。
1.8 免疫印迹检测肾组织NF-κB 蛋白含量
取3 组大鼠的50 mg 肾组织,细胞裂解后提取核蛋白,对核蛋白的浓度进行定量,分装后,保存在-20℃的环境中。将提取出的蛋白溶液和缓冲溶液按照4∶1 的比例进行混匀,煮沸使蛋白质变性。电泳板孔内注入蛋白样品50 μg。转移至PVDF 膜上后加脱脂奶粉,封闭1 h 后再在30 min 内漂洗3次,最后加入兔抗鼠NF-κB 抗体(1∶1 000,厦门慧嘉生物科技有限公司)1 h。取出PVDF 膜后再漂洗3 次,每次10 min,用博士德生产的DAB 试剂盒及ECL 化学发光试剂盒进行显影、定影,计算目的条带与GAPDH 比值,求得NF-κB 蛋白的相对表达含量。
1.9 统计学处理
采用SPSS22.0 软件进行统计学分析。计量资料以±s表示,组间两两比较采用t检验,3 组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 肾组织中miR-494 的表达
与假手术组相比,模型组及miR-494 inhibitor组大鼠肾组织中miR-494 表达量均升高(P<0.05),但miR-494 inhibitor 组大鼠miR-494 表达低于模型组(P<0.05)(图1)。
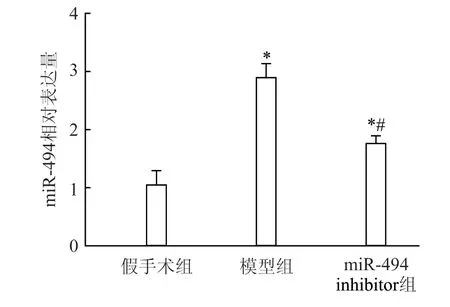
图1 3 组大鼠肾组织中miR-494 的表达情况
2.2 血清炎症因子表达
假手术组大鼠IL-6、TNF-α和IL-1β的表达最低,模型组大鼠IL-6、TNF-α和IL-1β的表达最高。与模型组相比较,miR-494 inhibitor组大鼠IL-6、TNF-α和IL-1β的表达显著降低。与假手术组相比,miR-494 inhibitor组的表达显著升高(P<0.05)(表1)。
表1 3 组大鼠炎性因子表达情况(n=15,±s,mg/L)
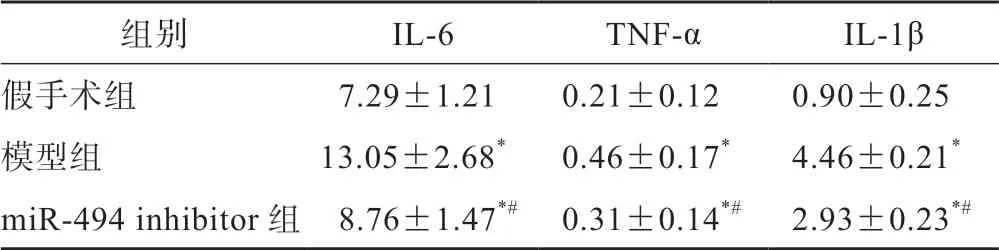
表1 3 组大鼠炎性因子表达情况(n=15,±s,mg/L)
*P<0.05 vs 假手术组;#P<0.05 vs 模型组
组别IL-6TNF-αIL-1β假手术组 7.29±1.210.21±0.120.90±0.25模型组13.05±2.68*0.46±0.17*4.46±0.21*miR-494 inhibitor 组 8.76±1.47*# 0.31±0.14*#2.93±0.23*#
2.3 肾组织病理比较
假手术组肾组织结构完整,肾小管等状况良好。MiR-494 inhibitor 组肾小球间质增多,肾间质增宽,炎症细胞浸润严重。模型组与miR-494 inhibitor 组相比,肾小球硬度增加,肾小管周围组织炎症浸润更加严重(图2)。
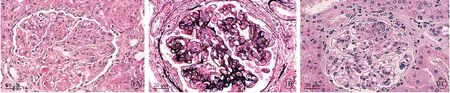
图2 大鼠肾组织病理结构比较,标尺=20 μm。A:假手术组;B:模型组;C:miR-494 inhibitor 组.
2.4 生物化学指标比较
与假手术组相比,模型组和miR-494 inhibitor组大鼠血清中Scr、BUN 和UTP 的水平均明显升高(均P<0.05);与模型组相比,miR-494 inhibitor 组大鼠血清中Scr、BUN 和UTP 的水平降低(P<0.05)(表2)。
表2 3 组大鼠生物化学指标比较(n=15,±s)

表2 3 组大鼠生物化学指标比较(n=15,±s)
*P<0.05 vs 假手术组;#P<0.05 vs 模型组
组别Scr(nmol /L)BUN(mmol/L)UTP(mg)假手术组31.59±3.653.67±1.731.07±0.24模型组48.64±2.52*12.17±2.14*2.15±0.34*miR-494 inhibitor 组40.05±2.68*#7.15±2.10*#1.66±0.28*#
2.5 miR-494 对肾小管上皮细胞凋亡的影响
棕黑色细胞为凋亡细胞。与假手术组相比,模型组大鼠肾小管上皮细胞的凋亡数目显著增多(P<0.05),miR-494 inhibitor 组中大鼠肾小管上皮细胞的凋亡数目少于模型组(P<0.05)(图3、4)。
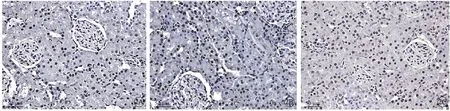
图3 大鼠肾小管上皮细胞凋亡情况,标尺= 50 μm。A:假手术组;B:模型组;C:miR-494 inhibitor 组.
2.6 肾组织中NF-κB p65 蛋白表达
模型组NF-κB p65 蛋白含量最高,miR-494 inhibitor 组中大鼠NF-κB p65 的蛋白含量比假手术组的蛋白含量高(P<0.05),但较模型组NF-κB 明显降低(P<0.05)(图5)。
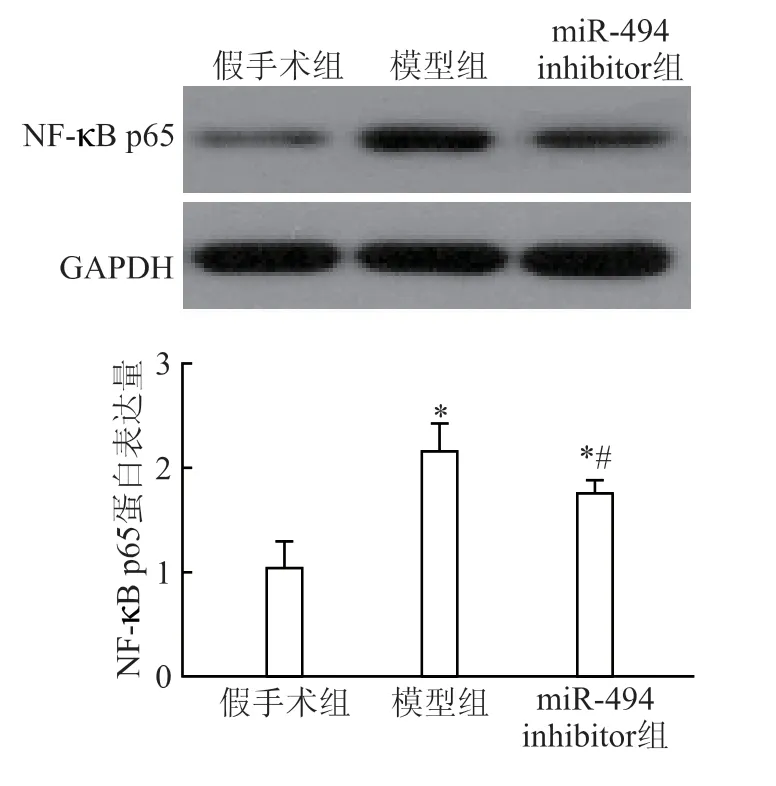
图5 大鼠肾组织中NF-κB p65 蛋白表达
3 讨论
脓毒症是细菌在血液中繁殖,释放毒素所引起,致死率高[10]。其中,大手术、烧伤、感染等是临床中并发脓毒症的较常见原因[11]。脓毒症可能会累及机体多个器官功能受到损害,死亡率可达30%左右[12]。本研究结果显示,假手术组大鼠IL-6、TNF-α 和IL-1β 的含量最低,脓毒症组大鼠IL-6、TNF-α 和IL-1β 的含量最高,miR-494 inhibitor 组大鼠IL-6、TNF-α 和IL-1β 的含量较脓毒组有所降低。病理组织观察到假手术组肾组织结构完整,miR-494 inhibitor 组肾小球间质增多,炎症细胞浸润严重;模型组与miR-494 inhibitor 组相比,肾小球硬度增加,肾小管周围组织炎症细胞浸润更加严重。研究表明miR-494 是一种可以影响细胞活性的miR,它可根据细胞所处的环境和作用靶点的变化,既可发挥促凋亡作用,又可发挥抗凋亡的作用,同时还可以调控炎症因子[13]。研究显示,miR-494 可以通过多种途径参与肾缺血再灌注损伤炎症反应的调控。小鼠肾小管上皮细胞在经过脂多糖刺激后,小鼠体内miR-494 的表达出现异常,多种炎症相关因子表达变化,表明miR-494 参与肾损伤的炎症反应[13]。动物实验得出,miR-494 过表达会增加大鼠肾组织及细胞的损伤,从而影响肾功能[15]。同时,miR-494 能提高脓毒症大鼠的炎症因子水平,损伤肾功能,显微镜观察肾组织病理形态的变化也证明了这一观点[16]。
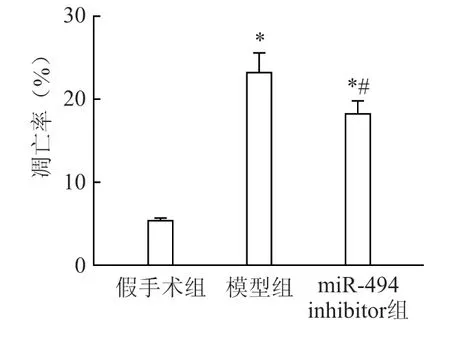
图4 大鼠肾小管上皮细胞凋亡率
本研究结果显示,模型组大鼠Scr、BUN 和UTP 水平升高,而miR-494 inhibitor 组上述指标有所降低,但仍然比假手术组高。Scr 与肾小球过滤功能具有关联,Scr 处于非稳定期,意味着肾功能发生改变[17]。有研究指出Scr、BUN 和UTP 水平升高提示肾存在缺血现象,是评价肾损伤患者的敏感指标[18]。
本研究通过病理、肾小管细胞凋亡程度和肾组织中NF-κB 蛋白表达情况表明,miR-494 inhibitor组大鼠中肾小管上皮细胞的凋亡数目比模型组少,比假手术组多;miR-494 inhibitor 组大鼠的NF-κB蛋白表达比模型组低,但比假手术组的NF-κB 蛋白表达高。结果提示miR-494 能够通过提高NF-κB 的表达来促进炎症因子的释放,进而促进肾小管细胞凋亡,加重脓毒症患者病情。尽管miR-494 对脓毒症大鼠的作用机制目前尚不明确,但许多学者认为NF-κB 通路在此过程成中发挥重要作用。NF-κB 是一种纤维细胞产生的促炎症因子,参与调节免疫及炎症反应,也是一种调节细胞凋亡因子,在调节肾上皮细胞凋亡方面发挥重要作用。miR-494 是一种能够参与免疫反应的调控因子,它可以活化组织中的STAT3 和NF-κB 等信号通路,促进NF-κB 的表达,进而促进炎症因子的释放。近些年,关于miR参与肾病理改变的研究越来越多,在一项关于对肾损伤大鼠肾组织的miR 筛查过程中,miR-494 表达升高,这说明miR-494 与肾损伤存在关联性[19]。细胞及动物实验研究表明,在脓毒症模型中miR-494 表达升高会加重模型大鼠肾小管上皮细胞凋亡,对大鼠皮下注射miR-494 抑制剂后,肾损伤有所缓解[20]。有文献报道脓毒症大鼠肾组织高表达miR-494,是健康大鼠肾组织中的2~3 倍以上,随着miR-494 升高,脓毒症大鼠中炎症因子水平逐渐升高,病情恶化[21-22]。
综上所述,miR-494 可能通过提高NF-κB 的表达,促进脓毒症大鼠炎症因子的释放,进而加重大鼠的肾损伤程度。
