成纤维细胞生长因子受体4基因沉默对口腔鳞癌细胞增殖和凋亡的影响及其作用机制*
2021-09-17董庆旭赵郑莉
董庆旭 赵郑莉
(河南医学高等专科学校附属医院口腔科,郑州 451100)
口腔鳞癌约占所有口腔癌的90%[1],多种基因突变的积累会导致口腔上皮细胞发展为癌症[2],患者5年生存率低于50%[3]。因此,研究口腔鳞癌的发生发展机制非常重要。研究证实,成纤维细胞生长因子受体4(fibroblast growth factor receptor 4,FGFR4)在胚胎发育、血管生成中起关键作用[4]。FGFR4 在肿瘤中的高表达[5]、多态性与肝癌的转移相关[6]。RAS/RAF/MAPK 通路能够在细胞核中激活特定的基因促进细胞生长和分化[7],参与肿瘤细胞增殖和凋亡[8]。RAS 是突变最频繁的致癌基因,40%食管癌患者具有RAS 扩增的特点[9],大约50%的乳腺癌与RAS 的高表达密切相关[10]。RAF 进一步促使MAPK 磷酸化信号级联激活,诱导特定基因转录[8]。蛋白激酶MAPK 是RAS/RAF/MAPK 通路的核心成分,在细胞增殖、分化等程序中发挥重要作用[11]。阐明RAS/RAF/MAPK 通路的调控机制有助于明确肿瘤的发展机制。FGFR4 过表达可活化GRB2 和SOS 蛋白,进而激活RAS/RAF/MAPK通路[12]。因此本研究探究下调FGFR4 基因的表达与RAS/RAF/MAPK 信号通路的调节作用及对口腔鳞癌增殖和凋亡的影响。
1 材料和方法
1.1 组织样本、细胞株及主要试剂
收集本院于2018年4月至2019年8月收治的口腔鳞癌患者的32对肿瘤组织样本和癌旁非癌组织。所有患者术后病理诊断为口腔鳞癌,术前未行化疗或放疗,具有完整病史记录,且所有患者已签署知情同意书。组织样本均保存于-80℃,使用时同时处理肿瘤组织及非肿瘤样本组织。人正常口腔上皮细胞HOEC购自上海弘顺生物科技有限公司;人口腔鳞癌细胞CAL-27和HSC-2均购自上海酶研生物科技有限公司;SACC-83细胞购自江阴雨汐生物科技有限公司。胎牛血清、胰蛋白酶、RPMI-1640培养基、MEM培养基和DMEM培养基、qRT-PCR试剂盒、细胞凋亡检测试剂盒购自赛默飞世尔科技(中国)有限公司;TRIzol试剂购自上海联迈生物工程有限公司;Bcl-2、Bax、RAS、RAF、MEK、p-MEK、ERK1、p-ERK1和FGFR4抗体购自Abcam公司;二抗(羊抗兔)购自美国CST公司;显影液和定影液购自碧云天生物科技有限公司;细胞周期检测试剂盒购自上海研卉生物科技有限公司。
1.2 细胞培养
人正常口腔上皮细胞HOEC 用RPMI-1640(15%胎牛血清)培养基在37 ℃、5 % CO2的条件下于培养箱中培养;SACC-83 细胞用MEM(15%胎牛血清)培养基在37 ℃、5 % CO2的条件下于培养箱中培养;CAL-27 细胞和HSC-2 细胞用DMEM(10%胎牛血清)在37 ℃、5 % CO2的条件下于培养箱中培养。
1.3 细胞转染
收集对数生长期SACC-83 细胞,以每孔3.5×106个细胞接种于6 孔板内过夜培养。细胞分为3 组:空白组、siNC 组和siFGFR4 组。空白组细胞不作任何处理,siNC 组和siFGFR4 组细胞中分别将20 ng 的siNC 和siFGFR4 质粒分别与15 μL 的LipofectamineTM2000 混合,加入孔内,置于37 ℃、5 % CO2的细胞培养箱中。转染24 h 后,收集细胞。
1.4 qRT-PCR 检测FGFR4 mRNA 表达水平
利用TRIzol 试剂提取细胞的RNA,RNA 样品中加入100 μL 氯仿充分混匀后,4 ℃ 12 000 r/min 离心15 min,上层液体中加入新无RNA 酶离心管,加入等体积异丙醇,混匀后-20℃静置10 min,离心10 min,弃上清,加入无水乙醇清洗沉淀,重复清洗1 次,弃上清,加入20 μL RNase-free 水溶解RNA。反转录根据qRT-PCR 试剂盒说明进行。将逆转录产物进行qRT-PCR 检测,反应体系为:cDNA 模板2 ng,上下游引物各0.4 μL,SYBR Primix Ex TaqTM5 μL,ddH2O 补充至10 μL。扩增结果根据2-△△Ct法计算FGFR4 mRNA 的相对表达量。FGFR4 上游引物序列为5'-TCCTACCTGAGGATGCTGGCCGCT-3',下游引物序列为5'-ACCGTCGGCTCCGAAGCTGCTGC CGA-3';β-actin 上游引物序列为5'-CCGTTGCCC TGAGGCTCTTT-3',下游引物序列为5'-GATCTG TCTGTCTTCTGTCTC-3'。
1.5 免疫印迹检测FGFR4、Bcl-2、Bax、RAS、p-MEK和p-ERK1 蛋白表达水平
将RIPA 裂解液加入细胞中裂解蛋白,利用BCA 法检测细胞蛋白浓度。SDS-PAGE 凝胶电泳分离等量蛋白后转膜。利用5%脱脂牛奶4℃封闭1 h,加鼠抗人的Bcl-2、Bax、RAS、RAF、MEK、p-MEK、ERK1、p-ERK1 抗体(1∶2 000)和FGFR4 抗体摇床4℃孵育过夜,TBST 洗膜5 min,4 次,加入HRP 标记的兔抗鼠二抗(1∶1 500)37 ℃孵育1 h,TBST 洗膜5 min,4 次。显影曝光后,通过Image-Pro Plus 系统分析蛋白条带灰度值,计算(目的蛋白/β-actin)的比值。
1.6 免疫组织化学检测FGFR4 的表达
将获得的肿瘤组织样本和癌旁非肿瘤组织进行常规石蜡切片,切片脱蜡后蒸馏水浸洗1 min 后,对切片进行抗原修复,滴加3%的过氧化氢于切片组织上,室温孵育10 min,PBS 冲洗5 次,每次2 min。滴加稀释好的山羊血清,孵育40 min,去除玻片周围液体,滴加鼠抗人FGFR4 抗体,置于4℃孵育过夜。PBS 冲洗切片5 次,每次2 min,去除玻片周围液体,滴加二抗37℃孵育25 min。PBS冲洗切片,滴加DAB 显色液,自来水冲洗终止染色后,Harris 苏木精复染45 s,水洗后用1%的盐酸乙醇分化,再用自来水水洗返蓝。将切片置于无水乙醇Ⅰ-无水乙醇Ⅱ-二甲苯Ⅰ-二甲苯Ⅱ脱水后,平置于通风橱晾干,镜检拍照。
1.7 克隆形成实验检测SACC-83 细胞的增殖
胰蛋白酶消化对数生长期细胞,完全培养基重悬细胞后计数。以每孔800 个细胞接种于6 孔板内,置于37 ℃、5 % CO2的细胞培养箱中培养,每3 d更换培养基并观察细胞,在6 孔板底部对单克隆细胞标记。培养8 d 后观察细胞,弃上清,PBS 洗涤细胞,加入1 mL 4%多聚甲醛,4℃固定细胞1 h,PBS 洗涤细胞,加入1 000 μL 结晶紫染色液作用细胞2 min,ddH2O 洗涤细胞,选取肿瘤丰富的区域,置于200×高倍镜,胞质或细胞核染成棕黄色表示为阳性细胞,200×镜下计数400 个肿瘤细胞中阳性细胞数,统计数值:阳性细胞数/肿瘤细胞数×100%,重复5 次后取平均值。
1.8 流式细胞术检测SACC-83 细胞凋亡和细胞周期
将转染siRNA 24 h的SACC-83细胞胰蛋白酶消化,离心收集细胞后利用冰预冷的PBS洗涤细胞。在避光条件下,加入FITC-Annexin V和碘化丙钠(PI),静置15 min后,加入Binding Buffer混匀置于冰上,利用流式细胞仪检测细胞凋亡。收集人口腔鳞癌细胞SACC-83,调整细胞数目为106/mL,加入70%乙醇固定细胞,PBS洗涤细胞后,离心去除上清,加入RNase 37℃孵育30 min,加入碘化丙啶(PI),孵育15 min,利用流式细胞仪分析细胞周期。
1.9 统计学处理
采用SPSS 20.0 软件进行分析,符合正态分布的数据采用±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 FGFR4在口腔鳞癌组织及口腔鳞癌细胞中的表达
32 对样本的免疫组织化学显色结果显示,FGFR4 在正常口腔上皮组织中表达微弱,但在口腔鳞癌组织中过度表达(图1A)。与免疫组织化学染色结果一致,免疫印迹检测显示,肿瘤组织中的FGFR4 蛋白水平高于相应的非癌组织(图1B)。此外,与正常口腔上皮细胞HOEC 相比,在口腔鳞癌细胞系(HSC-2、CAL-27 和SACC-83)中检测到不同程度的FGFR4 过表达(P<0.01)(图1C、D)。SACC-83 细胞系中的FGFR4 蛋白表达水平较高,可作为以下研究基础。

图1 FGFR4 在口腔鳞癌组织和口腔鳞癌细胞系中的表达,标尺=100 μm。A:免疫组织化学检测FGFR4 的表达;B、C:免疫印迹检测FGFR4 的表达;D:FGFR4/β-actin 比值,**P<0.01 vs HOEC.
2.2 沉默FGFR4 基因对口腔鳞癌细胞增殖的影响
为了研究FGFR4 对口腔鳞癌细胞增殖的影响,将FGFR4 siRNA 转染SACC-83 细胞24 h 后进行qRT-PCR、免疫印迹和克隆形成实验。qRT-PCR 实验结果显示,与siNC 组(0.987±0.061)相比,si-FGFR4 组(0.305±0.015)的FGFR4 mRNA 相对表达量显著降低(P<0.01)(图2A);免疫印迹检测结果显示,si-FGFR4 组的FGFR4 蛋白表达水平明显低于siNC 组,说明siRNA 可以有效抑制FGFR4的表达(图2B)。克隆形成实验检测沉默FGFR4基因对SACC-83 细胞增殖的影响,结果显示,与siNC 组相比,si-FGFR4 组细胞克隆数减少约40.6%(P<0.01)(图2C、D)。
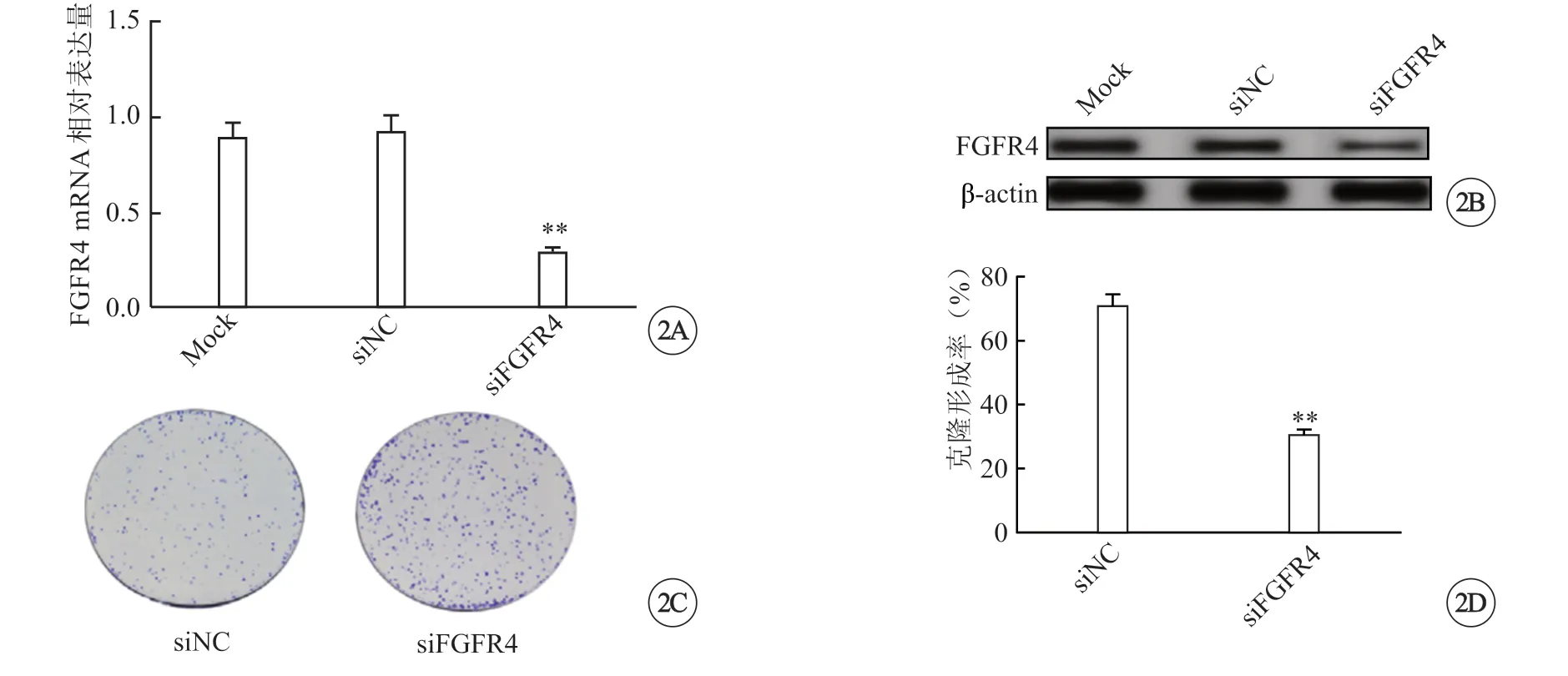
图2 沉默FGFR4 对口腔鳞癌细胞SACC-83 增殖的影响。A、B:SACC-83 细胞分别瞬时转染NC siRNA 和FGFR4 siRNA,提取总RNA和细胞溶解产物在转染后24 h 内,用qRT-PCR 和免疫印迹检测FGFR4 在mRNA 和蛋白水平的表达(**P<0.01 vs siNC);C、D:克隆形成实验检测FGFR4 沉默后SACC-83 细胞增殖能力,**P<0.01 vs siNC.
2.3 沉默FGFR4 基因对口腔鳞癌细胞凋亡的影响
为了研究FGFR4 对口腔鳞癌细胞凋亡的影响,对已转染FGFR4 siRNA 的SACC-83 细胞进行流式细胞术检测。流式细胞术检测结果显示,与siNC组相比,si-FGFR4 组细胞凋亡数目增加(P<0.01)(图3A、B)。免疫印迹检测结果显示,与siNC 组相比[Bcl-2 表达量为(0.812±0.120),Bax 表达量为(0.469±0.060)],沉默FGFR4 抑制了抗凋亡蛋白Bcl-2 的表达(0.378±0.080)(P<0.01),上调凋亡蛋白Bax 的表达(0.885±0.090)(P<0.01)(图3C、D)。

图3 沉默FGFR4 对口腔鳞癌细胞SACC-83 的凋亡影响。A、B:流式细胞术检测FGFR4 对SACC-83 细胞凋亡的影响(**P<0.01 vs siNC);C、D:免疫印迹检测抗凋亡蛋白Bcl-2 和凋亡相关蛋白Bax 蛋白的表达(**P<0.01 vs siNC).
2.4 沉默FGFR4 基因对口腔鳞癌细胞周期的影响
为了研究FGFR4 基因对口腔鳞癌细胞周期的影响,对已转染FGFR4 siRNA 的SACC-83 细胞进行流式细胞术检测。实验结果显示,与siNC 组相比,转染siFGFR4 使SACC-83 细胞在G0/G1 期停滞(图4A)。免疫印迹检测结果显示,沉默FGFR4 抑制周期蛋白P21 的表达(P<0.05)(图4B)。

图4 沉默FGFR4 对口腔鳞癌细胞周期的影响
2.5 沉默FGFR4基因抑制RAS/RAF/MAPK信号通路
为了研究沉默FGFR4 对RAS/RAF/MAPK 信号通路的影响,将收集的已转染FGFR4 siRNA的SACC-83 细胞进行免疫印迹检测。结果显示,siNC 组的EGFR 表达量为(0.732±0.210)、RAS为(0.634±0.080)、RAF 为(0.601±0.680)、p-MEK/MEK 为(0.768±0.410)、p-ERK1/ERK1为(0.753±0.540);si-FGFR4 组的EGFR(0.197±0.280),RAS 表达量为(0.317±0.720)、RAF 为(0.309±0.620)、p-MEK/MEK 为(0.409±0.320)和p-ERK1/ERK1 为(0.325± 0.080);较siNC 组显著降低(P<0.05),说明沉默FGFR4 基因可抑制RAS/RAF/MAPK 信号通路(图5A、B)。

图5 沉默FGFR4 对RAS/RAF/MAPK 信号通路影响
3 讨论
口腔鳞癌是人类最常见的恶性肿瘤之一,发病率约占头颈部鳞状细胞癌的40%[13]。与其他恶性肿瘤相比,口腔鳞癌的生存指数低、预后复发和转移概率较高[14]。根据世界卫生组织数据显示,每年口腔鳞癌的死亡人数高达14.5 万[15]。尽管在预防和治疗方面已取得相应进展,但口腔鳞癌诊断的延误仍然是高发病率和高死亡率的主要原因之一[16]。因而,探究抑制口腔鳞癌细胞增殖和迁移的分子机制,是解决当前临床口腔鳞癌防治的关键之一。
FGFR4 是高度保守的酪氨酸激酶受体家族成员之一,由一个细胞配体结构域、单跨膜螺旋结构域和具有酪氨酸激酶活性的细胞质结构域组成[17]。在癌症中,FGFR4 基因异常会影响FGFR4 蛋白的下游信号通路,导致持续的细胞增殖,促进肿瘤的发生发展[18]。研究表明,FGFR4 是肝细胞癌的驱动因素[19],FGFR4 可增加肺腺癌中表皮生长因子受体(EGFR)的致癌信号,阻断FGFR4 可显著抑制ESCC 的恶性行为[20]。此外,FGFR4 在乳腺癌细胞中过表达,是引起肿瘤细胞恶性生物学行为的原因[21]。这些研究表明,FGFR4 可能是一个促癌因子。Choi 等[22]报道FGFR4 单核苷酸多态性可作为预测口腔鳞癌淋巴结转移的因素;Chia-Hsuan 等[23]报道FGFR4 的多态性与口腔鳞癌的易感性相关。这说明FGFR4 可能与口腔鳞癌的发生发展相关。然而,目前FGFR4 与口腔鳞癌发生发展的相关分子机制的研究报道甚少。本研究结果显示,FGFR4在口腔鳞癌组织样本和细胞系中显著高表达,暗示FGFR4 的高表达与口腔鳞癌细胞的发生发展过程相关。研究显示下调FGFR4 表达,会抑制口腔鳞癌细胞SACC-83 的增殖,降低抗凋亡蛋白Bcl-2的表达,促进凋亡相关蛋白Bax 的表达,细胞凋亡的数目增加;此外,P21 蛋白表达降低。P21 是调控细胞周期的主要蛋白,通过与增殖细胞核抗原结合,抑制DNA 聚合酶复合物的形成,进而影响细胞复制,阻滞细胞周期,特别是G0/G1 期[24]。本研究证实,下调FGFR4 表达,使SACC-83 细胞停滞于G0/G1 期。这说明在口腔鳞癌细胞SACC-83中,下调FGFR4 表达具有抑制其细胞增殖,促进细胞凋亡的作用。本研究结果表明,FGFR4 在口腔鳞癌细胞SACC-83 中发挥的功能与其在乳腺癌、肝癌、肺腺癌等癌症中的生物学功能一致,具有明显的促癌作用。
研究表明,肿瘤细胞中过表达的FGFR4 和Klotho 蛋白结合,与FGFR19 组成同源二聚体复合物,随后激活RAS/RAF/MAPK 信号通路,最终导致肿瘤细胞的增殖和迁移[25]。已有研究显示,RAS/RAF/MAPK 信号通路与乳腺癌和直肠癌的发生发展相关[26-27]。白玥等[28]报道甲氨蝶呤通过RAS/MAPK 信号通路抑制胶质母细胞瘤的生长;候晓洁等[29]报道华蟾毒配基联合索拉非尼通过AURKA/RAS/RAF/ERK 信号通路影响肝癌Huh7 细胞增殖与凋亡。这些研究表明,RAS/RAF/MAPK 信号通路参与肿瘤发生发展和恶性转化过程。本研究结果显示,在口腔鳞癌细胞中下调FGFR4,降低RAS、p-RAF 和p-ERK1/2 蛋白的表达,提示下调FGFR4 的表达抑制口腔鳞癌中RAS/RAF/MAPK 信号通路的活化。之前的研究显示,RAS/RAF/MAPK 在胶质母细胞瘤、肝癌、乳腺癌和直肠癌发展过程中被异常激活,而本研究的实验结果提示,在口腔鳞癌细胞SACC-83 中RAS/RAF/MAPK 通路同样被激活,也可能参与了癌细胞的发展,进一步表明抑制该通路活化有可能成为癌细胞靶向治疗的关键。
综上所述,FGFR4 在口腔鳞癌组织和口腔鳞癌细胞中高表达,下调FGFR4 可抑制RAS/RAF/MAPK 信号通路的激活,进而抑制口腔鳞癌细胞增殖,使细胞周期停滞于G0/G1 期,促进其凋亡。以上结果初步明确FGFR4 在口腔鳞癌进展中发挥重要作用,为进一步探索口腔鳞癌的发生发展机制提供新的思路。
