成年人抗接触蛋白相关蛋白2抗体自身免疫性脑炎的临床特征研究
2021-09-16吴兰香田胜郑合情刘盼吴伟
吴兰香,田胜,郑合情,刘盼,吴伟
本研究价值:
(1)抗接触蛋白相关蛋白2(Caspr 2)抗体自身免疫性脑炎发病率不高,临床少见,本研究首次收集了68例该病患者的临床资料,丰富了对该病临床特征及辅助检查的研究。
(2)部分患者完成了随访,使临床对该病的预后评估有了更进一步的认识,有一定指导意义。
随着关于自身免疫性脑炎(autoimmune encephalitis,AE)的研究进展,越来越多具有致病性的抗神经细胞抗体被发现,其中抗接触蛋白相关蛋白2(contact protein related protein-2,Caspr 2)抗体是电压门控钾通道自身抗体(VGKC)的一种。电压门控钾通道是调节神经元动作电位的重要离子通道,出现功能障碍时会延长神经元动作电位,导致癫痫发作、小脑性共济失调、脑炎、神经精神症状和其他临床表现[1]。抗Caspr 2抗体的检出率为1.30%(51/3 910)[2],明显低于其他AE相关抗体,临床少见,且对其报道多见于VGKC复合物相关疾病患者中,限制了临床医生对其的认识。本文旨在对2016年4月至2020年12月南昌大学第二附属医院收治的14例成年人抗Caspr 2抗体相关脑炎患者的临床资料进行回顾性分析,并复习相关文献,以期提高临床医生对该病的认识,改善患者预后。
1 对象与方法
1.1 研究对象 2016年4月至2020年12月于南昌大学第二附属医院神经内科就诊的表现为急性或亚急性脑炎症状的成年患者中被确诊为AE者共198例,回顾性选取其中血清或脑脊液抗Caspr 2抗体阳性患者14例为研究对象。收集研究对象的住院病历资料,并由2名神经内科主治医师重新评估其诊断依据。纳入标准:(1)符合2017年中华医学会神经病学分会发布的《中国自身免疫性脑炎诊治专家共识》[3]及2016年在Lancet Neurology发表的AE诊断标准[4];(2)所有患者血清或脑脊液至少有1项抗Caspr 2抗体阳性。排除标准:(1)可能的AE,但自身抗体检测阴性者;(2)失访或拒绝回访者。
1.2 方法 (1)入院后评估患者颅脑磁共振成像、脑电图(普通脑电图或长程视频脑电图)、腰椎穿刺脑脊液检测结果,并对血清肿瘤标志物、血清抗核抗体谱、甲状腺抗体、胸部CT、腹部及盆腔彩超/CT检查结果进行评估。(2)获得所有患者及其家属知情同意后,收集患者血液及脑脊液标本进行特异性抗体检测。采用IIFT和间接免疫荧光试剂盒(德国,EUROIMMUNAG公司,No:FA112d-1005-1)检测相关抗体:抗Caspr 2抗体、抗N-甲基-D-天冬氨酸受体(NMDAR)抗体、α氨基-3-羟基-5-甲基-4-异嗯唑丙酸受体(AMPAR)抗体、抗富含亮氨酸胶质瘤失活蛋白1(LGI1)抗体、抗γ-氨基丁酸B型受体(GABABR)抗体、抗γ-氨基丁酸A型受体(GABAAR)抗体、抗二肽基肽酶样蛋白(DPPX)抗体、抗代谢型谷氨酸受体1(mGLuR)抗体、抗甘氨酸受体(GlyR α1)抗体、抗神经黏附蛋白-5(lgLON5)抗体、抗多巴胺2型受体(D2R)抗体、抗突触蛋白-3α(Neurexin3α)抗体、抗谷氨酸脱羧酶65(GAD65)抗体,该试剂盒含有猴小脑薄片。严格执行试剂盒标注的检验步骤:取经磷酸盐缓冲液(phosphate buffer saline,PBS)按1∶10稀释的血清及脑脊液原液30 μl加至标本反应区,让生物薄片与标本在室温下反应30 min,PBS冲洗2遍,每次至少5 min,再加入25μl异硫氰酸荧光素标记的山羊抗人IgG至反应区,盖上生物薄片,室温避光孵育30 min,使用PBS冲洗2遍,随后封片,在荧光显微镜下观察并判定结果(由武汉康圣达医学检验所提供技术支持)。(3)采用间接免疫荧光法和线性免疫印迹法进行副肿瘤相关抗体检测,包括抗Hu、Yo、Ri、Ma2、CV2、amphiphysin抗体。血清、脑脊液抗体滴度分为弱阳性、强阳性两个水平,其中弱阳性滴度包括 1∶1、1∶3.2、1∶10、1∶32,强阳性滴度包括 1∶100、1∶320。
1.3 治疗及随访评估 14例患者均接受一线免疫治疗,并对癫痫发作、精神症状进行对症治疗,并予相应的支持及康复治疗,确诊肿瘤患者建议其进行针对性抗肿瘤治疗。所有患者通过门诊或电话随访。采用改良Rankin量表(mRS)评分对患者的生活状态进行评估。mRS评分≤2分表示预后良好,mRS评分≥3分表示预后不良。
复发定义:患者症状好转或者稳定2个月以后重新出现症状或者症状加重,mRS评分增加1分及以上。
1.4 观察指标 回顾性收集14例抗Caspr2抗体AE患者的临床特征、实验室检查结果、影像学检查结果、脑电图表现、治疗和随访。
2 结果
2.1 临床特征 14例抗Caspr 2抗体AE患者中,男11例,女3例;年龄为18~82岁,平均年龄(47.9±19.6)岁;2例有抗NMDAR脑炎病史,1例有乙型肝炎病史,1例有单纯疱疹病毒性脑炎病史,1例有甲状腺功能减退病史,余患者既往史无特殊。14例患者中,有前驱症状者5例(发热3例、头晕1例、头痛3例),精神行为异常为最常见的首发症状;伴有边缘性脑炎症状者11例,其中精神行为异常者9例,认知功能下降者7例,癫痫发作者6例;合并自主神经功能障碍者10例,其中多汗症8例,窦性心动过速6例,便秘2例,小便困难1例;合并失眠者6例;合并周围神经高兴奋性症状者5例,主要表现为肌肉的不自主跳动、颤搐,以下肢为著;4例出现神经性疼痛;合并小脑症状者3例(21.4%),主要表现为头晕,步态不稳,详见表1。

表1 抗Caspr 2抗体相关脑炎患者的抗体检测、临床表现、辅助检查、治疗及预后情况Table 1 The antibody examinations,clinical manifestations,auxiliary examinations,treatments and prognosis of patients with anti-Caspr 2 antibody autoimmune-associated encephalitis
2.2 实验室检查结果 所有患者风湿四项、肿瘤标志物检测结果均正常。患者均行甲状腺功能检测:病例9和病例10出现甲状腺功能异常:病例9游离三碘甲状腺原氨酸(FT3)1.89 ng/L(参考范围 2.3~4.2 ng/L),促甲状腺激素(TSH) 0.324 mU/L(参考范围0.55~4.78 mU/L);病例10 FT31.39 ng/L,游离甲状腺素(FT4)0.45 ng/dl,TSH 66.5 mU/L;11例患者行ANA、ANA3、ANCA检测未见异常。低钠血症5例,血钠125~134 mmol/L( 参 考 范 围 135~145 mmol/L)。9例 患 者 脑脊液压力在参考范围内〔参考范围:80~180 mm H2O(1 mm H2O=0.009 8 kPa)〕;1例患者脑脊液压力升高,为190 mm H2O;2例患者脑脊液压力降低,分别为50、70 mm H2O。病例3脑脊液水痘-带状疱疹病毒(VZV)DNA PCR (+),病例7脑脊液培养示新型隐球菌阳性(第5天时),余病毒(单纯疱疹病毒Ⅰ和Ⅱ型、风疹、巨细胞病毒)抗体、细菌、真菌涂片和培养均阴性。脑脊液常规检查:8例患者脑脊液蛋白水平升高(0.56~4.14 g/L);2例脑脊液葡萄糖水平下降;8例脑脊液白细胞计数升高(26×106/L~2 411×106/L),5例以淋巴细胞为主。
14例患者行副肿瘤抗体(抗Hu、Yo、Ri、Ma2、CV2、amphiphysin抗体)检测,结果均为阴性。血清及脑脊液标本抗Caspr 2抗体检测结果:7例血清及脑脊液抗体阳性,6例单血清抗体阳性,1例单脑脊液抗体阳性。5例患者同时出现抗Caspr 2抗体、抗NMDAR抗体双阳性。
2.3 影像学检查结果 14例患者均通过胸部CT、腹部和淋巴结超声检查筛查潜在的恶性肿瘤,均未发现异常结果。14例患者均行颅脑磁共振成像检查:病例1示左侧颞叶内侧异常信号,增强无强化。病例2示双侧额叶、岛叶、右侧颞叶脑回肿胀并脑膜增厚强化;病例3示双侧额、颞、岛叶,双侧小脑半球,小脑蚓部皮层及皮层下肿胀并发多斑片异常信号(图1);双侧小脑半球见散在斑点状轻度强化,双侧大、小脑半球软脑膜增强并线性强化,出院时复查示病灶范围较前明显缩小(图2)。病例10示胼胝体压部T2WI高信号。病例14示双侧颞叶海马硬化。9例患者脑电图异常:3例患者出现癫痫放电,6例出现弥漫性低或中高波幅慢波。2例患者进行肌电图检查,其中1例出现双下肢胫后神经M波后发放电位;1例出现束颤电位及肌颤搐电位。
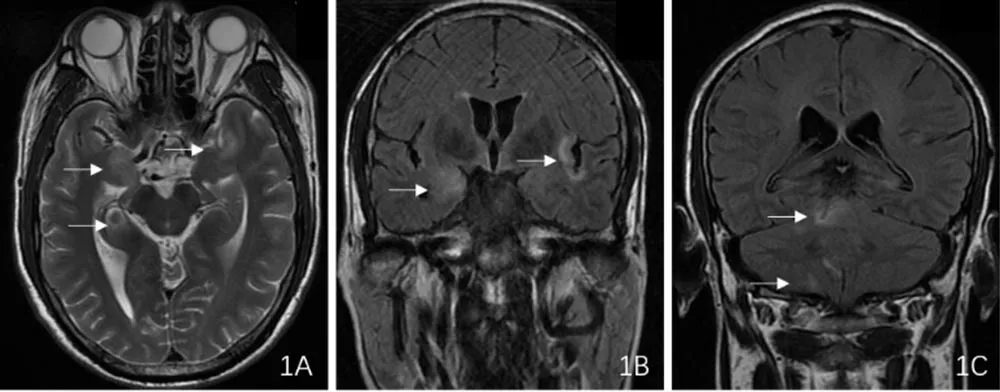
图1 一例男性抗Caspr 2抗体AE患者入院颅脑磁共振检查结果Figure 1 The results of admission brain MRI examination of a male patient with anti-Caspr 2 antibody autoimmune-associated encephalitis before treatment
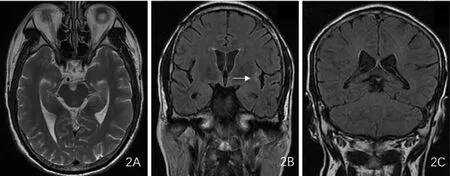
图2 一例男性抗Caspr 2抗体AE患者治疗10 d后颅脑磁共振成像检查结果Figure 2 The results of brain MRI examination of a male patient with anti-Caspr 2 antibody autoimmune-associated encephalitis after 10-day treatment
2.4 治疗及随访评估 住院期间,14例患者急性期予以一线免疫治疗,其中9例予以激素(静脉甲泼尼龙冲击+口服)联合丙种球蛋白冲击(0.4 mg·kg-1·d-1,5 d)治疗,4例予以激素治疗,1例予以丙种球蛋白冲击治疗。随访0~47个月,平均随访8.9个月。8例患者完全恢复正常(mRS评分0分)。2例患者(病例1、11)预后良好(mRS评分1分),遗留记忆力减退或癫痫发作,不影响日常生活。1例患者(病例6)自行停用激素后复发,出现性格改变,症状反复发作,未重新治疗。1例患者(病例7)病情稍好转,仍在住院治疗过程中。1例患者(病例12)脑炎症状消失,并发左侧股骨头坏死(已行手术治疗)。1例患者(病例10)在住院治疗过程中发生恶性心律失常后死亡。
3 讨论
Caspr 2是一种膜蛋白,属于神经毒素(neurexin)Ⅳ跨膜蛋白超家族成员之一,广泛表达于周围神经和海马、小脑等,与周围神经高兴奋性和脑炎密切相关。Caspr 2通过与接触蛋白2(contactin-2)形成功能复合体而发挥作用,可促进髓鞘轴突近旁节中钾通道聚集,避免神经元重复放电,进而稳定细胞膜静息电位。抗Caspr 2抗体通过与Caspr 2胞外段结合而阻断功能复合体形成过程,使得细胞膜去极化,导致重复放电[5]。文献研究表明,抗Caspr 2抗体相关相关脑炎患者中84.31%为男性[5-6]。自身免疫性疾病多好发于女性,但抗Caspr 2抗体脑炎以年长男性多见,可能由男性生殖系统储存和释放该抗体所致[7];此外,女性患者发病有年轻化趋势。本研究中男性患者所占比例为11/14,女性发病年龄为21~59岁,普遍低于男性患者,与上述文献报道相符。
研究表明,中枢神经系统(CNS)病毒感染(通常为单纯疱疹病毒-1脑炎)后,部分患者会出现副感染性自身免疫性脑炎[8],其中以抗NMDAR脑炎最常见[9]。除单纯疱疹病毒外,人类免疫缺陷病毒(HIV)、风疹病毒、梅毒螺旋体(TP)、VZV、肺炎支原体、巨细胞病毒和爱泼斯坦-巴尔病毒也可诱发AE[10]。脑炎可能是由潜在的抗体/补体介导的免疫反应或T细胞介导的细胞毒性引起的[6]。本研究中有1例患者先出现左上臂外侧条带状疱疹伴疼痛,5 d后出现脑炎综合征,脑脊液检查示VZV DNA PCR(+),考虑感染继发AE。目前我国VZV疫苗已普及,VZV感染所致CNS感染发生率明显下降。初次感染VZV后,病毒长期潜伏于脊髓神经后根神经节内,机体免疫力下降时病毒重新激活,顺行到皮肤引起带状疱疹或者入脑引起脑炎。皮肤损伤可以帮助识别VZV,然而,在没有皮疹的情况下,神经节内VZV也可能会重新激活[11]。因此,临床上可通过检测脑脊液中VZV DNA或抗VZV抗体诊断相关疾病,并推荐阿昔洛韦抗病毒治疗[12]。2019年,PRAKASH等[13]报道了1例VZV感染合并抗NMDAR抗体阳性患者,同时合并抗Caspr 2抗体阳性病例未见报道。与肠病毒(EV)、单纯疱疹病毒相比,在CNS感染患者中并不经常对VZV和带状疱疹进行检测,尚不清楚在CNS感染之前或同时伴有病变的VZV原发性和再激活感染患者的确切比例及危险因素[14]。因此,笔者建议在伴有VZV阳性的AE患者中同时进行抗病毒治疗,因为免疫抑制治疗(大剂量激素)可能触发重症患者暴发性脑VZV或单纯疱疹病毒再激活[15]。然而,病毒性脑炎进行抗病毒或丙种球蛋白治疗能否预防AE发生和发展尚需进一步研究。
本研究发现1例新型隐球菌感染继发抗Caspr 2抗体脑炎患者,SAKIYAMA等[16]和陈丹等[17]分别报道了结核性脑膜炎或隐球菌感染继发抗NMDAR抗体脑炎病例,认为某些病毒或细菌感染会引起组织损伤并可能通过暴露神经元中的NMDAR表位来诱导NMDAR抗体产生,破坏CNS的免疫耐受,或者与炎症致血-脑脊液屏障损害有关,具体机制尚不清楚。因此,对于CNS感染患者,在进行病毒研究的脊髓穿刺时,储存等量的脑脊液是很重要的。根据症状和临床怀疑的程度,可以在进行脑脊液病毒、细菌、真菌检测的同时启动相关自身抗体检测,也可以等到对最常见病毒的PCR或血清学研究完成后再进行研究。
抗Caspr 2抗体AE具有多样的临床谱,主要有7项核心症状:边缘系统症状(精神行为异常、认知功能下降、癫痫发作)、周围神经高兴奋性症状(肌肉颤搐、束颤、痉挛)、自主神经功能失调(多汗症、心动过速、便秘)、小脑性共济失调、失眠、神经性疼痛、体质量下降,且大多数症状有叠加[18]。抗Caspr 2抗体AE的另一重要表现是获得性神经肌强直,又名Isaacs综合征,是一种周围神经过度兴奋(peripheral nerve hyperexcitability,PNH)综合征,主要表现为肌肉颤搐、束颤、痉挛和萎缩。当CNS症状和周围神经过度兴奋同时出现时,伴随着自主神经功能障碍和失眠,称之为莫旺综合征(Morvan综合征)。莫旺综合征主要表现为获得性神经性肌强直、肌肉颤搐、严重失眠、多汗症和由脑病引起的意识模糊、幻觉和波动性认知功能障碍[19],以自主神经功能障碍尤为严重,可表现为心律失常(心动过速或过缓)、多汗症、血压异常、小便功能障碍及性功能障碍、便秘等多种形式。本研究4/14的患者出现神经性疼痛,疼痛表现多样,包括肌肉痛、胸痛、关节痛、腰痛以及手和脚部烧灼感等,以肌肉痛为主,这是既往容易被忽略的症状。有研究显示,周围神经小纤维功能及结构受累会导致神经性疼痛:抗Caspr 2抗体下调感觉神经小纤维近节旁区VGKC的表达,使得痛觉过敏神经传导性升高,产生疼痛症状[20]。本研究中11/14的患者出现边缘性脑炎症状,最常见的症状是精神行为异常,而单一症状早期容易误诊为精神分裂症,有的患者表现为突出的幻觉、抑郁和性格改变,这与抗Caspr 2抗体靶向海马、杏仁核中抑制性神经元有关[2]。本研究中6/14的患者经心电图检查发现心动过速,其中1例82岁的男性患者住院期间发生恶性心律失常后死亡,提示心脏并发症具有潜在的生命危险。据报道,QT间期延长、心动过缓和心源性猝死均与抗Caspr 2抗体有关,特别是在Morvan综合征患者中[21],这些患者多合并失眠,可能导致其更频繁地接触安定类药物,两者之间可能具有协同作用,因此,对于这类患者应加强心脏评估,以防止猝死的发生。本研究中6/14的患者合并失眠,明显高于其他类型脑炎,其原因为抗Caspr 2抗体与广泛分布在海马、小脑、蓝斑核及中缝核和丘脑的Caspr 2结合,引起觉醒系统(蓝斑核、中缝核及丘脑)神经元功能紊乱,继而出现严重失眠[7]。本研究中3/14的患者出现小脑性共济失调,如头晕、步态不稳等症状,与Caspr 2在小脑颗粒神经元轴突中高表达相关。据报道,10%的抗Caspr 2抗体AE患者可表现为小脑性共济失调,部分患者可出现帕金森综合征、舞蹈症、脊髓性肌阵挛、直立性肌阵挛及眼睑痉挛等其他运动障碍表现[22]。
目前,免疫荧光法(CBA)已广泛用于抗Caspr 2抗体检测,研究表明血清抗Caspr 2抗体阳性与莫旺综合征和神经性肌强直有关,脑脊液抗Caspr 2抗体阳性则与脑炎有关[23]。有研究报道,当血清抗Caspr 2抗体滴度≥1∶200时可以确诊,灵敏度达85%,特异度达81%,但由于只有较高滴度的血清抗体才有助于诊断,低滴度抗体可能是神经系统破坏过程中的附带现象,因此,检测出低滴度抗体患者需结合流行病学特征(如年龄和性别等),以及特征性临床表现等协助诊断[24]。脑脊液抗Caspr 2抗体的特异度高于血清抗体,但灵敏度较低,因此血清抗Caspr 2抗体的高滴度更具诊断价值,脑脊液抗体检测阴性不宜作为合适的排除标准[2]。本研究中13/14的患者出现血清抗Caspr 2抗体阳性,仅有1例患者脑脊液抗Caspr 2抗体阳性。
抗Caspr 2抗体并非AE特异性抗体,目前认为帕金森综合征、舞蹈病、克雅病、吉兰-巴雷综合征、额颞叶痴呆样综合征和肌萎缩侧索硬化也可能与该抗体有关,且在多达10%的特发性小脑性共济失调患者中可检测到抗Caspr 2抗体[25]。随着抗体谱的扩展和检测手段的更新,双重抗神经元抗体阳性的现象也越来越受到关注。任海涛等[26]报道531例AE患者中10例合并多重抗体阳性,其中以抗GABABR合并抗Hu抗体阳性最常见,有的多种抗体同时共存,有的复发后出现新的抗体。本研究中5例抗Caspr 2抗体患者合并抗NMDAR抗体阳性,查阅相关文献发现,LIU等[27]曾报道1例抗Caspr 2抗体、NMDAR抗体、MOG抗体三抗体阳性患者。虽然两种或多种自身抗体共存的机制尚不清楚,但这种现象可以部分地用表位扩散的概念来解释,即对自身抗原的持续识别和激活导致慢性免疫反应,同时伴随着针对同一抗原内(分子内)或不同抗原(分子间)不同优势表位的抗体的产生[28]。目前认为,患者有1种以上的自身抗体阳性则表明其免疫系统紊乱更加广泛。本研究中3例抗NMDAR、Caspr 2抗体阳性患者以精神行为异常为首发症状,两种抗体均属于神经元表面抗体,可直接作用于突触或细胞表面特定抗原,产生神经传导功能障碍。有学者认为,多重抗神经元抗体与疾病快速进展或神经综合征的叠加相关,本研究中1例患者出现抗NMDAR抗体脑炎和抗Caspr 2抗体脑炎症状的结合,出现边缘性脑炎症状和自主神经症状;2例患者虽出现多重抗体(NMDAR和Caspr 2)阳性,但只出现抗NMDAR抗体阳性的临床表现,考虑其临床特征取决于责任抗体。有研究表明,抗NMDAR抗体持续的鞘内合成是抗NMDAR抗体脑炎复发的基础,其鞘内合成可能与B淋巴细胞和浆细胞在CNS定植有关[29]。本研究中2例患者虽出现多重抗体(NMDAR和Caspr 2)阳性,但主要表现为莫旺综合征或神经性肌强直以及共济失调等症状。据文献报道,约50%的Caspr 2抗体阳性者存在肌肉颤搐、痉挛、多汗、失眠等周围和自主神经受累表现。因此,本研究2例患者尽管抗Caspr 2和NMDAR抗体共存,但最初的治疗与单独抗体阳性患者相似。抗NMDAR、Caspr 2抗体均为致病性抗体,有产生临床症状的潜能,但是否引起症状还与抗体滴度和个体耐受差异有关。因此,强调对AE患者进行血清和脑脊液全面检测;多种抗体的共存及复发等提示AE临床症状及病情的复杂性,此时应注意区分责任抗体和致病性抗体,但其临床意义和具体机制尚需进一步研究。
抗Caspr 2抗体AE患者实验室检查结果大多正常。25%的抗Caspr 2抗体AE患者会出现脑脊液白细胞计数升高,大多以淋巴细胞升高为主,脑脊液蛋白水平增高,可出现寡克隆带(OB)阳性,但特异度不高。脑电图检查可见痫性放电或弥漫性低至中高波幅慢波活动,但部分患者脑电图检查结果可正常。回顾文献发现,仅1/3抗Caspr 2抗体AE患者显示颅脑磁共振成像异常,特异性表现包括单侧或双侧内侧颞叶T2高信号,海马萎缩,以及内侧颞叶或海马硬化[30],免疫治疗后病灶可减轻或消失。此外,未见抗Caspr 2抗体AE累及大脑、脑干、脊髓和视神经的急性播散性脑脊髓炎(ADEM)样损害的报道。抗Caspr 2抗体AE可通过特异性抗体检测,并以颅脑磁共振成像检查结果作为诊断依据。
据文献报道,0~32%的抗Caspr 2抗体AE患者可筛查出肿瘤,以胸腺瘤最多见,膀胱癌、肺癌、子宫内膜癌等也有少量报道[31]。有研究显示,脑脊液抗Caspr 2抗体阳性AE和肿瘤相关性较小,仅血液抗Caspr 2抗体阳性AE通常伴有恶性胸腺瘤[23],表现为莫旺综合征或神经性肌强直的女性患者出现胸腺瘤的概率更大[25]。肿瘤相关蛋白可能组成性表达在神经元表面,然后通过免疫特权的破坏或细胞死亡后的吞噬作用暴露于免疫系统,使得神经元表面抗原表达降低[32],体内存在抗Caspr 2抗体与轴突生长诱向因子1 受体(DCC、UNC5a)抗体者同胸腺瘤尤为相关。本研究中14例患者经广泛的肿瘤筛查后未发现肿瘤,肿瘤发现率远低于上述文献报道。虽然随访时间太短而不能明确排除肿瘤,但对个体患者的评估结果表明,这种疾病可能是一种自身免疫性非肿瘤性综合征。
至今为止,抗Caspr 2抗体AE的治疗仍缺乏统一方案,抗癫痫、抗精神症状及其他对症治疗虽能在一定程度改善症状,但无法改善长期预后。AE的一线免疫治疗包括单独或联合应用糖皮质激素、免疫球蛋白、血浆置换等[6],在一线免疫治疗效果不佳、病情加重或复发时,可启用免疫抑制剂进行二线免疫治疗[3]。目前广泛应用的长程免疫治疗药物包括吗替麦考酚酯、硫唑嘌呤、环磷酰胺等[3]。据文献报道,在不伴肿瘤情况下,抗Caspr 2抗体AE倾向于单相病程,在快速的激素减停过程中及免疫抑制剂减量或中断时,20%~30%的患者容易出现复发[2,33]。本研究中1例患者复发,系自行停用泼尼松治疗,复发率低于上述文献报道,至于多重抗体阳性是否会增加复发风险尚需进一步扩大样本量研究。本研究中10/14的抗Caspr 2抗体AE患者采用一线免疫治疗(激素或丙种球蛋白)反应良好,与上述文献报道相符。抗Caspr 2抗体的主要亚型是IgG4,IgG4与 Fcγ 受体亲和力较低,而免疫球蛋白主要通过竞争性阻断Fcγ受体、阻止补体激活发挥治疗作用,因此,有学者认为免疫球蛋白在治疗抗Caspr 2抗体AE时并非所有患者均会有明显疗效[34]。由于这种疾病少见,对上述治疗方法缺少科学的比较,因此对于不伴有肿瘤的抗Caspr 2抗体AE患者可采用一线免疫治疗观察效果,另外,激素减量过程应注意个体化。
总之,抗Caspr 2抗体AE临床较为少见,表现多样,无统一的诊断标准。对于急性或亚急性起病的AE综合征表现,尤其是伴有失眠、肌肉颤搐、疼痛和多汗者,应及时进行特异性抗体检测以明确诊断。由于此类患者伴有自主神经受累,因此需警惕猝死的发生。部分抗Caspr 2抗体AE部分可合并其他自身免疫抗体阳性,临床上需要根据具体的抗体类型与临床表现予以分析,多抗体阳性者是否预后较差,尚需进行下一步研究。
作者贡献:吴兰香、吴伟进行文章的构思与研究的设计,研究的实施与可行性分析,撰写论文,论文的修订,负责文章的质量控制及审校,对文章整体负责、监督管理;吴兰香、田胜负责结果的分析与解释;田胜、郑合情、刘盼进行数据收集,数据整理。
本文无利益冲突。
