5种植物源农药对食用菌生产中脉孢霉抑制效果研究
2021-09-16赵长江代晨晨范博文张圣也张海燕
赵长江,代晨晨,范博文,张圣也,张海燕
(黑龙江八一农垦大学 农学院/黑龙江省秸秆资源化利用工程技术研究中心,黑龙江大庆 163319)
食用菌因其味美、营养、保健和药用等多重用途[1-2],尤其是可以不与粮食争地的方式生产人类优质食品,而备受青睐。中国已成为食用菌生产和消费大国,安全的、规模化的食用菌产业对于保护农业生态环境,促进农业和环境可持续发展具有重要意义[3-5]。
但是,伴随食用菌的规模化栽培,菌丝体培养和子实体培养阶段时刻面临“杂菌”的危害,成为产业发展的制约因素之一。“杂菌”与食用菌之间既可能是寄生关系,也可能是相互拮抗作用,还可能是一种相互竞争关系[6]。其中,链孢霉(Neurosporasitophila)和红 色 面 包 霉(Neurosporaspp.)为典型的竞争性霉菌,在食用菌生产中普遍发生,具有范围广、来势猛、繁殖快、防治难、损失大的特点[7-8]。目前,物理预防和化学防治措施相结合仍是食用菌生产中脉孢酶类“杂菌”治理常用方法。物理防治主要涉及菌种的选择、原材料的配比、室内外常规消毒、控制培养温湿度等;化学防治主要使用多菌灵、生石灰等粉剂拌料或使用二氯异氰尿酸钠熏蒸消毒[9-12]。但由于过量化学农药会在食用菌产品中有所残留、影响产品质量并且会危害人体健康[13]。因此,选用高效的生物农药作为替代品,是实现绿色安全生产的有效措施之一。
植物源农药又称植物性农药,是指利用植物体内参与自身防御反应的次生代谢产物不利于有害生物的特性而开发利用的药剂,例如对昆虫具有拒食、毒杀、麻醉、抑制生长发育及干扰正常行为的,或是对多种病原菌及杂草具有抑制作用的次生代谢物[14]。植物源农药具有环境友好、生物活性多样、对非靶标生物安全、不易产生抗药性等优势[15-16]。截至2019年底,中国在登记有效期内的植物源农药共计28种,其中苦参碱单剂的登记数量最多,占农用植物源农药品种登记单剂数量的45%[17]。苦参碱对人畜低毒,是广谱杀虫剂,具有触杀和胃毒作用[18],与蛇床子素一样具有杀虫和抑菌的双重作用。前期有研究指出,植物提取物对木霉(Trichodermaspp.)、青霉(Penicillium)和脉孢霉(Neurospora)等食用菌的竞争性杂菌孢子萌发存在明显抑制作用[19],但是关于植物源农药在食用菌生产中“杂菌”治理应用的报道,十分有限。
本研究从被污染的香菇栽培料中分离并鉴定出脉孢霉菌,选取印楝素、苦参碱、丁子香酚、蛇床子素、乙蒜素5种植物源农药通过药剂平板法探讨其对脉孢霉菌落生长的影响,以期为食用菌生产上的生物防治提供借鉴。
1 材料与方法
1.1 供试菌株和药剂
脉孢霉菌株分离于黑龙江省大庆市春雷农场被污染的香菇栽培料,在无菌操作台中用消毒接种钩轻轻刮取发病部位的霉层,接种到PDA培养基,置于28 ℃恒温培养箱培养24 h;再取边缘菌丝纯化培养,连续纯化两代后置于4 ℃冰箱保存,备用。
供试5种植物源农药分别为:印楝素,0.3%乳油,农药登记号PD20101580,成都绿金生物科技有限责任公司;苦参碱,1.3%水剂,农药登记号PD20121488,恒源伟业生物科技;丁子香酚,0.3%可溶液剂,农药登记号PD20120949,南通神雨绿色药业有限公司;蛇床子素,1%水乳剂,农药登记号PD20150150,内蒙古清源宝生物科技有限公司;乙蒜素,80%乳油,农药登记号PD20101285,河南省大地农化有限责任公司。
1.2 脉孢霉DNA的提取及分子鉴定
将供试脉孢霉接种到PDA液体培养基,28 ℃,120 r/min摇床培养2 d,用吸水纸吸干水分的新鲜菌丝通过CTAB法提取菌丝基因组DNA[20]。然后通过ITS1和ITS4通用引物对DNA进行PCR扩增,扩增条件为94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸90 s,30个循环。PCR产物经电泳检测后送华大测序,并提交NCBI数据库进行序列比对分析。PCR扩增及测序引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。
1.3 脉孢霉温度响应生长试验
将PDA活化菌株用8 mm打孔器打成大小一致的菌块,接入90 mm培养皿的培养基中央,分别置于10个不同温度梯度下恒温培养24 h,用十字交叉法测菌落直径,设3个重复。温度梯度分别为5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃,以28 ℃为对照。
菌丝生长速度=(菌落半径-打孔器半径)/时间。
1.4 植物源农药抑菌作用测定
将PDA培养基定量分装于100 mL三角瓶中,121 ℃灭菌20 min,水浴锅缓慢冷却至60 ℃时,分别加入50倍、100倍、300倍、500倍、1 000倍、2 000倍稀释的供试农药,充分混匀倒入90 mm培养皿中,制成不同浓度的药剂平板,以清水添加为对照。
选择PDA培养基活化菌株用8 mm打孔器制备接种菌碟,接入药剂平板,置于28 ℃恒温培养24 h,采用十字交叉法测菌落直径,设3个重复。其中抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-打孔器直径)×100%。
1.5 数据统计分析
利用Microsoft Excel 2003软件对试验数据进行汇总,运用DPS 7.05统计软件Duncan’s新复极差法比较不同处理间的差异显著性,并计算各供试药剂的毒力回归方程、相关系数r值和EC50值。
2 结果与分析
2.1 脉孢霉的分子鉴定及其菌丝最适生长温度
以纯化菌株基因组DNA为模板,ITS1和ITS4扩增特异PCR产物直接测序获得600 bp碱基序列,提交NCBI数据库进行比对(表1),匹配112条锤舌菌纲真菌序列,发现与好食脉孢霉菌(Neurosporasitophila)株M21的18S核糖体RNA基因序列的完全匹配,期望(Expect)值为0.0、一致性(Identities)为100%、缺口(Gaps)为0%,表明供述菌株为好食脉孢霉(N.sitophila)。将脉孢霉置于10个不同温度下培养24 h,不同温度下菌丝生长速度差异显著(图1)。在5 ℃和 45 ℃时停止生长,在二者区间内均可生长;在 10 ℃和15 ℃虽能生长但菌落生长缓慢,生长速率分别为3 mm/d和5.7 mm/d,48 h后菌落直径变化不大,同时产生少量橘红色分生孢子;30 ℃和35 ℃处理及28 ℃对照培养的脉孢霉在接种24 h后已经长满培养皿,28~35 ℃为该菌最适生长温度区间;25 ℃和40 ℃下脉孢霉生长速率相当,为28 mm/d左右。结果表明,脉孢霉生长温度范围较广、喜高温,最适生长温度为28~35 ℃。
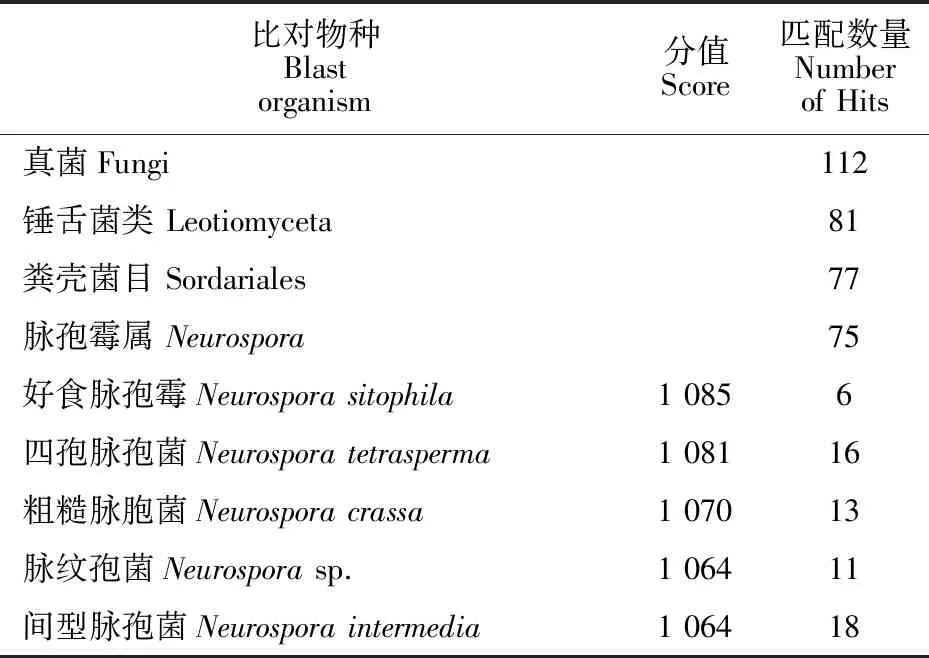
表1 测序脉孢霉ITS序列比对结果Table 1 ITS sequence alignment of the tested Neurospora strain
2.2 印楝素对脉孢霉菌丝生长的影响
0.3%印楝素乳油分别稀释至50倍、100倍、300倍、500倍、1 000倍和2 000倍的药剂平板对脉孢霉的抑制率差异不同(图2)。随处理药剂浓度的升高,菌落直径减小,抑制率增强。其中,印楝素乳油2 000倍和1 000倍平板与对照相同,抑菌率为0;500倍平板抑菌率55%,与对照差异显著;100倍和50倍平板(3 mg/kg)抑菌率达100%,菌丝仅在菌碟上生长,生长缓慢且为絮状,48 h后仍有粉红色孢子产生。
2.3 苦参碱对脉孢霉菌丝生长的影响
1.3%苦参碱水剂分别稀释至50倍、100倍、300倍、500倍、1 000倍和2 000倍的药剂平板对脉孢霉的抑制率有差异(图3)。随药剂处理浓度的升高,菌落直径减少,抑制率增强,均与对照差异显著。其中,苦参碱水剂2 000倍平板抑菌率为24%,1 000倍(13 mg/kg)抑制率为63%,50倍平板抑菌率近100%。
2.4 丁子香酚对脉孢霉菌丝生长的影响
0.3%丁子香酚可溶剂分别稀释至50倍、100倍、300倍、500倍、1 000倍和2 000倍的药剂平板对脉孢霉的抑制率相近(图4),2 000倍平板(1.5 mg/kg)时抑制率达到95%,其余供试浓度药剂抑菌率均为100%。
2.5 乙蒜素对脉孢霉菌丝生长的影响
将80%乙蒜素乳油分别稀释至50倍、100倍、300倍、500倍、1 000倍和2 000倍,供试6个浓度药剂平板抑菌率均为100%,与对照间差异显著(图5)。乙蒜素乳油2 000倍浓度(400 mg/kg)抑制效果也相当明显,菌碟上的菌丝在24 h后萎缩 死亡。
2.6 蛇床子素对脉孢霉菌丝生长的影响
1%蛇床子素水乳剂分别稀释至50倍、100倍、300倍、500倍、1 000倍和2 000倍的药剂平板对脉孢霉的抑制率不同,与对照差异显著(图6)。随处理药剂浓度的升高,菌落直径减小,抑制率增强。其中,蛇床子素水乳剂2 000倍平板抑菌率为63%,500倍(20 mg/kg)及更低倍数平板抑菌率均超过90%,但在48 h后仍有粉红色分生孢子产生。
2.7 植物源农药对脉孢霉的毒力分析
依据供试农药对菌丝的抑制数据,计算药剂的毒力回归方程、相关系数(r)和半最大效应浓度(EC50)。由表2可见,丁子香酚和乙蒜素对脉孢霉的抑制作用最强,其回归曲线相关系数和EC50值均为0;其次是印楝素和苦参碱,印楝素回归曲线的相关系数为0.974 4和苦参碱(0.973 5)相差不大,二者的EC50也相差不大;蛇床子素回归曲线的相关系数为0.884 1,其EC50为 5.329 8。供试5种植物源药剂对脉孢霉的毒力分别为乙蒜素=丁子香酚>印楝素>苦参碱>蛇床子素。

表2 供试植物源农药对脉孢霉的毒力Table 2 Toxicity of the tested phytogenic pesticides to Neurospora
3 结论与讨论
按照植保理论,抗性品种的应用是最理想的,但是食用菌抗性品种开发十分有限[21],所以目前食用菌工厂化生产中病虫害的防治仍以物理、化学防治为主。本研究从北方香菇分离鉴定一株脉孢霉属真菌后,侧重分析5种植物源农药对脉孢霉菌丝生长的抑制作用。其中丁子香酚和乙蒜素对其抑制率最高,抑菌效果最好,可用于食用菌生产中脉孢霉的生物防治,或可与前期对脉孢霉防治化学药剂[22-23]相结合提高防效。丁子香酚注册登记为杀菌剂,近来有研究表明丁子香酚可抑制苹果斑点落叶病菌(Alternariamali)和腐烂病菌(Valsamali)菌丝生长,用于苹果病害防治[24-25],本研究结果亦表明该单剂具有明显的广谱性。也有研究表明,在相等剂量下,大蒜素对番茄叶霉菌的防治效果高于多菌灵和甲基托布津,表明大蒜素是一种可以替代化学药剂防治叶霉病的有效抑菌物质[26],或是与40%福星乳油和70%甲基托布津等化学农药配合施用防治脉孢霉等真菌危害[27],并能提高速效性,取得经济效益和生态效益双丰收。此外,植物源农药中藜芦碱对黑腹果蝇卵和幼虫的生物活性最高,而苦参碱对成虫的杀虫活性高,两种药剂在食用菌害虫防治中均具备较好的应用前景[28],本研究中苦参碱也具有一定的抑菌活性,表明植物源农药具有病、虫兼防的广谱性,有助于食用菌减药增效的绿色产业发展。
已有研究[29]表明,除虫菊素和印楝素对平菇(Pleurotusostreatus)菌丝生长抑制率极低,可安全用于拌料栽培防治平菇害虫。当然也有研究[30]表明,植物源农药对木耳(Auriculariaauricula)菌丝具有明显的抑制作用,且抑制率均随稀释倍数的增大而降低,其中印楝素对木耳菌丝的抑制率最高,苦参碱和除虫菊素其次。尽管植物源农药应用于食用菌生产尚存在一定限制,但是基于经济和生态效益综合考虑,可以充分利用植物源农药对光不稳定和活性成分易分解等弱点[15-16],探讨错期或错环境应用植物源农药。当然,食用菌菌丝生长以及子实体的形成都极易受外源物的影响,国家己登记且能够用在食用菌生产上的杀菌剂较少,本研究试验只限于室内,今后可将筛选出的药剂在生产上进行验证并分析食用菌中的药剂残留,明确供试药剂对食用菌的高效性与安全性。
