肠道细菌Akkermansia muciniphila在疾病调控中的作用研究进展
2021-09-16鹿欣雨综述李正堃李海燕审校
鹿欣雨综述,李正堃,李海燕审校
0 引 言
人类肠道微生物群由数万亿个微生物细胞和数千种细菌组成。大量研究显示肠道微生物对人类健康和各种疾病的发生和发展有深远影响。迄今为止,在肠道中已检测到大约50种细菌门,肠道菌群的主要门类是硬壁菌和拟杆菌门,其次是放线菌和疣微菌门[1]。肠道细菌Akkermansiamuciniphila(A.muciniphila)是疣微菌门的一种黏蛋白降解细菌,是一种椭圆形细菌,不运动且为革兰氏阴性,不形成内生孢子,可耐受低水平的氧气[2]。A.muciniphila在宿主肠黏液层中较丰富,被认为是黏液层的关键物种。对啮齿类动物研究发现A.muciniphila可降解黏蛋白为微生物群落提供单糖和寡糖,产生短链脂肪酸,这些底物可用作其他细菌和宿主的能源,而其本身可能直接影响宿主代谢[3-5]。补充A.muciniphila可增加杯状细胞的数量,并产生诸如Reg3g和LyZ1之类的抗菌肽[6],A.muciniphila还可控制硫化氢浓度,限制黏蛋白层中硫酸盐还原细菌的毒性[7]。黏液层是肠道中的一个微生态环境,黏蛋白是黏液层的主要成分,是上皮杯状细胞分泌的糖蛋白,由装饰有各种碳水化合物链的蛋白主链组成[8-9],黏液层的微生物生态学对于理解微生物群在健康和疾病中的作用至关重要。见图1。本文就A.muciniphila与各种疾病调控相关的最新认识及其可能对临床实践产生的影响作一综述。
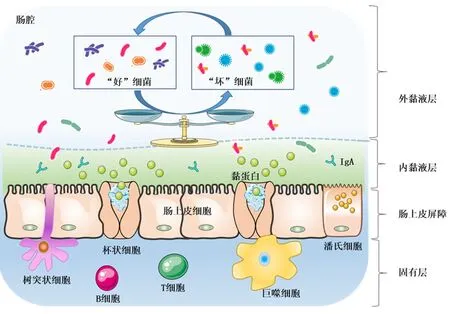
图 1 健康状态肠道菌群与肠黏液屏障
1 A.muciniphila和肥胖及其相关代谢疾病
肠道微生物群相互作用已被认为是治疗肥胖症和相关代谢疾病的研究热点[10-11]。在肠道黏液中发现的A.muciniphila对肥胖相关的代谢紊乱具有良好的作用[12-13]。研究人员发现A.muciniphila在肥胖和2型糖尿病小鼠中丰度降低,补充益生元可恢复其水平,同时证明A.muciniphila可能通过控制炎症和肠屏障功能,增加肠肽分泌的内源性大麻素含量,进而逆转高脂饮食(high-fat diet,HFD)诱导的代谢紊乱,包括脂肪增加,代谢内毒素血症,脂肪组织炎症和胰岛素抵抗[14]。A.muciniphila可改善2型糖尿病小鼠的代谢状况,恢复黏液层厚度,并抵消肥胖小鼠中HFD引起的脂多糖(Lipopolysaccharides,LPS)内毒素血症[15]。二甲双胍使用者肠道菌群中降解黏蛋白的细菌A.muciniphila和B.bifidum含量较高,二甲双胍的健康益处可能源于肠黏膜屏障的增强[16],增加A.muciniphila丰度可能有助于二甲双胍的抗糖尿病作用[17]。HFD诱导的糖尿病小鼠中,A.muciniphila衍生的细胞外囊泡给药可增强肠上皮紧密连接功能,减少体重增加并改善葡萄糖耐量[18];最近在小鼠和人类中观察到,巴氏灭活的A.muciniphila可预防饮食引起的肥胖,并能显著降低肠道中葡萄糖转运蛋白2(glucose transporter 2,GLUT2),葡萄糖转运蛋白5(glucose transporter 5,GLUT5)和钠葡萄糖共转运载体(sodium-glucose transporter 1,SGLT1)mRNA的转录水平[19]。巴氏灭活的A.muciniphila还可显著降低HFD小鼠的体重,脂肪量和葡萄糖耐量;此外,外膜蛋白Amuc_1100*通过TLR2信号参与A.muciniphila和宿主相互作用,进而改善肠屏障[20]。从人类肠道中新分离出的三种A.muciniphila菌株(EB-AMDK 10、EB-AMDK 19 和 EB-AMDK 27)可抑制体重增加、卡路里摄入量、脂肪量、脂肪生成、血清总胆固醇水平和炎症损伤,有效预防HFD诱导的肥胖和相关代谢紊乱[21]。一项在超重和肥胖人群中进行的临床研究表明每日口服补充1010活的或经过巴氏灭活的A.muciniphila3个月都是安全的,并且具有良好的耐受性[22]。基于这些干预研究显示,A.muciniphila可能是治疗肥胖相关代谢异常中非常有前途的有益微生物,有望成为治疗肥胖及其相关代谢疾病的潜在靶标。
2 A. muciniphila和肝病
肝通过门静脉从肠道获得大部分血液供应,是最易暴露于肠道潜在毒性因子及食物中生物活性成分的器官之一,肠道菌群的数量和质量变化可能影响肝病的发病机理。最近的研究表明,肠道菌群中A.muciniphila的相对丰度与各种肝病呈负相关,如非酒精性脂肪性肝病、非酒精性脂肪性肝炎和酒精性肝病[23-25]。对HFD小鼠施用A.muciniphila可降低肥胖小鼠中血清甘油三酸酯(Triglyceride,TG)和丙氨酸氨基转移酶水平,并降低肝组织中TG合成的调节剂SREBP的表达,抑制脂肪合成和炎症,从而预防肥胖小鼠脂肪肝的形成[26]。免疫介导的肝损伤模型中,A.muciniphila处理可改善Con A诱发的肝损伤,通过抑制IFN-γ,IL-1β,IL-2和IL-12p40等细胞因子表达来改变转氨酶活性和组织学损伤,起到减轻肝损害的作用[27]。大黄提取物对酒精性肝病有潜在保护作用,补充大黄能增加A.muciniphila的相对丰度,上调抗菌肽Pla2g2和RegIIIγ进一步改善肠道稳态[28]。补充二甲双胍或果寡糖可恢复A.muciniphila丰度,并增加三氯蔗糖处理的小鼠杯状细胞数量,改善非酒精性脂肪肝病的发生和发展[29]。热灭活的A.muciniphila可显著调节纤维化标志物的表达,并逆转LPS诱导的LX-2细胞中的肝星状细胞激活[30]。这些数据表明A.muciniphila在肝损伤中具有保护作用,补充A.muciniphila或许能为预防和治疗肝病提供新方向。
3 A. muciniphila和炎症性肠病
炎症性肠病(inflammatory bowel disease,IBD)受基因、先天免疫力和环境因素之间复杂的相互作用影响,肠道菌群在IBD的发展中发挥重要作用。研究表明,在葡聚糖硫酸钠(dextran sulfate sodium Salt,DSS)诱导的结肠炎小鼠中A.muciniphila的丰度显著降低,巴氏杀菌的A.muciniphila可通过减少结肠浸润型巨噬细胞和细胞毒性T淋巴细胞来减轻DSS诱导的结肠炎[31]。口服A.muciniphila可逆转低纤维饮食(low calorie diet,LCD)小鼠中由DSS诱导的严重结肠炎[32]。Bian等[33]提出A.muciniphila减轻结肠炎的一些潜在的机制:①改善结肠黏膜屏障损伤;②调节代谢功能;③重塑肠道菌群;④调节炎症反应(如抑制促炎细胞因子TNF-α、IL6、IL12A、INF-γ和IL1α表达,促进抗炎细胞因子IL-10产生)。然而,目前关于A.muciniphila对IBD的影响仍存在争议,一项研究发现A.muciniphila可充当病原体在L10-/-小鼠中促进结肠炎,研究人员推测可能由于A.muciniphila降解黏液层使得更多微生物进入肠道黏膜后增加了结肠炎的严重程度[34]。然而另一项研究表明从人类粪便中分离出的A.muciniphilaATCC BAA-835株在两到三周内不会引起L10-/-小鼠肠道炎症的发生,同时实验也发现A.muciniphila不会影响IL10-/-小鼠的黏液产生和黏液层厚度[35]。这些不一致的实验数据表明A.muciniphila和肠黏液层的复杂关系仍不清楚,不同肠炎模型中A.muciniphila对肠道炎症的不同作用机制仍有待阐明。因此,仍需要更广泛的研究来阐明A.muciniphila在IBD中的临床意义。
4 A. muciniphila和多发性硬化症
多发性硬化症(multiple sclerosis,MS)是一种具有炎症和自身免疫性质的慢性脱髓鞘疾病,实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是其理想的动物模型。越来越多的研究表明肠道菌群在MS/EAE的疾病进程中至关重要,菌群的紊乱会促进EAE的发生和发展。16S rRNA测序显示MS患者(n=60)和健康对照组(n=43)肠道微生物组相比A.muciniphila增多[36]。Cekanaviciute等[37]分析71名MS患者和71名健康人的肠道菌群发现A.muciniphila数量在MS患者肠道中显著增加,A.muciniphila可增加Th1淋巴细胞在体外的分化。此外,大麻素(THC+CBD)治疗EAE可降低疾病严重程度并促进抗炎反应,LefSE分析确定A.muciniphila是EAE疾病的潜在生物标志物,在大麻素组合处理后会降低[38]。近期一项研究发现,口服MiR-30d可通过上调β-半乳糖苷酶增加黏膜A.muciniphila丰度,进而促进肠系膜淋巴结中树突状细胞分泌Treg细胞因子来抑制EAE[39]。Chen等[40]发现A.muciniphila在用诺氟沙星治疗的EAE小鼠中增加,诺氟沙星可通过调节肠道菌群和EAE小鼠的免疫反应而对宿主产生额外的抗感染作用。这些实验结论差异提示我们A.muciniphila是否具有促炎或抗炎作用可能取决于宿主的免疫状况,肠道菌群的总体变化和干预结果是复杂的,每个细菌菌株对EAE可能有好或坏或没有影响,而所有细菌的平衡可能决定了肠道菌群的总体作用。
5 A. muciniphila和癌症
近年来越来越多研究表明肠道菌群与癌症密切相关,在癌症的发生发展及治疗中扮演着重要角色[41]。先前的研究发现,A.muciniphila水平降低与许多恶性肿瘤的发生和发展有关,A.muciniphila在肿瘤中对化疗药物和免疫检查点抑制剂的反应具有积极作用[42]。通过对比鼻咽癌患者和健康对照者的肠道菌群发现家族性鼻咽癌患者A.muciniphila明显减少[43]。来自A.muciniphila的重组蛋白Amuc_1434 *促进LS174T大肠癌细胞的凋亡并增加LS174T细胞中的ROS含量[44]。补充维生素D可抑制大肠癌的发生和发展,并增加A.muciniphila介导的结肠屏障完整性[45]。A.muciniphila处理还可降低肿瘤微环境中Treg细胞的比例,降低血清中免疫抑制细胞因子TGF-β的水平,与单一疗法相比,IL-2疗法与A.muciniphila的结合在调节Treg或TGF-β水平方面具有更强的功效,有助于增强抗肿瘤免疫反应[35]。A.muciniphila衍生的细胞外囊泡(Akk-EVs)可在前列腺癌小鼠模型中减轻肿瘤负担,提高CD8+T细胞中颗粒酶B(GZMB+)阳性和干扰素γ(IFN-γ+)阳性淋巴细胞的比例,增加M1型巨噬细胞比例[46]。活血益气配方2(HYR-2)能抑制肺癌的生长并下调PD-L1的表达,促进M2巨噬细胞向M1巨噬细胞的转化,并显著提高A.muciniphila的水平发挥抗肺癌作用[47]。以上研究结果提示,补充A.muciniphila可增加癌症患者免疫疗法的有效性,有望在肿瘤预防和诊治中发挥重要作用。
6 结语与展望
在糖尿病和肥胖中A.muciniphila被认为是一种标志物,可能通过增加肠屏障功能,调节内源性大麻素水平,产生短链脂肪酸及降低炎症等方式维持人类代谢健康。许多研究已证实,A.muciniphila能维持肠屏障完整性并表现出益生特性与抗炎作用,甚至促进了癌症免疫治疗佐剂的功效,但A.muciniphila在炎症性肠病及多发性硬化中的作用机制仍有待明确。A.muciniphila对人体健康和疾病的影响需要开展更广泛和更深入的研究,微生物成员如何响应病原体的存在而改变其在生态系统中的作用,以及其如何从普通细菌转变为有害细菌还不清楚。在任何条件下,“好细菌”并不总是有益的,“坏细菌”并不总是对宿主有害的,不同情况下,肠道菌群的群落平衡可能更为关键,“好”或“坏”细菌可能是在不同条件下的转移状态。目前A.muciniphila的临床实践数据有限,尚未确定不会引起严重副作用的最小和最大有效剂量,将来需要进行更大规模的临床研究,以保证A.muciniphila应用的安全性。未来的研究工作应更加关注A.muciniphila对宿主的作用机制,在整个微生态中的角色以及如何与其他物种协同互作,挖掘A.muciniphila的临床应用价值。
