南海冷泉活动区双壳类生物中单不饱和脂肪酸双键位置的确定及其意义
2021-09-15管红香许兰芳茅晟懿刘丽华陈宗恒
刘 磊, 管红香, 许兰芳, 茅晟懿, 刘丽华, 陈宗恒, 陶 军
南海冷泉活动区双壳类生物中单不饱和脂肪酸双键位置的确定及其意义
刘 磊1,3, 管红香1*, 许兰芳1,3, 茅晟懿1, 刘丽华1, 陈宗恒2, 陶 军2
(1. 中国科学院 广州能源研究所 天然气水合物重点实验室, 广东 广州 510640; 2. 广州海洋地质调查局 广东 广州 510075; 3. 中国科学院大学, 北京 100049)
本次研究对南海冷泉活动区福尔摩沙脊(F站位)、海马冷泉环境中与甲烷有氧氧化菌共生的贻贝(分别为和), 以及与硫氧化菌共生的蛤()腮组织中的单不饱和脂肪酸进行了结构鉴定。结果发现, 贻贝鳃组织中存在C16∶1ω9、C16∶1ω8和C18∶1ω8脂肪酸, 同时C16∶1ω8的含量远远高于C18∶1ω8, 这说明与贻贝共生的为Ⅰ型甲烷有氧氧化菌。在蛤腮组织中, 单不饱和脂肪酸C16∶1ω7、C18∶1ω7和C20∶1ω7含量极高, 表明ω7脂肪酸来源于硫氧化菌。同时, 贻贝和蛤鳃中含有大量多不饱和脂肪酸, 如C20∶2和C22∶2。在同一样品中来源于共生菌的单不饱和脂肪酸和来源于宿主的多不饱和脂肪酸具有相近的13C值, 表明宿主从共生菌或共生菌代谢产物中获得碳源和营养。Ⅰ型甲烷有氧氧化菌在贻贝腮组织中广泛存在, 指示F站位和海马冷泉活动区冷泉流体渗漏强度较弱。确定单不饱和脂肪酸的类型是判断双壳共生菌种类的基础。双壳类共生菌类型的识别, 可以帮助理解共生体与宿主之间碳源和能量的转化关系、冷泉环境中甲烷的消耗过程如碳同化途径、碳循环等。
单不饱和脂肪酸; 二甲基二硫化合物; 顺或反异构; 稳定碳同位素; 南海
0 引 言
来自热液喷口和冷泉的无脊椎动物, 如贻贝双壳类、腹足类、管状蠕虫或海绵等, 通过与细菌共生而获得碳源和营养[1-5]。共生菌通过氧化硫化物或甲烷获得碳源和能量, 同时O2作为电子受体接受电子[6]。双壳类则通过将自身固定在富甲烷和含有O2的氧化还原界面为共生菌提供一个同时具有电子供体和受体的稳定环境[6]。能通过化能共生获得碳源和能量的贻贝最初在热液喷口被发现[7]。通过光学和透射电子显微镜观察, Childress.[5]对比了墨西哥贻贝腮组织与周围甲烷源的13C特征, 从而证实了甲烷有氧氧化菌与贻贝的共生关系。随后, Brooks.[4]对美国墨西哥湾大陆坡采集的管状蠕虫和蛤类进行了酶试验、硫元素分析和CO2固定方式研究, 结果表明, 它们与细胞内的硫氧化菌共生。到目前为止, 冷泉活动区已经发现了10多种深海贻贝双壳类[8-11]。相关研究已经证明, 冷泉双壳类可以作为寄主分别与硫氧化菌[12-13]或甲烷有氧氧化菌共生[5,8], 也可以同时与这两种细菌共生[14]。迄今为止, 热液喷口和冷泉中的内共生菌培养还没有成功。这些共生菌的多样性、代谢, 以及宿主与共生体之间共生关系的证据主要来自于对共生宿主软组织的研究[2,6]。培养实验或原生环境中, 以甲烷为营养物的化能合成细菌, 如甲烷有氧氧化菌, 其脂类生物标志物表现出极亏损13C的特征[15-17]。具体来说, 甲烷有氧氧化菌和硫氧化菌分别以单不饱和脂肪酸C16∶1ω9、C16∶1ω8、C18∶1ω8和C16∶1ω7、C18∶1ω7为特征[17-20]; 此外, Ⅰ、Ⅱ和X型甲烷有氧氧化菌被证明含有不同类型的脂类生物标志物, 例如单不饱和脂肪酸C16: 1ω8含量在Ⅰ型和X型甲烷有氧氧化菌中很高; 而C18∶1ω8脂肪酸是Ⅱ型甲烷有氧氧化菌的主要成分[18-19]。同时, 贻贝组织中发现的多不饱和脂肪酸如C18∶3、C20∶2&3和C22∶2被认为是宿主贻贝来源, 因为它们在海洋无脊椎动物中占主导地位, 并且未在细菌中发现[21]。因此, 特定的脂类生物标志物可进一步用于区分甲烷有氧氧化菌的类型, 同时对碳利用路径具有重要意义, 因为Ⅰ型和X型甲烷有氧氧化菌通过磷酸核酮糖途径吸收碳[21], 而Ⅱ型甲烷有氧氧化菌则通过丝氨酸途径[22]。共生菌培养实验表明, 在低甲烷含量、高氧条件下, Ⅰ型甲烷有氧氧化菌比较活跃, 而高甲烷和低氧环境对Ⅱ型甲烷有氧氧化菌的生长有利[23-25]。
但是目前质谱直接测试单不饱和脂肪酸双键位置存在很大困难, 一方面在离子源轰击下, C═C不容易发生裂解; 另一方面在形成分子离子后, 氢原子容易发生沿碳链的重排, 所以根据质谱特征碎片离子难以判断双键在碳链中的位置[26-28]。为了确定沉积物和生物中的不饱和脂肪酸结构, 很多双键衍生化方法被应用到实践中来[29-33]。大多数识别单不饱和脂肪酸双键位置的方法, 因为冗长的样品处理过程、不适用于碳数大于24的单不饱和脂肪酸以及无法区分顺或反异构体等原因, 而未被广泛地应用于环境学和微生物研究中。目前, 常用的是一种单步骤衍生化与气相色谱-质谱(GC-MS)联用的分析方法, 主要步骤包括碘催化线性烯烃, 然后向其中添加二甲基二硫化物(DMDS)并进行加热生成脂肪酸甲酯二甲基二硫化物衍生物的方法[29,34-35]。该方法具有转化率高、步骤少和操作方便等优点, 能够成功实现单不饱和脂肪酸双键位置的识别及顺或反异构的判定[26,35-37]。实际上, 对于很多生物样品来说, 确定长链不饱和化合物中双键的位置是确定具体生物标志物的先决条件, 如单不饱和脂肪酸、长链不饱和烯烃等[38-40]。二甲基二硫化物衍生化最开始应用于实验室合成的样品中[39], 逐渐应用到昆虫信息素[31]、土壤和海洋等各种样品中[35,38]。但是实验过程中, 试剂用量、反应温度和反应时间的控制会直接影响实验的效率与结果[38]。二甲基二硫化物衍生单不饱和脂肪酸的基本原理是: 对其原双键位置进行加成, 从而形成易于检测的含甲硫基化合物(图1)。Nichols.[35]在对单不饱和脂肪甲酯进行衍生化实验时用到的试剂为二甲基二硫化物100 μL、反应时间48 h和反应温度50℃(表1); Scribe.[42]在单不饱和脂肪酸甲酯二甲基二硫化物衍生化时, 多添加了1.2 mg I2。Richter.[38]在对比前人研究的基础上, 认为I2是作为催化剂参与二甲基二硫化物衍生化中并且给出了相关的催化机理。本次研究主要是为了确定海洋生物样品中单不饱和脂肪酸结构(图1), 实验从脂肪酸甲酯开始[37]。选择添加稍过量的I2, 以达到充分转换C═C的目的[42]。在衍生化反应结束后, 适量的硫代硫酸钠水溶液可以反应未消耗完的I2。Richter.[38]衍生化烯酮时, 通过实验观测得出较低的反应温度、适当的反应时间以及I2催化剂可以实现最佳的烯酮检测效果。而对于单不饱和脂肪酸甲酯来说, 最佳的衍生化条件为过量的I2、100 μL 二甲基二硫化物、50 ℃的温度和48 h的反应时间[35,38]。
单不饱和脂肪酸是判断海洋双壳类共生菌类型的重要指标。本次研究基于南海冷泉活动区生物样品(两种贻贝:和; 一种蛤:), 应用二甲基二硫化物衍生化程序和GC-MS检测, 识别单不饱和脂肪酸结构, 对比稳定碳同位素13C值, 进而分析共生菌类别, 碳代谢机制、宿主-共生菌的碳源和能量转化关系, 旨在探讨单不饱和脂肪酸作为生物标志物判别海洋双壳类共生菌类型的适用性, 为后续分析碳循环途径及冷泉区甲烷渗漏环境奠定基础。

图1 单不饱和脂肪酸衍生化过程及GC-MS检测示意图, 修改自文献[30]

表1 前人二甲基二硫化物衍生化最佳实验条件和试剂等情况对比
注: “/”表示未添加。
1 样品采集及实验方法
1.1 样品采集和保存
2018年5月嘉庚号航次期间, 无人遥控潜水器(ROV)“ROPOS号”从南海冷泉活动区福尔摩沙脊(F站位, 水深1120 m)采集了贻贝[43-44]。2019年5月, “海马号”无人遥控潜水器在南海西北部海马冷泉活动区(1390 m)采集了贻贝和蛤样品[8,45-46]。取样位置如图所示(图2)[47]。样品采集后在船上保存在−80 ℃的冰柜中, 随后运到实验室并在−25 ℃下保存。样品在实验室解剖为鳃组织、足组织和剩余组织3部分, 用冷冻干燥机进行低温干燥并磨成粉末。
1.2 二甲基二硫化物衍生化、GC-MS和色谱-同位素比值质谱(GC-IRMS)测试
本研究分析的样品为贻贝、和蛤的腮组织部分, 称取适量样品, 用二氯甲烷、二氯甲烷/甲醇(体积比为1∶1)和甲醇溶剂分别超声提取3次, 获得总脂类提取物(TLE)。一部分干燥的总脂类提取物加入氢氧化钾的甲醇溶液(1 mol/L)在70℃下皂化2 h。皂化后的样品用正己烷萃取中性组分。为了获得脂肪酸组分, 剩余溶液加入10%盐酸至PH=2, 然后用正己烷萃取, 获得的脂肪酸旋转蒸发并转移至2 mL细胞瓶, 并在N2下吹干。在处理后的脂肪酸组分中加入适量三氟化硼甲醇溶液(BF3-CH3OH)试剂, 然后在60 ℃下衍生化2 h并萃取, 萃取液在N2下吹干得到不饱和脂肪酸甲酯。吹干后的样品中加入50 μL正己烷和100 μL二甲基二硫化合物(过量), 然后再加入500 μL碘溶液(碘的乙醚溶液), 迅速向样品中充入Ar并密封, 50℃反应48 h, 生成脂肪酸甲酯二甲基二硫化合物衍生物(图1)。冷却后, 向溶液中加入适量的硫代硫酸钠(Na2S2O3)水溶液(质量分数为5%)来还原I2并终止反应(表1)[30]。最后除去有机相, 正己烷萃取3次以上获得脂肪酸甲酯二甲基二硫化合物衍生物, 吹干并转移至2 mL细胞瓶, 加入适量正己烷, 用于GC-MS和GC-IRMS分析。
GC-MS分析在中国科学院广州能源研究所TRACE 1300-ISQQD气相色谱质谱联用仪上完成。色谱柱为DB-5毛细管色谱柱(60 m×0.32 mm, 内径×0.25 μm厚涂层)。GC-MS的升温程序如下: 初始温度60℃保留2 min, 以10℃/min的速率从60℃升至160℃; 以2℃/min的速率从160℃升至320℃并保留30 min。载气为高纯He, 流速为1.2 mL/min。GC-IRMS 分析在中国科学院地球化学研究所的GV Isoprime Hewlett-Packard 6890 GC色谱-同位素比值质谱仪上完成, 升温条件与GC-MS相同。每个样品至少测试2次, 同位素测定误差大部分小于0.8‰。碳同位素以表示, VPDB 标准。对不饱和脂肪酸二甲基二硫化合物衍生物在分析过程中增加的碳进行了碳同位素校正。
图2 生物取样位置图, 修改自文献[47]
Fig.2 Map showing the location of the sampling sites in this study, modified from reference[47]
图中黄点是南海北部目前已知的甲烷渗漏点; 红点为取样点, 活动冷泉。
The red dot and square are both the sampling sites and the active cold seeps. yellow dots are currently known methane leakage sites in the northern South China Sea.
2 结果及讨论
2.1 单不饱和脂肪酸结构分析
在气相色谱中, 不同相对分子质量的单不饱和脂肪酸甲酯二甲基二硫化合物衍生物依据不同保留时间能够很好地分开(图3)。Nichols.[35]的研究表明, 一般顺式脂肪酸甲酯二甲基二硫化合物衍生物先被分离出来, 因此在色谱图上具有较短的保留时间, 以此可以区分具有相同分子式和C═C位置的顺反结构单不饱和脂肪酸, 如图3a中的C16∶1ω7c和C16∶1ω7t顺或反异构的判定。对于质谱分析, 衍生物的质谱会显示出3个特征离子碎片峰(图1), 分子离子峰M+的相对丰度可以达到10%~30%(相对于质谱中的最高峰); 而脂肪烃端元(ω)碎片离子A+和羧基端元(Δ)碎片离子B+峰的相对丰度可高于50%[31]。我们通过分析衍生化后产物的质谱图, 可以判断原单不饱和脂肪酸的结构和双键位置。
在质谱中, 我们按照上述原则, 可以确定单不饱和脂肪酸甲酯二甲基二硫化合物衍生物的相对分子质量、双键位置[35]。图4a、图4b展示了ω7单不饱和脂肪酸甲酯二甲基二硫化合物衍生化产物的质谱图。一般来说, 通过分子离子峰可以确定化合物的相对分子质量[31,34,35,38], 如图4a中分子离子峰的质荷比为362, 确定该化合物相对分子质量为362, 为含有16个碳的原单不饱和脂肪酸。同时, 质谱中相对丰度较高的离子峰(可高于50%)为特征峰, 双键加成后带有两个甲硫基(图1), 在离子源轰击下, 容易断裂, 形成ω-碎片离子和Δ-碎片离子峰, 如图4a中特征离子峰的质荷比为145(ω-碎片)和217(Δ-碎片)。由此可得出原单不饱和脂肪酸结构为C16∶1ω7(图4a)[39]。除此之外, 我们还检测到双键位置在ω8(图4c, 图4d)和ω9(图4e, 图4f)的单不饱和脂肪酸。它们的分析方法与ω7类似, 区别在于ω7的衍生物ω-碎片质量为145, 双键在ω8的衍生物ω-碎片质量应为159(二者相差1个亚甲基的相对分子质量)。根据分子离子峰质荷比为362(图4c)可确定其为单不饱和脂肪酸C16∶1, 同时根据其特征峰(ω-碎片离子峰)质荷比为159可判断其双键位于甲基端8号碳位, 为C16∶1ω8[27]。依此类推, 双键位置在ω9的衍生物的ω-碎片质量应为173 (图4e)[35,42,48]。我们按照色谱上的出峰顺序, 逐次分析其质谱, 从而确定单不饱和脂肪酸的顺或反异构、碳数和双键位置等信息。本次研究对于单不饱和脂肪酸二甲基二硫化合物衍生物的分析详细列在表2。
2.2 南海冷泉活动区双壳中脂肪酸分布的生物地球化学意义
在本研究中, 脂类生物标志物C16∶1ω8、C18∶1ω8的出现表明, 贻贝和鳃组织中存在甲烷有氧氧化菌(表2)[16,52]。实际上, Xu.[8]分析了从海马冷泉区采集的鳃组织中的微生物16S rRNA基因, 发现其中细菌主要是由3种共生γ蛋白细菌和3种ε蛋白杆菌组成; 而中含量最丰富的γ蛋白细菌与另一种种属的甲烷营养型γ蛋白细菌相似度极高, 是甲烷有氧氧化菌存在的基因学证据。贻贝和鳃组织中C16∶1ω8绝对含量远高于C18∶1ω8, 进一步揭示了I型甲烷有氧氧化菌的存在(图3a, 图3b)[18-19,53]。培养实验显示, I型甲烷有氧氧化菌的脂肪酸比宿主略微亏损碳,13C差别2‰~4‰[52,54]。在海马冷泉区, 水合物分解释放的甲烷13C值大约是−60‰[55]。前人研究表明, F站位的贻贝和海马冷泉区贻贝软组织的13C值变化范围分别是−73‰~−70‰和−65‰~−56‰[56]。在本次研究中, 贻贝和腮组织中脂肪酸13C值的平均值分别为−73‰和−64‰ (图5, 表3), 这分别与两种宿主贻贝软组织的13C值相接近[56], 从而表明了I型甲烷有氧氧化菌在两种贻贝腮组织中占主导地位。同时, 硫氧化菌的膜脂含有大量ω7单不饱和脂肪酸, 以C16∶1ω7或者C18∶1ω7为主[18], 它们在与硫氧化菌共生的双壳类中含量很高[16], 这种特性使得ω7单不饱和脂肪酸可以作为硫氧化菌的标志化合物。在本研究中, 单不饱和脂肪酸 C16∶1ω7和C18∶1ω7在蛤的腮组织中含量极高(图3c), 证明与共生的细菌为硫氧化菌。

图3 生物样品中脂肪酸甲酯二甲基二硫化合物衍生物的气相色谱图及单不饱和脂肪酸鉴定
表示顺异构;表示反异构。

图4 典型单不饱和脂肪酸甲酯二甲基二硫化合物衍生物质谱图及结构鉴定
(a).腮组织中的C16∶1ω7二甲基二硫化合物衍生物质谱图及化合物结构; (b)腮组织中的C22∶1ω7二甲基二硫化合物衍生物质谱图及化合物结构; (c)腮组织中的C16∶1ω8二甲基二硫化合物衍生物质谱图及化合物结构; (d)腮组织中的C18∶1ω8二甲基二硫化合物衍生物质谱图及化合物结构; (e)腮组织中的C20∶1ω9二甲基二硫化合物衍生物质谱图及化合物结构; (f)腮组织中的C22∶1ω9二甲基二硫化合物衍生物质谱图及化合物结构。
(a) DMDS adduct of C16∶1ω7in.gill tissue and structure identification; (b) C22∶1ω7ingill tissue; (c) DMDS adduct of C16∶1ω8ingill tissue; (d) DMDS adduct of C18∶1ω8ingill tissue; (e) DMDS adduct of C20∶1ω9ingill tissue; (f) DMDS adduct of C22∶1ω9ingill tissue.
稳定碳同位素可以记录自然环境中碳循环的信息, 示踪共生菌和动物宿主之间的关联。除共生菌特有的单不饱和脂肪酸外, 长链脂肪酸和多不饱和脂肪酸被证明是无脊椎宿主通过利用共生菌的代谢产物进行合成, 比如C20∶1ω7和C22∶1ω7利用C18∶1ω7经C2碳链加长而产生[57-58]。一般来说, 动物宿主合成多不饱和脂肪酸如C20∶2和C22∶2的过程, 首先通过加长共生菌产生单不饱和脂肪酸的碳链, 然后在∆5或∆9处去饱和形成双键[58]。值得注意的是, 贻贝还能够将C16∶1碳链加长(C2)至C18∶1, 然后再将碳链加长至C20∶1[57]。因此, 宿主脂肪酸和共生体脂肪酸单体碳同位素的差异可用于评价共生菌对宿主碳源和能量的贡献[16,52]。本次研究同一样品中, 共生菌产生的单不饱和脂肪酸和宿主合成的多不饱和脂肪酸具有相近的13C值, 表明宿主直接从共生菌或共生菌代谢产物中获得碳源(表3)。同时, 与贻贝共生的甲烷有氧氧化菌类型也能够反映冷泉流体的渗漏特征。培养实验发现, Ⅰ型甲烷有氧氧化菌主要发育于冷泉流体渗漏强度较弱, 含氧量较高的冷泉环境中; 而Ⅱ型甲烷有氧氧化菌在含氧量低和甲烷分压较高的环境中占主导[23-25]。在本研究中, 贻贝和鳃组织中的甲烷有氧氧化菌均为Ⅰ型, 表明福尔摩沙脊和海马冷泉活动区的甲烷渗漏活动均较弱。总的来说, 单不饱和脂肪酸结构和双键位置的识别为微生物参与的有机生物地球化学过程分析提供了基础。贻贝和鳃组织中甲烷有氧氧化菌类型的判定, 为研究南海冷泉活动区氧化还原界面碳循环途径和微生物消耗甲烷机理提供生物地球化学基础。
3 结 论
(1) 二甲基二硫化合物衍生化程序和GC-MS检测, 可以实现色谱分离顺或反异构体, 质谱确定单不饱和脂肪酸的双键位置。
(2) 生物标志物C16∶1ω8、C18∶1ω8的发现证实了贻贝鳃组织中存在甲烷有氧氧化菌, 其中C16∶1ω8脂肪酸都相对高于C18∶1ω8脂肪酸, 揭示了其共生菌为Ⅰ型甲烷有氧氧化菌的特征, 从而指示F站位和海马冷泉活动区较弱的甲烷渗漏活动。蛤腮组织中检测到相对高含量的脂肪酸C16∶1ω7、C18∶1ω7和C20∶1ω7, 证明硫氧化菌的存在。
(3) 同一样品中宿主-共生菌合成的脂肪酸具有较接近的13C特征, 表明宿主直接从共生菌或共生菌代谢产物中获得碳源和能量。单不饱和脂肪酸的检测和结构确定是鉴别冷泉区双壳类共生菌种类的基础, 对判断海底环境、碳利用路径分析和有机生物地球化学研究等具有重要意义。
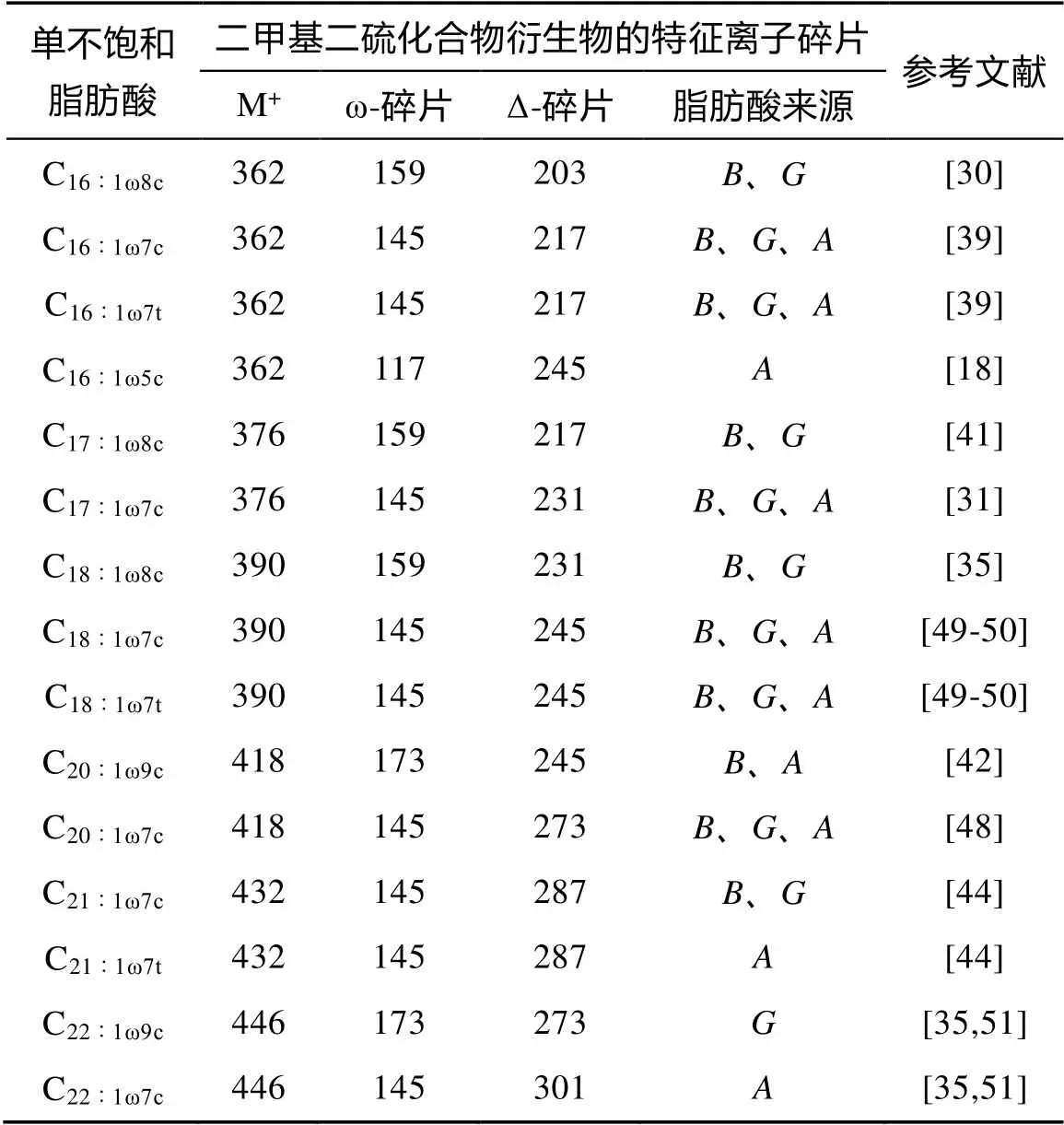
表2 单不饱和脂肪酸甲酯二甲基二硫化合物衍生物特征离子碎片、碳数、双键位置和顺或反异构判定情况
注: “ω-碎片”指含有脂肪烃的端元; “Δ-碎片”指含有羧基的端元。-腮组织;-腮组织;-腮组织。

图5 G. haimaensis鳃组织样品中脂肪酸的部分气相色谱图
表示顺异构;表示反异构。
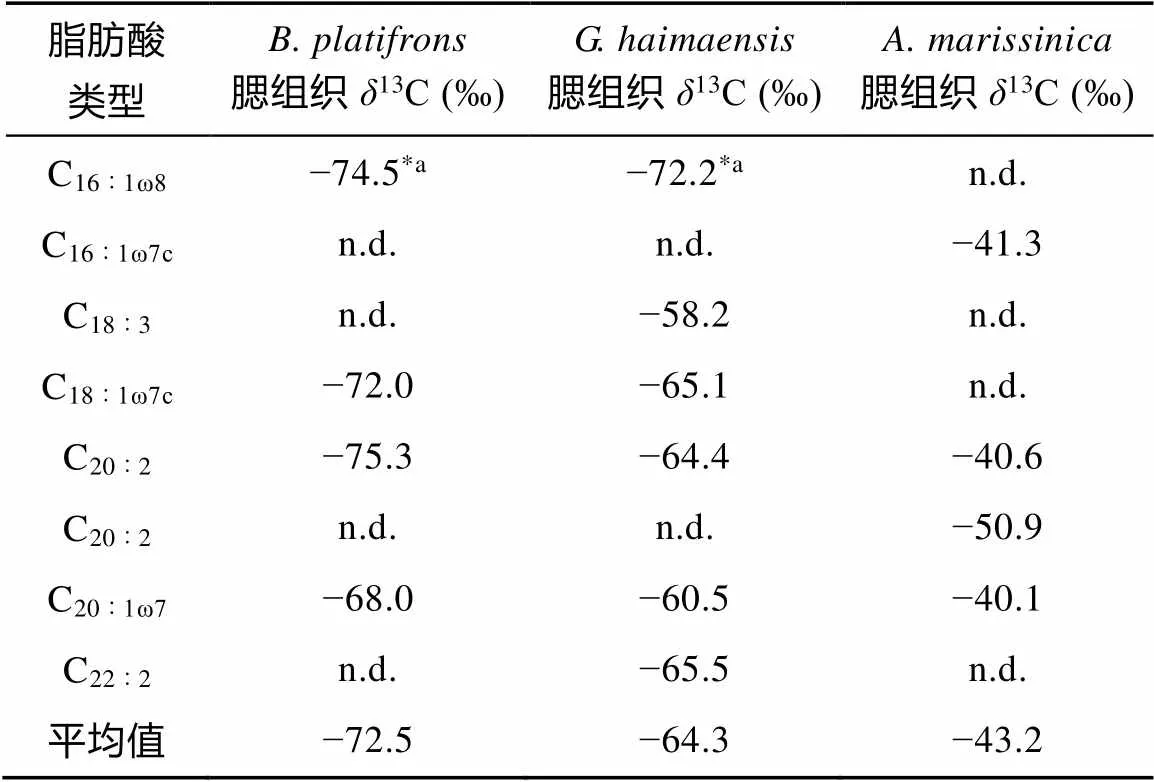
表3 生物样品贻贝B. platifrons、G. haimaensis和蛤A. marissinica腮组织中脂肪酸的单体碳同位素特征
注: n.d.表示未检测到;*a表示C16∶1ω8+ C16∶1ω7。
感谢海马号、母船海洋六号、“ROPOS”号和母船嘉庚号全体科考人员采集的生物样品; 感谢中国科学院广州能源研究所刘世君博士的技术支持。同时也感谢《地球化学》编辑部及两位匿名审稿人对本文提出的建设性意见。
[1] Duperron S, Gaudron S M, Lemaitre N, Bayon G. A microbiological and biogeochemical investigation of the cold seep tubeworm Escarpia southwardae (Annelida: Siboglinidae): Symbiosis and trace element composition of the tube[J]. Deep Sea Res Part I Oceanogr Res Paper, 2014, 90: 105-114.
[2] Duperron S, Lorion J, Samadi S, Gros O, Gaill F. Symbioses between deep-sea mussels (Mytilidae: Bathymodiolinae) and chemosynthetic bacteria: Diversity, function and evolution[J]. Compt Rend Biol, 2009, 332(2/3): 298-310.
[3] Fisher C R, Childress J J, Oremland R S, Bidigare R R. The importance of methane and thiosulfate in the metabolism of the bacterial symbionts of 2 deep-sea mussels[J]. Mar Biol, 1987, 96(1): 56-71.
[4] Brooks J M, Kennicutt M C, Fisher C R, Macko S A, Cole K, Childress J J, Bidigare R, Vetter R D. Deep-sea hydrocarbon seep communities-evidence for energy and nutritional carbon- sources[J]. Science, 1987, 238(4830): 1138-1142.
[5] Childress J J, Fisher C R, Brooks J M, Kennicutt M C, Bidigare R, Anderson A E. A methanotrophic marine molluscan (bivalvia, mytilidae) symbiosis-mussels fueled by gas[J]. Science, 1986, 233(4770): 1306-1308.
[6] Murrell J C. The aerobic methane oxidizing bacteria (methanotrophs) [M]. Timmis K N. Handbook of Hydrocarbon and Lipid Microbiology. Heidelberg: Springer, 2010: 1953- 1966.
[7] Rau G H, Hedges J I. Carbon-13 depletion in a hydrothermal vent mussel: Suggestion of a chemo-synthetic food source[J]. Science, 1979, 203(4381): 648-649.
[8] Xu T, Feng D, Tao J, Qiu J W. A new species of deep-sea mussel (Bivalvia: Mytilidae:) from the South China Sea: Morphology, phylogenetic position, and gill-associated microbes[J]. Deep Sea Res Part I Oceanogr Res Paper, 2019, 146: 79-90.
[9] Duperron S, Gros O.and sulfur-oxidizing bacteria: An unusual dual symbiosis in amussel (Mytilidae: Bathymodiolinae) from whale falls in the Antilles arc[J]. Deep Sea Res Part I Oceanogr Res Paper, 2016, 115: 112-122.
[10] Faure B, Schaeffer S W, Fisher C R. Species distribution and population connectivity of deep-sea mussels at hydrocarbon seeps in the Gulf of Mexico[J]. Plos One, 2015, 10(4): 1-19.
[11] Cordes E E, Bergquist D C, Fisher C R. Macro-ecology of gulf of Mexico cold seeps[J]. Ann Reve Mar Sci, 2009, 1: 143-168.
[12] Distel D L, Lane D L, Olsen G J, Giovannoni S J, Pace B, Pace N R, Stahl D A, Felbeck H. Sulfur-oxidizing bacterial endosymbionts-analysis of phylogeny and specificity by 16S rRNA sequences[J]. J Bacteriol, 1988, 170(6): 2506-2510.
[13] Cavanaugh C M. Symbiotic chemoautotrophic bacteria in marine-invertebrates from sulfide-rich habitats[J]. Nature, 1983, 302(5903): 58-61.
[14] Fisher C R, Brooks J M, Vodenichar J S, Zande J M, Childress J J, Burke Jr R A. The co-occurrence of methanotrophic and chemoautotrophic sulfur-oxidizing bacterial symbionts in a deep-sea mussel[J]. Mar Ecol, 1993, 14(4): 277-289.
[15] Pond D W, Bell M V, Dixon D R, Fallick A E, Segonzac M, Sargent J R. Stable-carbon-isotope composition of fatty acids in hydrothermal vent mussels containing methanotrophic and thiotrophic bacterial endosymbionts[J]. Appl Environ Microbiol, 1998, 64(1): 370-375.
[16] Kellermann M Y, Schubotz F, Elvert M, Lipp J S, Birgel D, Prieto-Mollar X, Dubilier N, Hinrichs K U. Symbiont-host relationships in chemosynthetic mussels: A comprehensive lipid biomarker study[J]. Org Geochem, 2012, 43: 112-124.
[17] Jahnke L L, Nichols P D. Methyl sterol and cyclopropane fatty-acid composition of methylococcus-capsulatus grown at low oxygen-tensions[J]. J Bacteriol, 1986, 167(1): 238-242.
[18] Bowman J P, Skerrat J H, Nichols P D, Sly L I. Phospholipid fatty-acid and lipopolysaccharide fatty-acid signature lipids in methane-utilizing bacteria[J]. Fem Microbiol Ecol, 1991, 85(1): 15-22.
[19] Nichols P D, Smith G A, Antworth C P, Hanson R S, White D C. Phospholipid and lipopolysaccharide normal and hydroxy fatty-acids as potential signatures for methane-oxidizing bacteria[J]. Fem Microbiol Ecol, 1985, 1(6): 327-335.
[20] Jannasch H W. The chemosynthetic support of life and the microbial diversity at deep-sea hydrothermal vents[J]. Proc Royal Soc Series B Biol Sci, 1985, 225(1240): 277--297.
[21] Dunstan G A, Volkman J K, Barrett S M. The effect of lyophilization on the solvent-extraction of lipid classes, fatty- acids and sterols from the oyster crassostrea-gigas[J]. Lipids, 1993, 28(10): 937-944.
[22] Jahnke L L, Summons R E, Hope J M, Marais D J D. Carbon isotopic fractionation in lipids from methanotrophic bacteria II: The effects of physiology and environmental parameters on the biosynthesis and isotopic signatures of biomarkers[J]. Geochim Cosmochim Acta, 1999, 63(1): 79-93.
[23] Hanson R S, Hanson T E. Methanotrophic bacteria[J]. Microbiol Rev, 1996, 60(2): 439-471.
[24] Amaral J A, Archambault C, Richards S R, Knowles R. Denitrification associated with groups I and II methanotrophs in a gradient enrichment system[J]. Fem Microbiol Ecol, 1995, 18(4): 289-298.
[25] Boetius A, Wenzhöfer F. Seafloor oxygen consumption fuelled by methane from cold seeps[J]. Nat Geosci, 2013, 6(9): 725- 734.
[26] 孔祥波, 赵莉蔺, 张真, 王鸿斌. 一种用于昆虫性信息素成分单不饱和双键定位的简便方法[J]. 昆虫学报, 2010, 53(6): 634-639. Kong Xiang-bo, Zhao Li-lin, Zhang Zhen, Wang Hong-bin. A simple method to determine the double bond position in monounsaturated insect pheromone compounds[J]. Acta Entomol Sinica, 2010, 53(6): 634-639 (in Chinese with English abstract).
[27] Carlson D A, Roan C S, Yost R A, Hector J. Dimethyl disulfide derivatives of long-chain alkenes, alkadienes, and alkatrienes for gas-chromatography mass-spectrometry[J]. Anal Chem, 1989, 61(14): 1564-1571.
[28] 张继跃, 虞启涛, 黄知恒. 质谱法对长链不饱和脂肪酸和其它双官能团不饱和化合物的双键定位[J]. 质谱学报, 1987, 8(1): 1-14. Zhang Ji-yue, Yu Qi-tao, Huang Zhi-heng. Double bond localization of long chain unsaturated fatty acids and other bifunctional unsaturated compounds by mass spectrometry[J]. J Chinese Mass Spectr Soc, 1987, 8(1): 1-14 (in Chinese with English abstract).
[29] Shibamoto S, Murata T, Lu W J, Yamamoto K. Preparation of dimethyl disulfide adducts from the mono-trans octadecadienoic acid methyl esters[J]. Lipids, 2018, 53(6): 653-659.
[30] Dunkelblum E, Tan S H, Silk P J. Double-bond location in monounsaturated fatty acids by dimethyl disulfide derivatization and mass spectrometry: Application to analysis of fatty acids in pheromone glands of four lepidoptera[J]. J Chem Ecol, 1985, 11(3): 265-277.
[31] Buser H R, Arn H, Guerin P, Rauscher S. Determination of double-bond position in monounsaturated acetates by mass- spectrometry of dimethyl disulfide adducts[J]. Anal Chem, 1983, 55(6): 818-822.
[32] Murata T, Ariga T, Araki E. Determination of double bond positions of unsaturated fatty acids by a chemical ionization mass spectrometry computer system[J]. J Lipid Res, 1978, 19(2): 172-176.
[33] Capella P, Zorzut C M. Determination of double bond position in monounsaturated fatty acid esters by mass spectrometry of their trimethylsilyloxy derivatives[J]. Anal Chem, 1968, 40(10): 1458-1463.
[34] Shibamoto S, Murata t, Yamamoto K. Determination of double bond positions and geometry of methyl linoleate isomers with dimethyl disulfide adducts by GC/MS[J]. Lipids, 2016, 51(9): 1077-1081.
[35] Nichols P D, Guckert J B, White D C. Determination of monosaturated fatty acid double-bond position and geometry for microbial monocultures and complex consortia by capillary GC-MS of their dimethyl disulphide adducts[J]. J Microbiol Method, 1986, 5(1): 49-55.
[36] Méjanelle L, Laureillard J, Saliot A. Novel marine flagellate fatty acid: Structural elucidation by GC-MS analysis of DMOX derivatives and DMDS adducts[J]. J Microbiol Method, 2002, 48(2): 221-237.
[37] Imai H, Yamamoto K, Shibahara A, Miyatani S, Nakayama T. Determining double-bond positions in monoenoic 2-hydroxy fatty acids of glucosylceramides by gas chromatography-mass spectrometry[J]. Lipids, 2000, 35(2): 233-236.
[38] Richter N, Dillon J T, Rott D M, Lomazzo M A, Seto C T, Huang Y S. Optimizing the yield of transient mono-dimethyl disulfide adducts for elucidating double bond positions of long chain alkenones[J]. Org Geochem, 2017, 109: 58-66.
[39] Leonhardt B A, Devilbiss E D. Separation and double-bond determination on nanogram quantities of aliphatic monounsaturated alcohols, aldehydes and carboxylic acid methyl esters[J]. J Chromatogr A, 1985, 322: 484-490.
[40] Yamamoto K, Shibahara A, Nakayama T, Kajimoto G. Determination of double-bond positions in methylene-interrupted dienoic fatty acids by GC-MS as their dimethyl disulfide adducts[J]. Chem Phys Lipid, 1991, 60(1): 39-50.
[41] Francis G W, Veland K. Alkylthiolation for the determination of double-bond positions in linear alkenes[J]. J Chromatogr, 1981, 219(3): 379-384.
[42] Scribe P, Guezennec J, Dagaut J, Pepe C, Saliot A. Identification of the position and the stereochemistry of the double-bond in monounsaturated fatty-acid methyl-esters by gas-chromatography mass-spectrometry of dimethyl disulfide derivatives[J]. Anal Chem, 1988, 60(9): 928-931.
[43] Feng D, Chen D F. Authigenic carbonates from an active cold seep of the northern South China Sea: New insights into fluid sources and past seepage activity[J]. Deep Sea Res II Topic Stud Oceanogr, 2015, 122: 74-83.
[44] Feng D, Cheng M, Kiel S, Qiu J W, Yang Q H, Zhou H Y, Peng Y B, Chen D F. Usingtissue stable carbon, nitrogen and sulfur isotopes to infer biogeochemical process at a cold seep in the South China Sea[J]. Deep Sea Res I Oceanogr Res Pap, 2015, 104: 52-59.
[45] Liang Q Y, Hu Y, Feng D, Peckmann J, Chen L Y, Yang S X, Liang J Q, Tao J, Chen D F. Authigenic carbonates from two newly discovered active cold seeps on the northwestern slope of the South China Sea: Constraints on fluids sources, formation environments and seepage dynamics[J]. Deep Sea Res I Oceanogr Res Pap, 2017, 124: 31-41.
[46] Chen C, Okutani T, Liang Q Y, Qiu J W. A noteworthy new species of the family Vesicomyidae from the South China Sea (Bivalvia: Glossoidea) [J]. Venus, 2018, 76(1/4): 29-37.
[47] Feng D, Qiu J W, Hu Y, Peckmann J, Guan H X, Tong H P, Chen C, Chen J X, Gong S G, Li N, Chen D F. Cold seep systems in the South China Sea: An overview[J]. J Asian Earth Sci, 2018, 168: 3-16.
[48] Vincenti M, Guglielmetti G, Cassani G, Tonini C. Determination of double-bond position in diunsaturated compounds by mass-spectrometry of dimethyl disulfide derivatives[J]. Anal Chem, 1987, 59(5): 694-699.
[49] Shibahara A, Yamamoto K, Kinoshita A, Anderson B L. An improved method for preparing dimethyl disulfide adducts for GC/MS analysis[J]. J Am Oil Chem Soc, 2008, 85(1): 93-94.
[50] Shibahara A, Yamamoto K, Nakayama T, Kajimoto G. Rapid determination of double bond positions in monounsaturated fatty acids by GC-MS and its application to fatty acid analysis[J]. J Japan Oil Chem Soc, 1985, 34(8): 618-625.
[51] Nichols P D, Shaw P M, Johns R B. Determination of the double bond position and geometry in monoenoic fatty acids from complex microbial and environmental samples by capillary GC-MS of their Diels-Alder adducts[J]. J Microbiol Method, 1985, 3(5/6): 311-319.
[52] Jahnke L L, Summons R E, Dowling L M, Zahiralis K D. Identification of methanotrophic lipid biomarkers in cold-seep mussel gills-chemical and isotopic analysis[J]. Appl Environ Microbiol, 1995, 61(2): 576-582.
[53] Niemann H, Lösekann T, de Beer D, Elvert M, Nadalig T, Knittel K, Amann R, Sauter W J, Schlüter M, Klages M, Faucher J P, Boetius A. Novel microbial communities of the Haakon Mosby mud volcano and their role as a methane sink[J]. Nature, 2006, 443(7113): 854-858.
[54] Summons R E, Jahnke L L, Rocsandic T. Carbon isotopic fractionation in lipids from methsnotrophic bacteria: Relevance for interpretation of the geochemical record of biomarkers[J]. Geochim Cosmochim Acta, 1994, 58(13): 2853-2863.
[55] Fang Y, Wei J, Lu H, Liang J, Lu J, Fu J, Cao J. Chemical and structural characteristics of gas hydrates from the Haima cold seeps in the Qiongdongnan Basin of the South China Sea[J]. J Asian Earth Sci, 2019, 182: 1-7.
[56] Feng D, Peckmannc J, Li N, Kiel S, Qiu J W, Liang Q Y, Carney R S, Peng Y B, Tao J, Chen D F. The stable isotope fingerprint of chemosymbiosis in the shell organic matrix of seep-dwelling bivalves[J]. Chem Geol, 2018, 479: 241-250.
[57] Zhukova N V. The pathway of the biosynthesis of non-methylene-interrupted dienoic fatty acids in molluscs[J]. Comparat Biochem Phys Part B Comparat Biochem, 1991, 100(4): 801-804.
[58] Gregor Fullarton J, Dando P R, Sargent J R, Southwards A J, Southward E C. Fatty acids of hydrothermal ventand inshore bivalves containing symbiotic bacteria[J]. J Mar Biol Assoc UK, 1995, 75: 455-468.
Determination of double bond position in monounsaturated fatty acid in bivalves in active cold seeps of South China Sea and its significance
LIU Lei1,3, GUAN Hong-xiang1*, XU Lan-fang1,3, MAO Sheng-yi1, LIU Li-hua1, CHEN Zong-heng2and TAO Jun2
1. Key Laboratory of Gas Hydrate, Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China; 2. China Guangzhou Marine Geological Surveys, Guangzhou 510075, China;3. University of Chinese Academy of Sciences, Beijing 100049, China
In this study, the structures of monounsaturated fatty acids were analyzed in gill tissues of two mussels (and) and one clam (), symbiotic with methanotrophic and thiotrophic bacteria, respectively. The results showed that C16∶1ω9, C16∶1ω8, and C18∶1ω8were present in the gill tissues of both mussels, and the content of C16 : 1ω8was much higher than that of C18∶1ω8, indicating that type I methanotrophic bacteria were predominant in the gill tissues of mussels. In the clam gill tissue, the content of monounsaturated fatty acids C16∶1ω7, C18∶1ω7, and C20∶1ω7were extremely high, indicating the presence of thiotrophic bacteria.At the same time, mussel and clam gill tissues contained a large amount of polyunsaturated fatty acids, such as C20∶2and C22∶2. In the same sample, the monounsaturated fatty acids derived from symbiotic bacteria and the polyunsaturated fatty acids of the host exhibited similar13C values, which suggests the host obtained nutrition either directly from the symbionts or from symbiont-derived carbon. Type I methanotrophic bacteria were widely found in mussel gill tissues, indicating that cold spring fluid leakage intensities are weak at both site F and Haima seeps. Identifying the type of monounsaturated fatty acid is the foundation for identifying the type of symbiont bacteria in bivalves. Moreover, the study of carbon assimilation pathways, carbon cycling, and transformation between symbionts and hosts will contribute to the understanding of methane consumption under aerobic methane oxidation.
monounsaturated fatty acids; dimethyl disulfide;orisomerism;13C; South China Sea
P593; X142
A
0379-1726(2021)03-0294-11
10.19700/j.0379-1726.2021.03.007
2019-08-20;
2019-11-07;
2019-11-13
国家自然科学基金(91958105); 青岛海洋科学与技术国家实验室开放基金(QNLM2016ORP0210)
刘磊(1993-), 男, 硕士研究生, 海洋地质专业。E-mail: liulei@stu.ouc.edu.cn
Corresponding author):GUAN Hong-xiang, E-mail: guanhongxiang@ouc.edu.cn; Tel: +86-20-532-66781971
