HEK-293细胞培养过程中支原体污染处理初探
2021-09-15易蓉鑫杨齐之贤梁易晓周祖灵孙永科杨玉艾
易蓉鑫,杨齐之贤,梁易晓,周祖灵,孙永科,杨玉艾
(云南农业大学动物医学院,云南昆明 650000)
良好的细胞培养技术是成功培养细胞的前提,目前细胞培养是现代生物科学中发展得十分迅速的一项重要实验技术,也是研究病毒与研制疫苗等生物产品的基础技术[1-3]。
人胚肾293细胞(HEK-293细胞)是最常用于包装及扩增腺病毒载体的工具细胞,在细胞培养中,支原体污染是最常见、不易察觉和干扰试验结果的污染物,对后续的科研和生产极其不利[4]。据调查,实验室中30%~60%的细胞株都被支原体污染过,是细胞培养,特别是传代细胞的培养中的严重问题,其污染来源主要是操作者及小牛血清。支原体的检测及清除方法虽然众多,但比较复杂费时,且难以清除干净,本研究采用PCR及DNA荧光染色法检测支原体污染,目的是应用大环内酯类和四环素类2种药物有效地清除支原体污染,为更好地展开细胞研究奠定基础[5-8]。
1 材料与方法
1.1 材料
1.1.1 细胞和犊牛血清 试验中所用细胞为云南农业大学细胞保存中心存有的HEK-293细胞及其传代细胞;胎牛血清由美国BI公司生产。
1.1.2 主要试剂 细胞培养液(DMEM,High Glucose)和胰酶、细胞冻存液、大环内酯类抗生素TransMyco-1和四环素类衍生物TransMyco-2(Lot#N10923)、支原体检测试剂盒(TransDetect PCR Mycoplasma Detection Kit),Transgen公司产品;二甲基亚砜(DMSO),华美生物工程公司产品;四甲基偶氮唑盐(MTT),美国Sigma公司产品。
1.1.3 主要仪器设备 倒置相差显微镜,明美光电有限公司产品;CO2恒温培养箱,美墨尔特贸易有限公司产品; PCR仪,东胜国际贸易有限公司产品;电泳凝胶成像系统,上海天能科技有限公司产品;酶标仪,帝肯贸易有限公司产品。
1.2 方法
1.2.1 细胞的培养
1.2.1.1 复苏 从液氮罐中取出细胞冻存管,立即投入37 ℃水浴,不断摇动至迅速融化,待融化后用移液枪轻轻吸出,加入到事先37 ℃预热好的培养液中,稍微吹打混匀,1 000 r/min离心5 min,去除上清,加入适量培养液温和混匀制成细胞悬液,以1×105个/mL的密度接种于25 cm2的培养瓶中,在37℃、体积分数为5%的CO2,饱和湿度下培养。
1.2.1.2 传代 原代培养的HEK-293细胞培养48 h后,换液1次,细胞长至80%融合度时,用PBS缓冲液缓慢冲洗2次,250 mg/mL的胰酶消化1 min~2 min,轻轻吹打使细胞脱壁、悬浮、分散,获得细胞悬液,1 000 r/min离心5 min后去除上清,加入适量培养液温和混匀,传代扩增细胞。
1.2.1.3 冻存 传代的细胞处于对数生长期,大概60%~70%融合度时,可以进行冻存,冻存前1 d细胞换液,贴壁的细胞用常规方法制成细胞悬液,1 000 r/min离心5 min后去除上清,使用冻存液,按照冻存管大小分装0.5 mL~1.5 mL每管,拧紧管口,标注好细胞名称及冻存时间,在4 ℃放置30 min后存放至-80 ℃保存。长期保存则需要放置于液氮罐中保存。
1.2.2 药物半数抑制浓度(IC50)检测 采用MTT法检测药物IC50。取细胞数为1×105个/mL的对数生长期HEK-293细胞100 μL,接种于96孔培养板,随机分成空白对照组、TransMyco-1组、TransMyco-2组及联合用药组,每组设置5个复孔。对照组加入相同的培养基,TransMyco-1组和TransMyco-2组均按照1∶50、1∶100、1∶200的比例配制,联合用药组两种药物均按照1∶100加入,每孔100 μL设5个复孔。置于37 ℃、体积分数为5%的CO2,饱和湿度培养72 h后,加入MMT培养4 h,2 000 r/min离心10 min弃上清,加入DMSO置摇床上充分混匀1 h。
在酶标仪上以530 nm波长测定各孔吸光光度OD值,计算细胞存活率。细胞存活率=(每组平均OD值-试剂空白/对照组OD值-试剂空白)×100%,用细胞存活率做出量效曲线,用作图法得出不同用药方式与浓度对细胞的IC50。
1.2.3 支原体的清除 将解冻融化至室温的大环内酯类抗生素TransMyco-1和四环素类抗生素TransMyco-2分别以1∶100的比例加入到无双抗的培养基中,配制成10 mg/mL药物浓度的培养液。取对数生长期的HEK-293细胞,设置5个分组,在37℃、体积分数为5%的CO2,饱和湿度下培养24 h,采用以下3种方案清除支原体。
(1)分别单独使用:在支原体污染的细胞传代或继续培养时,换上添加了药物的培养基,待细胞培养至生长融合度80%时,可以取样培养液进行支原体检测。
(2)联合使用:在支原体污染的细胞传代或继续培养时,换上同时添加了2种药物的培养基,待细胞培养至生长融合度80%时,取样培养液进行检测。
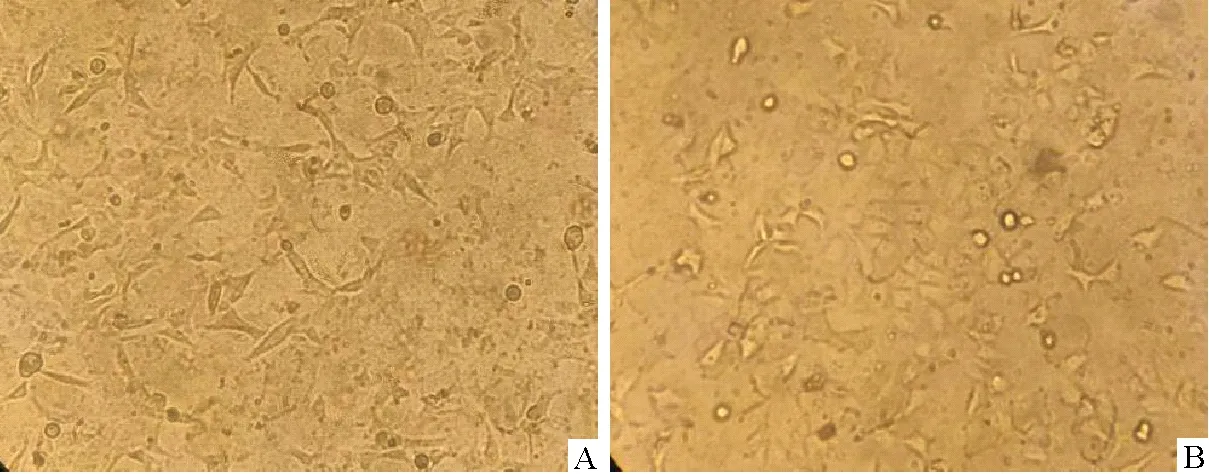
A.传代3次的细胞;B.传代5次的细胞
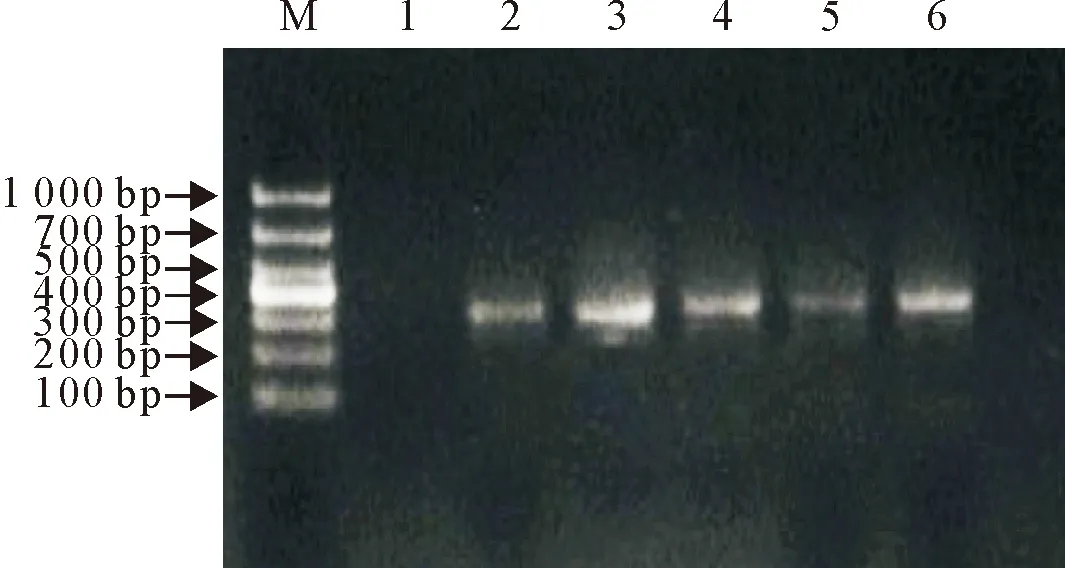
M.DNA标准DL 1 000;1.阴性对照;2~5.待试验的HEK-293细胞PCR检测结果;6.阳性对照
(3)交替使用:在支原体污染的细胞传代或继续培养时,换上添加了TransMyco-1的培养基,并保持污染的细胞在此环境下培养4 d,之后换上添加了TransMyco-2的培养液继续培养3 d,以上操作作为一个周期,重复两个循环周期后,取样培养液进行支原体检测。
含有抗生素的培养基应当现配现用,在短期内一个周使用,避免反复冻融。另外,HEK-293细胞增殖较快,为了降低传代次数,可以适当降低细胞接种密度,使药物充分作用。留取0、4、8、12、16 h的细胞及培养液进行支原体检测。
1.2.4 支原体检测试剂盒的使用 使用支原体检测试剂盒(TransDetect PCR Mycoplasma Detection Kit)进行操作:取40 μL细胞培养液放入干净的PCR管内,置于PCR仪中95 ℃热处理10 min后作为PCR模板。PCR反应体系:模板2 μL,水7.6 μL,PCR预混液10 μL,支原体引物0.4 μL,总计20 μL。反应条件:94 ℃ 4 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环;72℃ 5 min。取10 μL的PCR产物进行15 g/L琼脂糖凝胶电泳分析并拍照,通过与阴阳性对照检测结果的比较,确定支原体的污染情况,阳性条带大小约350 bp。
1.2.5 DNA荧光染色法检测支原体 检测分以下6个步骤进行:①首先,将待测细胞接种到盖玻片上,用培养液培养48 h,采用有支原体污染的HEK-293细胞作为阳性对照,无支原体污染的细胞作为阴性对照;②吸出培养液,用1∶3的冰醋酸/甲醇固定液固定15 min,重复1次,吸出固定液,室温干燥;③用PBS稀释Hoechst 33258储存液,使浓度为5 μg/mL,将染液滴加到固定好的细胞上,室温避光染色30 min;④用双蒸水浸泡洗涤5 min,重复3次;⑤滴加1滴含有10 mL/L甘油的柠檬酸缓冲液到细胞上封片,将有细胞的一面向下,覆盖在载玻片上;⑥在荧光显微镜下观察细胞的荧光分布状态,判断有无支原体污染及污染程度。
2 结果
2.1 支原体污染的HEK-293细胞检测结果
在倒置显微镜下观察可见,传代HEK293细胞状态不佳,细胞边缘模糊,生物特性差,生长缓慢,随着培养代次的增加,细胞逐渐死亡消失(图1),4个分组的HEK-293细胞PCR电泳结果显示,支原体检测均为阳性(图2)。
2.2 不同药物对细胞存活率的影响
采用MTT法检测药物IC50,Transmyco-1和Transmyco-2单独使用对HEK-293细胞的生长有轻微影响,其作用呈浓度依赖性;2种药物联合使用时,有抑制细胞生长作用,细胞存活率减低(图3)。

图3 两种药物对HEK-293细胞的存活率-药物浓度曲线
2.3 用药后的细胞状态及PCR检测结果
在细胞培养液中加入2种抗生素药物按1∶100进行单独使用、联合使用及交替使用的处理,在处理前及处理后4、8、12、16 d分别取细胞培养液留样,用支原体检测试剂盒进行PCR检测,电泳结果显示2种抗生素药物交替使用的治疗效果最为显著。
未使用药物处理的HEK-293细胞检测结果显示,均存在支原体污染,检测结果显示阳性;用1∶100的TransMyco-1和TransMyco-2分别单独处理后8 d后样本中仍显示弱阳性,继续处理8 d后转为阴性;2种药物的联合使用显示12 d后阴性,但交替使用效果显著,12 d后电泳结果显示转变为阴性(图4)。

A.4 d;B.8 d;C.12 d;D.16 d;M.DNA标准DL 1 000;1.阴性对照;2.TransMyco-1处理的PCR检测结果;3.TransMyco-2处理的PCR检测结果;4.2种药物联合使用处理的PCR检测结果;5.2种药物交替使用处理的PCR检测结果;6.阳性对照
倒置显微镜下观察细胞状态,2种药物联合使用后细胞损伤较大,生长缓慢状态较差(图5A);交替使用时细胞生长速度较快,状态良好(图5B)。
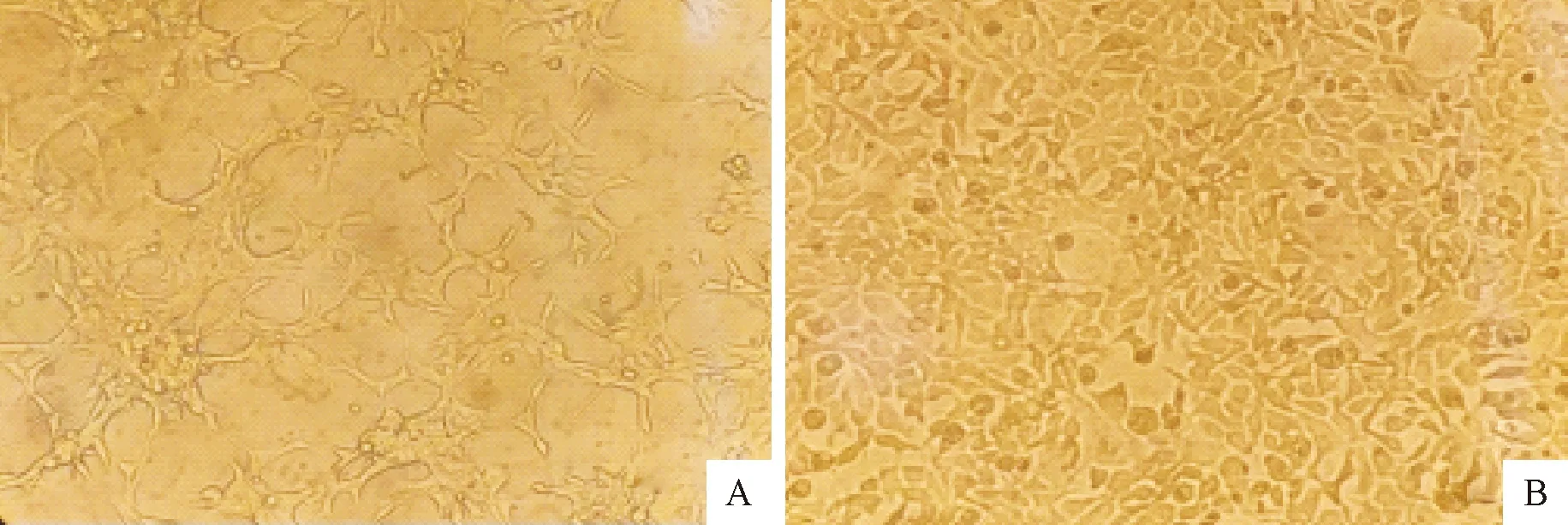
A.联合用药的细胞状态;B.交替用药的细胞状态A.Cell status of combination therapy;B.Cell status of alternating therapy
2.4 DNA荧光染色法检测结果
用Hoechst 33258荧光染色的细胞在荧光显微镜下观察,染色剂会结合到DNA中A-T含量较高的区域,在荧光显微镜下发蓝光。无支原体污染的细胞只有细胞核显色,细胞表面及周围清晰干净,无荧光小点(图6)。
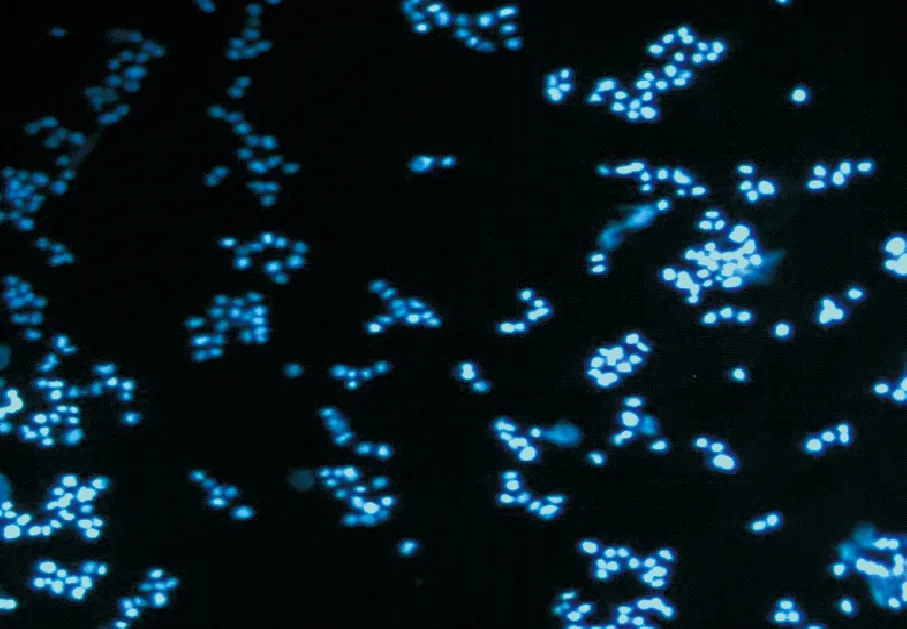
图6 无支原体污染的HEK-293细胞(40×)
有支原体污染的HEK-293细胞,细胞核与细胞质及其周围均可见散在的蓝色荧光颗粒或丝状小点,形状一致,其密集程度与污染呈正相关(图7)。

图7 支原体污染的HEK-293细胞(40×)
3 讨论
支原体的污染十分常见且污染早期不容易被发现,它会吸附在细胞的表面,破坏细胞膜的完整性,影响细胞信号的传递;消耗细胞的核苷酸库,引起细胞染色体的异常变化,同时还会改变细胞的分泌功能,降低其活性[9]。
目前对支原体的检测和治疗方法虽然众多,但单一的方法都不够理想,本试验采用支原体PCR检测试剂盒,特异性高,操作简便迅速,对于处理以后的细胞再进行DNA荧光检测,提高支原体的清除的确定性[10-11]。通过MTT试验,进一步优化了细胞的用药量,在治疗支原体的基础上,保证不影响细胞正常生长。与常规的支原体清除方法相比,灵敏度高,特异性强,操作简单,且避免了假阳性、支原体清除不彻底、药物抑制细胞生长等问题。
随着技术的发展,新的检测手段在不断建立和完善,但对于支原体的治疗与去除尚无完美的方法,本试验采用通过大环内酯类抗生素TransMyco-1和四环素类抗生素TransMyco-2的使用,探索2种药物不同作用方式之间的差别及效果,为细胞支原体污染的净化提供新的治疗思路。虽然不同的方法均能有效控制支原体污染的问题,但支原体主要来源于操作者的呼吸道和小牛血清,因此在探索新的清除方法的同时,应当着重于支原体污染的预防[12]。
在试验中发现,单独使用抗生素处理污染的细胞,随着培养时间的增加,存在支原体污染复发的现象。因此并不能立即停药,需要再继续加药处理[13]。通过Hoechst 33258荧光染色检测,发现交替用药的支原体清除效果最佳,药物单独作用处理的细胞疑似处理不彻底,细胞生长状态逐渐变差,且同一种抗生素药物使用次数过多或是使用时间超过6周时,一些细胞会出现耐药性,支原体污染开始重新反复出现,可以考虑采取不同药物交替使用,轮流对细胞进行处理。在本试验中可以看到,交替使用的效果相比其他用药方式治疗效果也更为显著[14]。综上,可以考虑使用不同种抗生素交替使用来治疗支原体的污染,可取得较为显著的效果。
细胞培养需要一个高度清洁的环境,但各种污染是难以避免的,除严格按照规范的实验程序操作以外,应当定期对实验室细胞及培养物进行支原体检测,做到有效的预防与控制[15-18]。通过本次试验,使得细胞支原体污染得以控制,希望从中总结经验方法,为潜在支原体的预防与清除提供依据,以便更好地开展各项细胞研究奠定基础[19-21]。
