斯氏艾美耳球虫四川株生物学特性研究
2021-09-15罗跃军华瑞其魏闻芮陶园园杨光友
罗跃军,肖 洁,华瑞其,魏闻芮,陶园园,杨光友
(四川农业大学动物医学院,四川成都 611130)
近年来养兔业发展迅猛,已成为畜牧业的重要组成部分。四川省是我国肉兔养殖大省和兔肉消耗大省,每年出栏量、存栏量、兔肉产量均占全国的1/3以上[1-2]。兔球虫病(rabbit coccidiosis)是由艾美耳属(Eimeria)的多种球虫所引起的一种寄生性原虫病。目前公认的兔球虫有11个有效种[3],其中斯氏艾美耳球虫(Eimeriastiedai)是唯一一种侵害兔肝胆管上皮细胞的兔球虫,亦是兔球虫中最早发现、致病性最强的一种,常引起兔的发病与死亡。不同地域的斯氏艾美耳球虫分离株的生物学特性描述存在差异,尤其是致病性差异较大[4-6]。为此,本试验研究了斯氏艾美耳球虫四川株生物学特性,以期为后续兔斯氏艾美耳球虫病免疫及防控等研究提供参考。
1 材料与方法
1.1 材料
1.1.1 试验用动物及虫株 试验用动物为四川农业大学动物寄生虫病研究中心自繁自养的新西兰白兔。26日龄断奶后饲养于经过火焰烘烤消毒后的铁丝笼中,饲料经高温干燥,饮水中加入抗球虫药地克珠利、磺胺氯吡嗪,自由采食。期间利用饱和食盐水漂浮法检查有无球虫卵囊。感染前停药7 d。
斯氏艾美耳球虫四川株由四川农业大学动物寄生虫病研究中心分离并保存。
1.1.2 主要试剂 饱和食盐水为在1 000 mL沸水中加入380 g食用盐,搅拌至完全溶解,然后冷却至室温,常温保存备用。25 mg/mL重铬酸钾溶液为称取10 g重铬酸钾加入400 mL蒸馏水搅拌完全溶解,常温保存备用。
1.1.3 主要仪器 低温高速离心机、微量移液器,德国Eppendorf公司产品;电子天平,上海仪器厂产品;恒温培养箱,Thermo公司产品;光学显微镜,Olympus公司产品。
1.2 方法
1.2.1 致病性、免疫原性的试验分组 将45只36日龄幼兔随机分成9组,第1组为空白对照组,第2组~第9组为试验组,其中第2组~第5组为致病性试验组,于50日龄每只兔分别经口感染1×104、5×104、1×105、2×105个孢子化卵囊;第6组~第9组为免疫原性试验组,于36日龄每只兔分别口服接种5×102、5×103、1×104、5×104个孢子化卵囊,14 d后给予2×105个孢子化卵囊的感染量。
感染后观察所有兔的精神状态、饮食欲等;若出现死亡,记录死亡时间并剖检。感染后的8 d~28 d,每天利用麦克马斯特法检测各组平均克粪便卵囊数(oocysts per gramme,OPG) ,每隔7 d记录1次体重。于感染后第28天处死所有试验兔,观察肝脏病变并记分,测定肝指数、相对增重率等。肝指数=肝重/体重×100%;相对增重率=试验组平均增重/对照组平均增重×100%;病变记分参考孟庆玲[6]等提出的5分制:0分为无病变;1分表示表面有1个~10个粟粒状结节;2分表示表面有11个~50个豆状结节或部分融合为泡状的大结节;3分表示表面有50个~100个泡状大结节;4分表示肝高度肿胀,表面有许多融合的泡状大结节;5分表示表面泡状结节融合为团块状。利用SPSS22.0进行方差分析,对肝指数、平均增重、相对增重率进行组间的显著性检验。
1.2.2 潜隐期、排卵高峰期、最短孢子化时间及卵囊大小的测定 感染后的8 d~28 d,每天利用饱和食盐水漂浮法检测并利用麦克马斯特法测定每克粪便中的卵囊数,确定最小潜隐期、排卵高峰期。收集病死兔粪便和肝脏中的卵囊,加入适量25 mg/mL重铬酸钾溶液混匀,于27 ℃恒温培养箱中培养。每3 h~6 h吸取少量混合液在显微镜下观察卵囊的发育情况,直至卵囊中出现折光体,记录最短孢子化时间。用显微镜在400倍镜下测定100个以上的孢子化卵囊,记录大小并计算形状指数。
2 结果
2.1 致病性试验结果
2.1.1 不同感染剂量的临床症状 感染后各试验组出现不同程度的临床症状:早期第2组、第3组症状不明显,感染后期表现为食欲减退,精神沉郁,喜卧;消瘦,腹泻偶有便秘;可视黏膜轻度黄染,腹围稍有增大。而第4组、第5组在感染早期便出现明显症状,主要表现为食欲废绝,可视黏膜黄染,腹围膨大,肝区触诊有痛感;后期出现死亡,死亡发生于感染后9 d~14 d,死亡率分别为20%和40%(表1)。
2.1.2 不同感染剂量的卵囊排出 除第1组外,各试验组在感染后13 d开始排出卵囊,OPG在16 d~19 d快速上升,于22 d~23 d达到最高值,其后持续大量排出卵囊。不同剂量组的OPG有差异,第5组最多可达2.8×106个,其他依次是第4组、第3组,第2组(图1)。
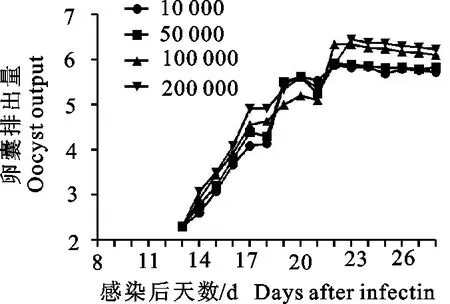
图1 不同接种剂量OPG变化规律
2.1.3 不同感染剂量的相对增重率与肝指数 相较于第1组,感染后各试验组增重均有不同程度降低:第2组、第3组增重影响轻微,相对增重率始终保持在80%以上,而第4组、第5组增重降低明显,相对增重率最低仅17%,后期个别试验兔出现负增长(图2)。感染后28 d,处死各组试验兔,计算肝指数发现,第2组肝指数显著大于第1组(P<0.05),其余3组肝指数与第1组肝指数差异极显著(P<0.01),肝指数与感染剂量成正相关(表1)。
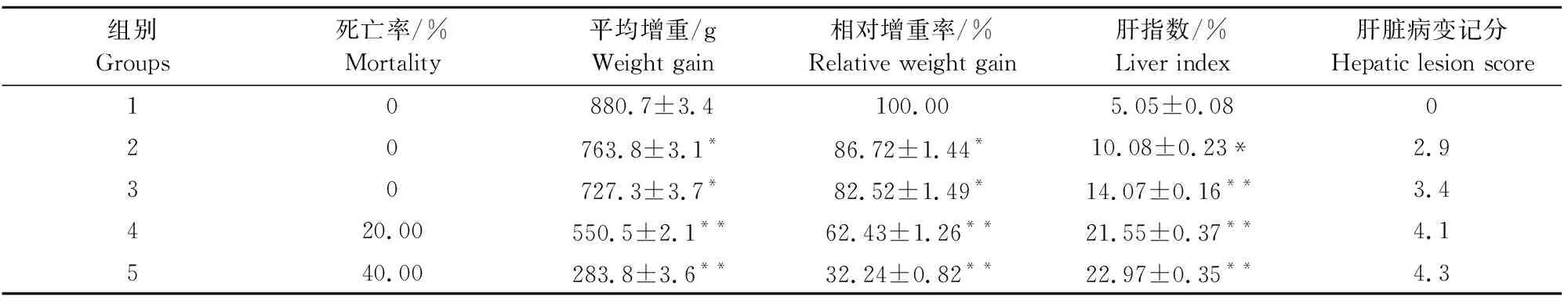
表1 致病性试验检测指标
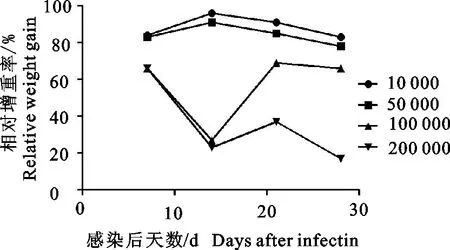
图2 不同感染剂量组的相对增重率
2.1.4 不同感染剂量的病理变化与病变记分 剖检发现,试验组均出现明显肝脏病理变化。第2组病变相对轻微,肝肿胀不明显,有一定数量的粟粒状或豆状结节,有的有少许泡状结节;第3组肝脏轻微肿胀,肝表面有一定量的泡状大结节;第4组、第5组肝脏明显肿胀,甚至占据腹腔的1/3,肝脏表面有大量融合的泡状大结节,胆囊高度肿胀,充满黄色渗出物,腹水明显,膀胱积尿(图3A)。各致病性试验组的肝脏病变记分分别为2.9、3.4、4.1、4.3,随感染剂量增加而增加(表1)。
2.2 免疫原性试验
2.2.1 不同免疫剂量的临床症状 免疫后各组并未出现明显症状,但在经口感染2×105个孢子化卵囊后先后出现与第5组相似的临床症状。除第9组外,第6组、第7组、第8组均出现了死亡,第6组死亡率与第5组相同为40%,其余两组死亡率分别是20%和20%,最早发生于免疫后7 d(表2)。
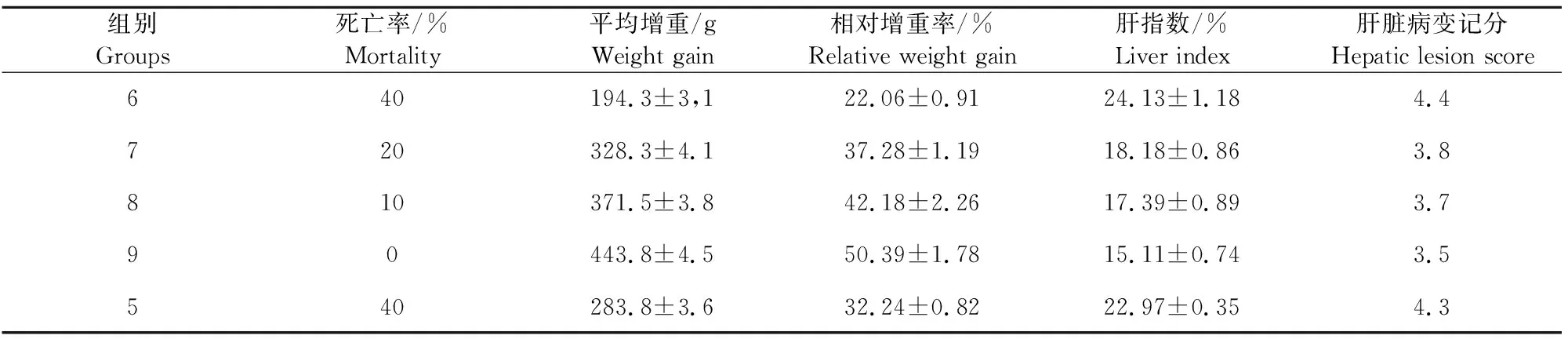
表2 免疫原性试验检测指标
2.2.2 不同免疫剂量的卵囊排出量 2×105个孢子化卵囊攻虫后至处死期间,除第9组有减少卵囊排出外,其余各免疫组均不能减少甚至会增加卵囊排出(图4)。
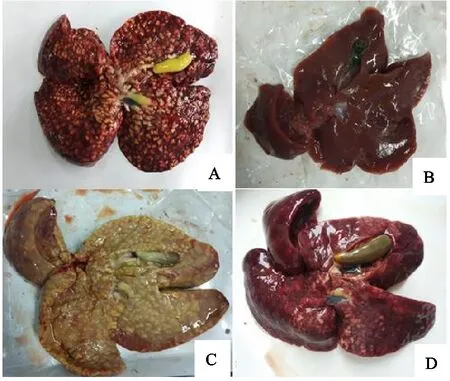
A.2×105;B.空白对照组;C.5×102;D.5×104
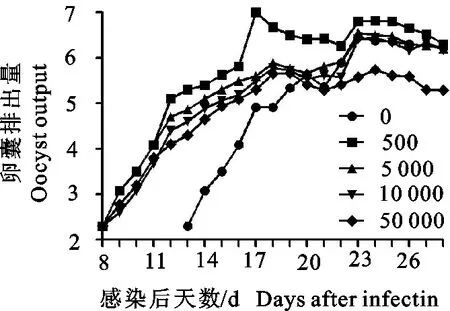
图4 不同免疫剂量组卵囊排出变化
2.2.3 相对增重率和肝指数 攻虫后每7 d测定一次体重,计算相对增重率。第9组增重能持续保持高于第5组;第8组则基本与第5组相近;而其余各组增重均低于第5组(图5)。处死时各免疫组增重均明显低于第1组。从肝指数来看,虽然第7组、第8组、第9组一定程度低于第5组,但均远远高于第1组;而第6组甚至高于第5组(表2)。
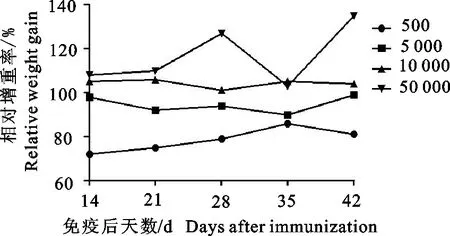
图5 不同免疫剂量组相对增重率
2.2.4 病理变化与病变记分 剖检发现各免疫组均出现明显肝脏病理变化。第9组病变相对轻微,肝脏稍肿胀,有一定数量的泡状大结节,胆囊增生,内容物尚有一定流动性(图3D)。第7组、第8组肝脏病变与第5组相似,只是表面泡状结节稍少。而第6组病变则更严重,肝脏高度肿胀呈淡黄色,表面充满沿小胆管分布的融合的大泡状结节;胆囊扩张,充满细胞碎片和虫体且无流动性(图3C)。
2.3 潜隐期、排卵高峰期、最短孢子化时间及卵囊大小
本试验中一次感染不同剂量斯氏艾美耳球虫后最早于第13天排出卵囊,即最短潜隐期为13 d;排卵高峰为感染后的22 d~23 d,且22 d~28 d均排出大量卵囊(图1);斯氏艾美耳球虫四川株在27 ℃恒温培养41 h出现明显的折光体,即最短孢子化时间为41 h,粪便和肝脏中分离的卵囊没有明显差别。试验测定斯氏艾美耳球虫四川株卵囊平均大小为36.2 μm(28.2 μm~38.1 μm)×19.9 μm(17.80 μm~22.3 μm);卵囊指数为1.81。
3 讨论
3.1 斯氏艾美耳球虫四川株的致病性
各年龄阶段的家兔均易感斯氏艾美耳球虫,成年兔一般呈隐性感染,是带虫者亦是传染源;幼兔感染时临床症状较明显,甚至死亡,严重危害养兔业的发展;感染造成肝功能指标、血液生化指标发生明显改变,降低实验兔的科研价值。斯氏艾美耳球虫的致病性与虫株、感染量密切相关。本试验表明随着感染量的增大,试验兔会出现食欲废绝,可视黏膜黄染,腹围膨大,肝区触诊痛感等临床症状;死亡率、卵囊排出量、肝指数、病变记分均会升高。其中死亡率最高可达40%,较阿拉尔株[4]、兰州株[6]的60%偏低,略高于景谨等[7]报道的37.5%,而张海芬等[5]、陈士恩等[8]报道当攻虫剂量达到6.4×105个死亡率可达100%,且本试验中死亡主要出现在感染的急性病变期;试验兔肝指数最高可达22.97%,高于阿拉尔株[4]的17.9%,低于兰州株[6]的28%;而相对增重会明显减少,相比于对照组最高减少67.76%的增重,高于景谨等[7]报道的54.37%和张海芬等[5]报道的61.1%。总的来说,本试验株的致病性较强。
除虫株、感染量外,斯氏艾美耳球虫的致病性还与家兔的日龄、品种密不可分。有研究表明,20日龄以下的仔兔由于缺乏分泌胆酸盐的能力而不易感,断奶后由于食物刺激幼兔分泌胆酸盐的能力增强而变得易感[9-10]。目前斯氏艾美耳球虫的致病性多是对于新西兰白兔的研究,对于其他养殖品种如獭兔、长毛兔等的研究还待加强。
3.2 斯氏艾美耳球虫四川株的免疫原性
关于斯氏艾美耳球虫免疫原性的研究较少,井波等[4]设计了1×103个、5×103个共2个免疫梯度,但其免疫保护效果较差。本试验设计了5×102个、5×103个、1×104个、5×104个共4个免疫梯度,结果显示除5×104免疫组保护效果稍好外,其他各组免疫保护效果都不尽如人意,表明斯氏艾美耳球虫四川株的免疫原性较差。另外有学者探索了不同的免疫方式,发现小剂量多次免疫或能提高免疫效果。对于斯氏艾美耳球虫这种免疫原性较差的虫种,或许通过筛选保护性抗原探索重组亚单位疫苗不失为一种选择。
3.3 潜隐期、排卵囊高峰期、最短孢子化时间及卵囊大小
在公认的兔球虫中,斯氏艾美耳球虫个体较大,一般呈长卵圆形。斯氏艾美耳球虫子孢子在肠内脱囊需要移行并借助循环系统才能到达寄生部位,所以其潜隐期较肠球虫长[11],四川株的最小潜隐期是13 d,与已报道的阿拉尔株相似[12],短于兰州株的14 d[13]。
通过监测感染后8 d~28 d的OPG,从13 d开始排出卵囊,在16 d~19 d卵囊排出量急剧增加,在22d ~23 d达到高峰并在此后几天持续大量排出,可于22 d后收集大量卵囊。不同地理株球虫的卵囊排出规律不同[14-15],四川株的排卵高峰在22 d~23 d,略早于阿拉尔株的24 d[12]。除虫株和试验兔的个体差异外,卵囊排出量与感染量也存在直接关系,在感染量较少时,有充足未破坏的胆管上皮细胞为虫体的发育提供条件,卵囊排出量与感染量成正相关;而当感染量达到一定数量时,裂殖生殖产生的裂殖子超过了上皮细胞的数目,就会造成后续的裂殖生殖和配子生殖缺少足够的发育条件,最终导致卵囊排出量反而下降。
本试验收集了粪便和肝脏的斯氏艾美耳球虫于27 ℃恒温培养,折光体最早出现于41 h后,即最短孢子化时间为41 h,二者并无明显差异。斯氏艾美耳球虫对温度较为敏感,10 ℃以下、45 ℃以上不能孵化,70 ℃作用10 min可杀死卵囊,最适宜的温度是20 ℃~32 ℃[17]。本试验虫株的最短孢子化时间为41 h(27℃培养),而阿拉尔株为33 h(29 ℃培养)[12],兰州株为35 h(29 ℃培养)[13]。
本试验测定的斯氏艾美耳球虫四川株孢子化卵囊的平均大小为36.2 μm(28.2 μm~38.1 μm)×19.9 μm(17.80 μm~22.3 μm),卵囊指数为1.81;而阿拉尔株的卵囊大小为36.4 μm(31.3 μm~38.7 μm)×22.8 μm(19.1 μm~27.8 μm),卵囊指数仅为1.59[12];兰州株的卵囊大小为35.2 μm(32.3 μm~38.5 μm)×20.6 μm(18.6 μm~25.7 μm),卵囊指数为1.71[13],可见斯氏艾美耳球虫四川株略小于其他分离株,但较修长。
