颅脑超声联合血清NSE、S100β 及IL-6 检测在早产儿脑白质损伤诊断中的应用
2021-09-15孙艳娟吴玉华
孙艳娟, 吴玉华
(1.宁夏医科大学总医院超声科,银川 750004; 2.宁夏医科大学总医院新生儿科,银川 750004)
脑实质的缺血缺氧性改变是早产儿最常见的脑损伤形式,如果缺血缺氧得不到及时地改善,随着时间的推移,将会在脑室周围脑白质区最先形成坏死软化灶,引发脑白质损伤,是相对较严重的一种脑白质损伤类型,这类损伤多出现在不足32 周的早产儿[1]。小胎龄早产儿的出生体重通常偏低,据统计有3%~5%的极低体质量儿(500~1500 g)会发生脑室周围白质软化[2]。严重脑白质损伤可引起脑瘫、智能发育障碍、视听障碍、癫痫、早期死亡等脑损伤综合征,其后果十分严重。目前,国内外对于脑白质损伤尚无明确的治疗手段,早期诊断及干预决定了患儿的预后情况,因此,如何尽早诊断新生儿的脑白质损伤受到临床医生的高度重视。颅脑超声是临床筛查早产儿脑白质损伤的重要手段,但其不能较好地显示直径较小的囊性病灶及非囊性病灶,并且筛查结果容易受到胎儿囟门大小、操作技术等因素的影响,所以仍可能发生漏误诊[3]。近期有研究[4]指出,多种血清生化标志物在脑白质受损后的24 h 内会明显升高,如白细胞介素-6(IL-6)、S100β、神经元特异性烯醇化酶(NSE)等,可能为临床早期诊断脑白质受损提供参考依据。本研究对早产儿脑白质损伤者行颅脑超声及血清NSE、S100β、IL-6 联合检测,以探讨联合检查对早产儿脑白质损伤的应用价值。
1 资料与方法
1.1 研究对象
选取2017 年11 月至 2019 年9 月在本院出生的60 例脑白质损伤早产儿作为研究组,另选取同期分娩的仅有轻度缺血缺氧无明显脑白质损伤的60 例早产儿作为对照组。纳入标准:1)胎龄<37 周;2)无神经系统发育异常、感染性疾病、蛛网膜下腔出血;3)患儿家属对本研究知情同意并签署知情同意书。研究组中男性33 例,女性27 例,胎龄 30~35 周,平均胎龄(32.35±1.08)周,阴道分娩36 例,剖宫产24 例,患儿符合脑白质损伤诊断标准[5],并经颅脑MRI 确诊;对照组中男性31 例,女性29 例,胎龄29~36 周,平均胎龄(33.69±1.33)周,阴道分娩 40 例,剖宫产 20 例。两组早产儿的性别构成、胎龄、分娩方式比较差异均无统计学意义(P均>0.05)。该研究通过了本院医学伦理委员会审核,获得批准,患者均知情同意。
1.2 观察指标和检测方法
所有早产儿接受颅脑超声检查及血清NSE、S100β、IL-6 检测。
1.2.1 颅脑超声检查 仪器选用阿洛卡a-10 彩色超声诊断仪,高频突阵探头:7~9 MHz。两组早产儿均在出生后24 h、72 h 及出生后1 周各行1次颅脑超声检查。若超声影像显示脑室旁白质区回声增强,且质地粗糙、不均匀,则判定为存在脑白质损伤。若同时可见脑室周围强回声,且向外辐射至皮层下,即判定为弥漫性脑白质损伤。对于有脑白质损伤的患儿,若连续3 次进行颅脑超声监测可见脑白质损伤征象减弱,则为轻度脑白质损伤;若连续3 次的颅脑超声监测可见病灶持续恶化、发展为软化灶,则为重度脑白质损伤。颅脑超声检查将脑白质损伤分为水肿期(可见脑室回声增强,通常发生在出生后1 周内)、囊腔形成前期(脑室周围回声基本正常,通常发生在出生后第1~3 周)、囊腔形成期(多发生于出生后2 周)、囊腔消失期(多发生于出生后数月)。
1.2.2 血清学指标检测 两组早产儿均在出生后 24 h、72 h 采集外周静脉血(5 mL),使用高速离心机离心(转速 3000 r·min-1)处理 5 min,保留上层血清待检。使用美国雅培公司生产的全自动时间分辨荧光免疫分析系统及配套试剂测定血清NSE 水平,并使用双抗体夹心酶联免疫法测定血清IL-6、S100β 水平。所有操作均严格按照试剂盒说明书进行。
1.3 统计学方法
采用SPSS 20.0 统计软件进行数据分析,计数资料比较采用χ2检验,计量资料采用均数±标准差()表示,采用t检验,通过绘制受试者工作特征曲线(ROC 曲线)分析各项指标单独与联合检测对早产儿脑白质损伤的诊断效能。P≤0.05为差异有统计学意义。
2 结果
2.1 颅脑超声对脑白质损伤的检出情况
两组早产儿出生后24 h、72 h 及1 周后的颅脑超声对脑白质损伤检出率差异均有统计学意义(P均<0.05),见表1。早产儿脑白质损伤的超声图像见图1。图1 A 显示早产儿双侧侧脑室内出血,可见侧脑室后角周边脑白质回声明显增强,图1B 为早产儿右侧豆状核区脑白质内出血(30+4周)。

图1 早产儿脑白质损伤的超声图像

表1 两组早产儿出生后24 h、72 h 及1 周后颅脑超声对脑白质损伤检出率的比较[例(%)]
2.2 两组早产儿血清NSE、S100β、IL-6 水平比较
研究组早产儿出生24 h 的血清NSE、S100β、IL-6 水平均高于对照组(P均<0.05);研究组早产儿出生72 h 的血清NSE、S100β 水平均高于对照组(P均<0.05),IL-6 水平与对照组比较差异无统计学意义(P>0.05),见表 2。
表2 两组早产儿的血清 NSE、S100β、IL-6 水平比较()
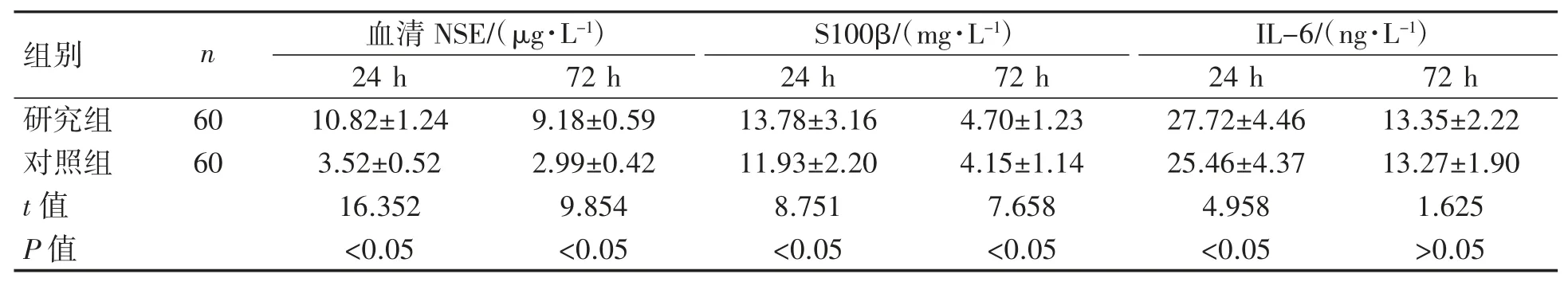
表2 两组早产儿的血清 NSE、S100β、IL-6 水平比较()
组别 n研究组 60对照组 60 t 值P 值血清NSE/(μg·L-1)S100β/(mg·L-1)IL-6/(ng·L-1)24 h 72 h 24 h 72 h 24 h 72 h 10.82±1.24 9.18±0.59 13.78±3.16 4.70±1.23 27.72±4.46 13.35±2.22 3.52±0.52 2.99±0.42 11.93±2.20 4.15±1.14 25.46±4.37 13.27±1.90 16.352 9.854 8.751 7.658 4.958 1.625<0.05 <0.05 <0.05 <0.05 <0.05 >0.05
2.3 血清 NSE、S100β、IL-6、颅脑超声对早产儿脑白质损伤的诊断效能
绘制早产儿出生后24 h 血清 NSE、S100β、IL-6、颅脑超声及四项联合预测早产儿脑白质损伤的 ROC 曲线(图 2)。ROC 曲线图显示:相比四项单独检测,四项联合检测的曲线下面积(AUC)值最大,其诊断灵敏度、特异度最高,分别为 94.32%、93.54%,见表 3。

表3 出生后24 h 血清NSE、S100β、IL-6、颅脑超声及四项联合对脑白质损伤的诊断效能

图2 血清NSE、S100β、IL-6、颅脑超声及四项联合诊断脑白质损伤的ROC 曲线图
3 讨论
研究[6]显示,新生儿脑白质损伤的发生主要与脑部缺氧缺血、感染、脑部发育不成熟等因素有关。由于早产儿脑白质损伤在早期通常无明显特异性临床表现,所以临床很难通过临床症状予以判定,但是由于早期脑白质损伤的病理改变较轻微,此时采取相应的干预措施可阻止病情进展,对于改善患儿预后具有重大意义。
在新生儿脑白质损伤的临床诊断中,影像学手段具有重要作用。颅脑超声检查具有操作简单、无创伤、无辐射、可重复性好、价格低廉等优势,而且随着近年来超声仪器的升级,颅脑超声对新生儿脑组织的显示准确性、敏感度越来越高,是临床上诊断新生儿脑白质损伤的首选影像学手段[7]。对于胎龄不足30 周的早产儿,在出生后都应行颅脑超声检查,并应在校正胎龄36~40周时进行复查,以明确是否存在颅脑损伤。研究[8]证实,新生儿的脑白质损伤程度与颅脑超声测得的超声灰度值有正相关关系,表明颅脑超声对脑白质损伤有较高的诊断价值。但是颅脑超声诊断新生儿脑白质损伤的灵敏度、特异度仍不及MRI,虽然MRI 对脑白质损伤的诊断效能更高,但是也存在费用昂贵,不适合长期监测,不便于进行床旁检查的特点,因此很难将MRI 作为新生儿脑白质损伤的常规筛查手段。研究[9]报道,颅脑超声对直径较小的囊性及非囊性病灶的诊断敏感性并不高,有较高的漏、误诊风险。本研究中,60 例脑白质损伤早产儿在出生后24 h 经颅脑超声检查仅检出90.00%,出生后72 h、1 周仅检出86.67%、85.00%。表明单纯的颅脑超声检查对早产儿脑白质损伤仍有一定的局限性,与王洁翡等[10]的报道结论相符。可能与颅脑超声技术本身对较小的脑白质损伤病灶分辨率有限有关,另外还可能与颅脑超声成像质量对操作者技术、经验依赖性较大有关。鉴于此,临床有必要以颅脑超声作为基础配合其他特异性指标,制订新的诊断方案,以提高脑白质损伤的诊断准确性。
有研究[11-12]指出,多种血清生化标志物在早产儿脑白质损伤早期就呈现出高表达,并且这种高表达会持续较长一段时间,所以临床或可将其作为诊断新生儿脑白质损伤的新指标。NSE 是反映神经元损伤程度的特异性、敏感性指标,在神经元受损后,细胞内的NSE 会迅速进入血液及脑脊液中,从而引起血清NSE 高表达。血清NSE水平能够反映神经元死亡程度,是反映脑损伤的特异性、敏感性指标。脑白质损伤发生后,受损脑细胞会向血液中释放出NSE 等多种蛋白质,研究[12]认为,检测这些蛋白质在血液中的浓度,将有助于了解脑白质损伤的程度及范围。本次研究显示,研究组早产儿出生后24 h、72 h 的血清NSE水平均高于对照组,其在早产儿出生24 h对脑白质损伤的诊断灵敏度、特异度分别为93.42%和87.70%。该结果与相关报道[13]结论相符,说明血清NSE 与早产儿脑白质损伤密切相关,对脑白质损伤有较高的诊断价值。但是标本久置或溶血可导致结果异常偏高,因此标本应当在抽取后6 h 内进行NSE 测定或立即分离血清后冰冻保存,以确保检测结果的准确性。
IL-6 主要由神经胶质细胞合成、分泌,广泛分布于大脑皮质、下丘脑、海马等中枢神经系统区域。研究[14]显示,存在有脑组织损伤的情况下,IL-6 的表达会明显增加。脑白质损伤早期,机体通常有一定程度的免疫功能紊乱,IL-6 可促进脑内钙离子超载,其虽然不会直接发挥神经毒性作用,但其可与其他炎性细胞因子协同作用,刺激炎性细胞间黏附因子发挥细胞毒性作用。S100β蛋白为神经胶质细胞标志类蛋白,其主要存在于神经系统星形胶质细胞中,S100β 蛋白分子通常不会穿透血脑屏障,但若发生脑白质受损,神经胶质细胞和组织功能失衡就可能引起神经细胞变性、水肿、坏死,大量的S100β 蛋白分子就会穿透血脑屏障进入血液,从而引起S100β 水平升高。本研究结果显示,研究组早产儿出生24 h 的IL-6、S100β 水平均高于对照组,S100β 对脑白质损伤的灵敏度、特异度分别为84.26%和83.37%,IL-6 分别为82.01%和80.33%。可见S100β 对早产儿脑白质损伤的敏感性较高,S100β 和IL-6对脑白质损伤均有一定的诊断价值,但两项单用的特异性并不高。在各项血清指标中,NSE 的AUC 值最大,S100β 次之,IL-6 最低,表明 NSE与脑白质损伤的关系最为密切。虽然三项血清指标对早产儿脑白质损伤均有较高的诊断价值,但是其无法反映病灶的具体位置与大小。因此,临床有必要将血清学指标与颅脑超声联合起来,以完善诊断信息[15]。本研究也显示,相比单项检测,NSE、S100β、IL-6 与颅脑超声四项联合检测的AUC 值更大,在早产儿出生24 h 对脑白质损伤的诊断灵敏度、特异度最高,分别达94.32%和93.54%。表明血清 NSE、S100β、IL-6 与颅脑超声联合用于早期诊断早产儿脑白质损伤可有效提高诊断效能,尽早发现脑白质损伤的轻微病理改变,可为临床采取相关干预措施提供参考依据。
综上所述,新生儿颅脑超声检查是临床诊断早产儿脑白质损伤的首选影像学手段,其与血清NSE、S100β、IL-6 联用能够有效提高早期诊断的灵敏度、特异度,降低漏误诊风险,对于改善患儿预后具有重大意义。
