橡胶树炭疽菌HCkHNQZ1736 -TUB2基因对多菌灵的抗性相关性分析
2021-09-14郑肖兰刘先宝李博勋郑行恺时涛冯艳丽黄贵修
郑肖兰 刘先宝 李博勋 郑行恺 时涛 冯艳丽 黄贵修


摘 要:天然橡胶是四大工业原料中唯一的可再生资源,由炭疽病菌侵染引起的橡胶树炭疽病是当前我国橡胶生产上最为严重的两大叶部病害之一。本研究以分离自云南保山的喀斯特炭疽病菌MeCkYN1705为对照,对海南新发炭疽病菌喀斯特炭疽菌HCkHNQZ1736进行抗药性评价。结果表明,菌株HCkHNQZ1736对苯并咪唑类杀菌剂多菌灵表现出高抗药性,EC50达1107.2654 ?g/mL,而MeCkYN1705的EC50仅为0.0554 ?g/mL。克隆了菌株HCkHNQZ1736的tub2基因,序列分析发现其所编码的第198个氨基酸位点由谷氨酸(Glu-E)突变为丙氨酸(Ala-A),推测该氨基酸位点突变是导致该菌株产生多菌灵抗性的原因。此外生物学特性测定发现,该菌株最适生长温度为28 ℃,致死温度为35 ℃;最适生长pH为6;光暗交替利于菌落生长;果胶、蛋白胨分别为最适碳源和氮源。
关键词:橡胶树炭疽病;喀斯特炭疽病菌;β-TUB2;抗药性
Abstract: Rubber tree (Hevea brasiliensis) is the only renewable resource among the four major industrial raw materials. Rubber tree anthracnose which infected by the Colletotrichum spp. is one of the most serious foliar disease of rubber production in China. In this paper, a new strain of C. karstii was identified and analyzed for carbendazim (2-benzo imidazole methyl carbamate) resistance. The carbendazim sensitivity test of HCkHNQZ1736 and MeCkYN1705, HCkHNQZ1736 showed high resistance to benzimidazole fungicides carbendazim, the EC50 was 1107.265 ?g/mL, while MeCkYN1705 had only 0.0554 ?g/mL. After the HCkHNQZ1736 tub2 gene was cloned, sequence analysis showed that the 198th amino acid locus was mutated from glutamic acid (Glu-E) to alanine (Ala-A). This paper speculated that the mutation of the amino acid locus was the cause of carbendazim resistance of the strain. Combining morphological observation and polygenic phylogenetic analysis found that the optimum temperature was 28 ℃, the lethal temperature was 35 ℃, and the optimum pH was 6. The study also found that the alternation of light and dark was beneficial to colony growth, and pectin and peptone were the optimum carbon and nitrogen sources.
Keywords: rubber tree anthracnose; Colletotrichum karstii; β-TUB2; resistance
天然橡胶、钢铁、煤炭、石油并称为世界四大工业原料,天然橡胶是其中唯一的可再生资源。1906年斯里兰卡的Peteh首次报道橡膠树炭疽病,我国该病最早于1962年在海南大丰农场开割林段爆发流行[1-2]。到目前为止,橡胶树炭疽病几乎遍布全球所有植胶地,其中非洲中部、南美洲、亚洲南部和东南部等植胶国家最为严重[2-3]。苯并咪唑类杀菌剂是一种内吸性杀菌剂,其开发已有近50 a的历史,以高效和广谱著称,是植物病害化学防治的里程碑,极具历史意义[4-5]。其中多菌灵是应用最普遍的一种。在化学防治仍是目前橡胶树炭疽病的主要应对方法的大环境下,长期施药除了污染环境以外,还极易使病原菌产生抗药性,这一现状为炭疽病防治加大了难度。
本研究就海南新发炭疽病菌喀斯特炭疽菌HCkHNQZ1736开展杀菌剂敏感性测定时发现该菌株对多菌灵表现出高抗药性,依据多篇文献报道,多种真菌对苯并咪唑类杀菌剂产生抗药性主要是β-微管蛋白与药剂结合位点氨基酸发生突变,导致真菌对药剂不敏感[6-16]。为探究本实验室所发现的橡胶树喀斯特炭疽菌是否也同样由于tub2基因的突变而引起多菌灵的抗药性,将已获得的抗药性菌株的β-微管蛋白tub2基因进行序列分析,在NCBI数据库中使用BLAST进行序列相似性比对分析,在http://linux1.softberry.com/berry. phtml?topic=fgenesh &group=programs&sub gr o u p = gfind中进行基因预测,获得氨基酸序列,比较抗性菌株和敏感性菌株的氨基酸序列,以探究HCkHNQZ1736菌株β-微管蛋白tub2基因的氨基酸是否发生突变。
1 材料与方法
1.1 材料
1.1.1 供试菌株 喀斯特炭疽(Colletotrichum karstii)菌株MeCkYN1705,分离自云南保山,由中国热带农业科学院环境与植物保护研究所分离、鉴定和保存;喀斯特炭疽菌株HCkHNQZ1736分离自海南琼中,为本研究中采集、分离和鉴定获得。
1.1.2 供试培养基 PDA培养基(马铃薯葡萄糖固体培养基):去皮洁净马铃薯200 g切小块在蒸馏水中煮沸30 min后用纱布过滤获取滤液,加入20 g葡萄糖,17 g琼脂粉,溶解后加蒸馏水定容至1 L,121 ℃灭菌20 min。
LB培养基:NaCl 10 g,酵母提取物5 g,蛋白胨10 g,琼脂粉17 g,加蒸馏水溶解后定容至1 L,121 ℃灭菌20 min。
1.1.3 供试药剂 98%多菌灵原药,由安林生物化工有限公司生产。
1.2 方法
1.2.1 药剂敏感性测定 (1)多菌灵药剂母液配置。称取0.5 g 98%多菌灵原药粉剂溶解于适量1 mol/L稀盐酸中,待粉末完全溶解后用无菌水定容至50 mL,过滤灭菌,获得10 000 ?g/mL的母液4 ℃保存。
(2)含药培养基配置。通过在降温至60 ℃左右的PDA培养基中按要求添加不同体积的多菌灵母液,分别制成不同浓度的含多菌灵PDA培养基。处理终浓度梯度如表1所示。
(3)敏感性评价方法[6]。将供试菌株接种于PDA平板上,28 ℃恒温培养箱内培养5 d后,用灭菌的接种针挑取直径5 mm的菌饼,移接于上述含药平板进行筛选,置于28 ℃恒温箱中培养5 d,实验设置3次重复,观察菌落生长情况,用十字交叉法测量并记录菌落生长直径,计算菌丝生长抑制率,进行回归分析,计算回归方程和EC50(抑制菌丝生长50%的有效浓度)。
1.2.2 抗药性菌株抗性遗传稳定性测定 将供试菌株接种于无药PDA平板上培养后,通过单孢分离进行继代培养5代后,将第1代和第5代菌株同时接种至多菌灵浓度为600 ?g/mL的PDA培养基上,置于28 ℃恒温箱中培养5 d,实验设置3次重复,观察菌落生长情况,用十字交叉法测量并记录菌落生长直径,若各代菌株生长情况和菌落直径差异不显著,则表明抗药性遗传稳定。
1.2.3 喀斯特炭疽菌tub2基因突变与抗药性关系分析 利用Primer 5.0软件在β-微管蛋白tub2基因起始编码区和终止编码区设计引物,扩增基因的完整编码区序列。
设计引物对:CKtub2F: 5-TCATCCAAAAT G C GT GAGATT-3;CKtub2R: 5-TACTC CTCCT CCTC CTCGTCA-3。
PCR擴增体系(总体积25 ?L):2.5 mmol/L dNTP Mixture 2 ?L;TakaRa LA Taq高保真酶0.5 ?L;2×GC buffer I 12.5 ?L;10 ?mol/L上游引物1 ?L;10 ?mol/L下游引物1 ?L;ddH2O 7 ?L;Template 1 ?L。
PCR反应程序:94 ℃ 5 min;94 ℃ 45 s,54 ℃ 45 s,72 ℃ 2 min,34个循环;72 ℃ 5 min,4 ℃保存。
扩增产物经1%琼脂糖凝胶电泳分离,片段用OMEGA回收试剂盒进行回收。将扩增回收产物连接至PMD18-T载体,连接体系:pMD18-T Vector 50 μg/μL 1 μL,Solution I 5 μL,目标片段0.1~0.3 pmol,ddH2O补至10 μL;16 ℃水浴中连接过夜。
采用热击转化将连接产物转化至Trans 5α大肠杆菌感受态细胞。进行蓝白斑筛选,挑选疑似阳性克隆子于LB液体培养基(含Amp浓度为50 μg/mL)中,37 ℃ 180 r/min摇菌培养12 h获得菌液。利用通用引物M13R和M13F进行菌液PCR检测。经过检测确认为阳性克隆子后,送华大基因有限公司测序。
1.2.4 基础生物学特性测定 (1)生长适宜温度的测定。将供试菌株接种于PDA平板上,分别置于10、15、20、25、28、30、32、35 ℃环境下黑暗培养5 d,实验设置3次重复,用十字交叉法测量并记录菌落生长直径,明确病原菌的生长适宜温度范围。
(2)不同光照下菌株生长速率的测定。将供试菌株接种于PDA平板上,分别置28 ℃于连续光照、连续黑暗和每12 h明暗交替的环境下培养5 d,实验设置3次重复,用十字交叉法测量并记录菌落生长直径,明确光照对菌株生长速度的影响。
(3)不同碳源对菌落生长的影响。以相同质量的木糖、阿拉伯糖、葡萄糖、果糖、半乳糖、麦芽糖、乳糖、碱性木素、果胶、纤维素、淀粉和多聚半乳糖醛酸替换察氏固体培养基中的蔗糖,配制成含有不同碳源的培养基。将供试菌株接种至不同碳源的察氏培养基中,以普通察氏培养基作为对照,置于28 ℃恒温箱中培养7 d,实验设置3次重复,用十字交叉法测量菌落直径以明确菌株对不同碳源的利用率。
(4)不同氮源对菌落生长的影响。以相同质量的硝酸铵、硝酸钾、磷酸二氢铵、硫酸铵、氯化铵、蛋白胨和天冬酰胺替换察氏固体培养基中的硝酸钠,配制成含有不同氮源的培养基。将供试菌株接种至不同氮源的察氏培养基中,以普通察氏培养基作为对照,置于28 ℃恒温箱中培养7 d,实验设置3次重复,用十字交叉法测量菌落直径以明确菌株对不同氮源的利用率。
(5)pH对菌落生长的影响。用1 mol/L的HCl和NaOH溶液调节培养基的pH,将供试菌株分别接种于pH为4、5、6、7、8、9、10、11的PDA培养基中,置于28 ℃恒温箱中培养5 d,实验设置3次重复,用十字交叉法测量并记录菌落生长直径,明确pH对菌株生长速度的影响。
1.3 数据处理
采用Excel 2007软件整理试验数据,并用SPSS 7.0软件进行差异显著性分析。
2 结果与分析
2.1 喀斯特炭疽菌药剂敏感性测试结果
在98%多菌灵原药浓度梯度下菌株HCkHN QZ 1736和MeCkYN1705的敏感性结果如图1、图2,计算其毒力回归方程、相关系数和EC50值(表2)。结果表明,在多菌灵的筛选压力下,HCkHNQZ1736明显产生强抗药性,EC50达到1107.2654 ?g/mL,而MeCkYN1705的EC50仅为0.0554 ?g/mL。
2.2 HCkHNQZ1736多菌灵抗药性遗传稳定性分析
如图3所示,接种自第1代的菌株在600 ?g/mL多菌灵PDA平板上的平均菌落直径为48.17 mm,接种自第5代的菌株在600 ?g/mL多菌灵PDA平板上的平均菌落直径为47.33 mm,二者菌落生长情况无显著差异,可判断其对多菌灵的抗药性具有遗传稳定性。
2.3 喀斯特炭疽菌tub2基因与抗药性关系分析
通过引物对CKtub2F/CKtub2R对喀斯特炭疽菌HCkHNQZ1736和MeCkYN1705菌株的tub2基因進行PCR扩增(图4),将扩增片段回收、克隆、测序获得β-微管蛋白基因片段长度为1789 bp,通过基因预测分析基因序列编码428个氨基酸(图5),通过与几种已报道的植物病原真菌β-微管蛋白氨基酸进行比较。发现氨基酸的同源性99%以上,由此可以确认克隆获得的基因为HCkHNQZ1736和MeCkYN1705菌株的β-微管蛋白基因。
通过对6个菌株(多菌灵抗药性研究的模式菌株Aspergillus nidulans、Neurospora crassa,具有多菌灵抗药性的已报道菌株Colletotrichum siamense_Yd-8、Colletotrichum fructicola_Gwha-1,具有多菌灵抗药性的供试菌株HCkHNQZ1736,不具有多菌灵抗药性的供试菌株MeCkYN1705)的β-微管蛋白氨基酸序列进行比对,结果表明(图6),具有多菌灵抗药性的供试菌株HCkHNQ Z 1736与具有多菌灵抗药性的已报道菌株C. siamense_Yd-8、C. fructicola_Gwha-1存在氨基酸突变的一致性,其198位点的谷氨酸(Glu-E)均突变成为丙氨酸(Ala-A),这一现象与多篇文献报道的真菌产生多菌灵抗药性的机理相同[9, 17-19]。因此可以初步推断其第198位氨基酸的突变导致喀斯特炭疽菌HCkHNQZ1736对多菌灵产生抗药性。
2.4 基础生物学特性
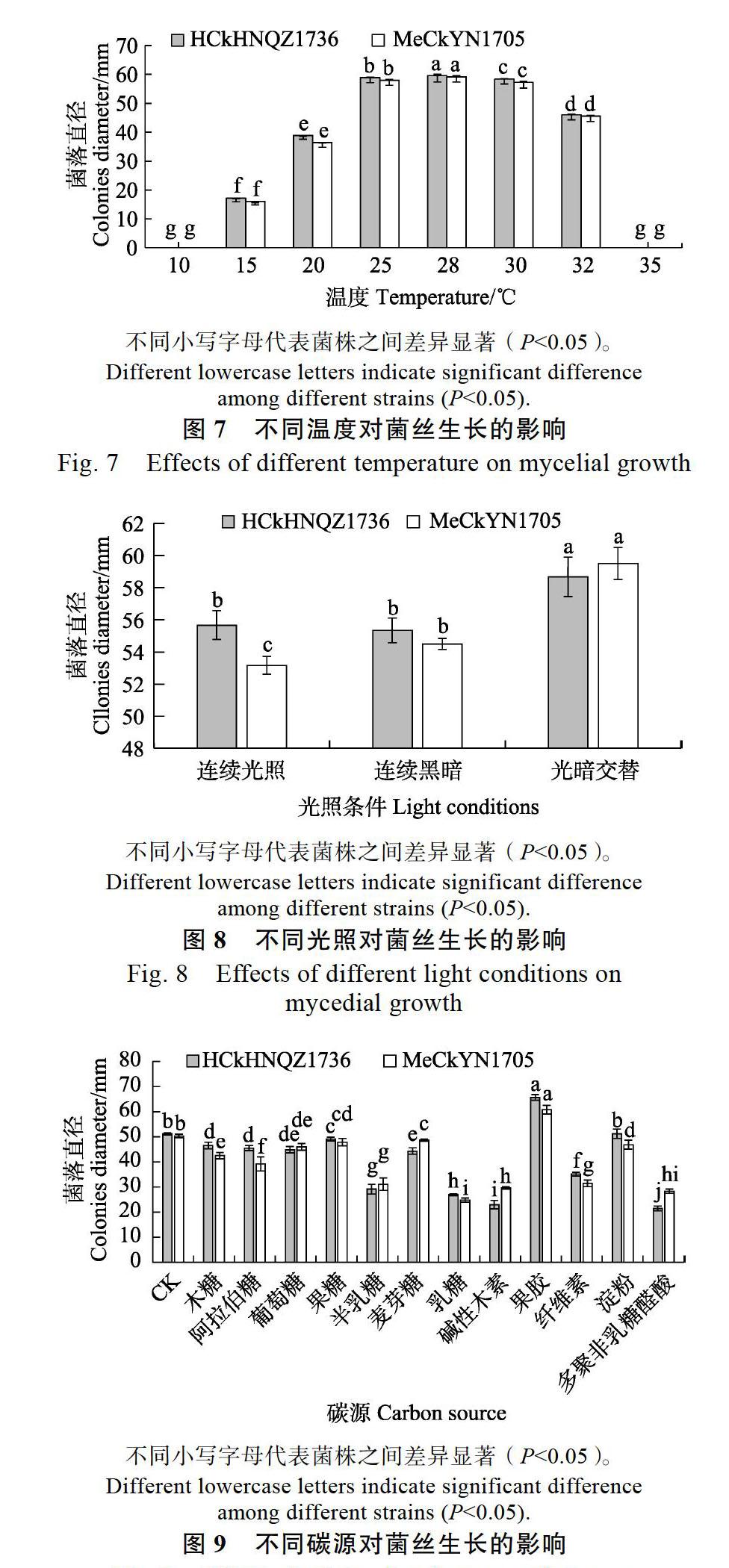
2.4.1 温度对菌落生长的影响 如图7所示,供试菌株HCkHNQZ1736和MeCkYN1705生长温度范围为15~32 ℃;28 ℃为最适生长温度范围,菌落生长速度最快,约为11.7 mm/d。
2.4.2 光照对菌落生长的影响 如图8所示,供试菌株HCkHNQZ1736和MeCkYN1705在3种光照条件下均能正常生长,连续光照条件下2种菌株生长速率分别为11.1 mm/d和10.6 mm/d;连续黑暗条件下2种菌株生长速率分别为11.1 mm/d和10.9 mm/d;光暗交替条件下2种菌株生长最快,生长速率分别为11.7 mm/d和11.9 mm/d。
2.4.3 不同碳源对菌株生长的影响 如图9所示,供试菌株HCkHNQZ1736和MeCkYN1705在13种不同碳源中均能生长,其中HCkHN QZ1736对果胶的利用率最好,平均生长速率达9.4 mm/d,对多聚半乳糖醛酸的利用率最差,平均生长速率仅为3.1 mm/d;MeCkYN1705对果胶的利用率最好,平均生长速率达8.7 mm/d,对乳糖的利用率最差,平均生长速率仅为3.5 mm/d。
2.4.4 不同氮源对菌株生长的影响 如图10所示,供试菌株HCkHNQZ1736和MeCkYN1705在8种不同氮源中均能生长,其中参试菌株对蛋白胨的利用率最好,平均生长速率分别为9.0 mm/d和8.5 mm/d;对硫酸铵的利用率最差,平均生长速率分别为3.19 mm/d和2.7 mm/d。
2.4.5 pH对菌落生长的影响 如图11所示,供试菌株HCkHNQZ1736和MeCkYN1705在pH 4~12范围内均能生长,但菌落生长直径有明显差异,pH 6~9最适宜菌株生长,pH在6时菌株生长最快,HCkHNQZ1736和MeCkYN1705的生长速率分别约为11.1 mm/d和11.5 mm/d,在pH达到11时基本停止生长。
3 讨论
对真菌抗药性研究多用Aspergillus nidulans和Neurospora crassa作为模式菌株,黄大野等[20]研究表明,与tub2基因编码的氨基酸比对后发现,第6、50、134、165、167、198、200、237、241、250、257位点的氨基酸突变均能不同程度地引起菌株产生抗药性。其中198位点的谷氨酸(Glu-E)有多种突变方式,如突变为丙氨酸(Ala-A)、赖氨酸(Lys-K)、缬氨酸(Val-V)、甘氨酸(Gly-G)或谷氨酰胺(Gln-Q)均能引起菌株产生抗药性,但是抗性程度不同,E198A或E198K所产生的抗药性比其他突变情况将更强,E198A是迄今为止最常见的突变方式[21]。
胶孢炭疽病菌和尖孢炭疽病菌作为当前橡胶树炭疽病的主要病原菌,其对苯并咪唑类杀菌剂的抗性机理前人已做过一定的解释和研究,发现尖孢炭疽的抗药性存在tub1基因上调的独特性,而胶孢炭疽的抗药性机理与其他种类的菌株基本一致,都是由tub2基因突变引起[22-23],但尚无相关文献报道橡胶树喀斯特炭疽菌对苯并咪唑类杀菌剂产生抗药性和进行抗性机理的分析总结,在本研究中发现的喀斯特炭疽菌株HCkHNQZ1736tub2基因氨基酸符合E198A的突变方式,且表现为高抗性,EC50达到1107.2654 ?g/mL。菌株HCkHNQZ1736产生抗药性的机理符合前人对其他种类菌株的相关研究结果[22-23],为橡胶树喀斯特炭疽的相关研究提供了理论基础。
以此对菌株HCkHNQZ1736开展包括适生温度、光照影响、碳氮源利用和pH影响等生物学特性的研究,结果显示抗药性菌株HCkHNQZ 1736与敏感性菌株MeCkYN1705的基础形态和生物学特性并不存在显著差异,可见抗药性突变并不影响这些生物学功能。
通过研究发现,菌株HCkHNQZ1736的抗性遗传具有很好的稳定性,在田间长期施药过程中,可能致使药剂敏感性菌株发生突变成为抗性菌株后能够稳定扩展,最终使得施药效果逐年下降,产生严重的浪费,此时有针对性地施藥或轮换其他类型的药剂就显得尤为重要。由于此前在海南省橡胶树炭疽病的研究中并未发现和报道喀斯特炭疽菌,其他病原菌种群也未发现和报道对苯并咪唑类杀菌剂有高抗药性的菌株,并且历年用于不同小写字母代表菌株之间差异显著(P<0.05)。
防治橡胶树炭疽病时多菌灵的施用也不算过于频繁,故而推测本研究发现的侵染橡胶树的喀斯特炭疽菌或为其他作物上传染,然后蔓延至橡胶树的。
参考文献
冯淑芬, 刘秀娟, 王绍春, 等. 橡胶树炭疽病流行规律研究[J]. 热带作物学报, 1998, 19(4): 39-45.
崔昌华. 橡胶老叶炭疽病病原菌的生物学、对药物的敏感性及ITS序列分析[D]. 儋州: 华南热带农业大学, 2006.
刘 艳. 橡胶炭疽病菌(Colletotrichum gloeosporioides)致病相关突变体表型分析及插入位点定位[D]. 海口: 海南大学, 2010.
李婉婉. 苯并咪唑酮衍生物抑菌作用机理初探[D]. 杨凌: 西北农林科技大学, 2015.
黄圣明, 杨 叶, 刘秀娟. 香蕉果实潜伏炭疽菌对苯并咪唑杀菌剂的抗药性研究[J]. 热带作物学报, 1996(2): 47-51.
曹学仁, 车海彦, 杨 毅, 等. 2014年海南省橡胶炭疽病菌对多菌灵和咪鲜胺的敏感性测定[J]. 植物病理学报, 2015(6): 626-631.
Koenraadt H. Characterization of mutations in the beta-tubulin gene of benomyl-resistant field strains of Venturia inaequalis and other plant pathogenic fungi[J]. Phytopathology, 1992, 82(11): 1348.
Gafur A, Tanaka C, Shimizu K, et al. Molecular analysis and characterization of the Cochliobolus heterostrophus. beta.-tubulin gene and its possible role in conferring resistance to benomyl[J]. Journal of General & Applied Microbiology, 2005, 44(3): 217-223.
杨 莹, 赵东磊, 段亚冰, 等. 核盘菌(Sclerotinia sclerotiorum)抗多菌灵β-微管蛋白基因在禾谷镰孢菌(Fusarium graminearum)中的表达研究[C]//中国植物病理学会2016年学术年会论文集, 南京: 中国农业科学技术出版社, 2016: 169.
马晓伟, 邢春杰, 于金凤, 等. 水稻恶苗病菌(Fusarium fujikuroi)β-微管蛋白基因克隆及与多菌灵抗药性关系[J]. 微生物学报, 2012, 52(5): 581-587.
徐建强, 周裕军, 张 聪, 等. 禾谷镰孢菌β2-微管蛋白在大肠杆菌中的可溶性表达及纯化[J]. 中国农业科学, 2012, 45(6): 1084-1092.
张 聪, 徐建强, 于俊杰, 等. 禾谷镰孢菌β-微管蛋白基因的克隆及在原核细胞中的表达[J]. 南京农业大学学报, 2011, 34(1): 51-56.
詹儒林, 郑服丛. 芒果炭疽病菌β-微管蛋白基因的克隆及其与多菌灵抗药性发生的关系[J]. 微生物学报, 2004(6): 827-829.
李红霞, 陆悦健, 王建新, 周明国. 禾谷镰孢菌β-微管蛋白基因克隆及其与多菌灵抗药性关系的分析[J]. 微生物学报, 2003(4): 424-429.
李红霞, 陆悦健, 周明国, 等. 油菜菌核病菌β-微管蛋白基因与多菌灵抗药性相关突变的研究[J]. 中国油料作物学报, 2003(2): 57-61.
李红霞, 陆悦健, 王建新, 等. 四种不同植物病原真菌与多菌灵抗药性相关基因突变的比较[J]. 南京农业大学学报, 2002(3): 41-44.
成禄艳. 芒果炭疽病菌对几种杀菌剂的抗药性研究[D]. 广州: 华南农业大学, 2016.
邓维萍, 梅馨月, 杨 敏, 等. 胶孢炭疽菌及两种疫霉菌对苯酰菌胺的敏感性与β-微管蛋白氨基酸突变的相关性分析[J]. 农药学学报, 2012, 14(2): 143-150.
于俊杰. 禾谷镰孢菌(Fusarium graminearum)对多菌灵抗药性分子机制的研究[D]. 南京: 南京农业大学, 2009.
黄大野, 李宝聚, 石延霞, 等. 三种多菌灵耐药性链格孢属真菌β-tubulin基因的序列特征[J]. 菌物学报, 2012, 31(5): 710-716.
Ma Z, Michailides T J. Advances in understanding molecular mechanisms of fungicide resistance and molecular detection of resistant genotypes in phytopathogenic fungi[J]. Crop Protection, 2005, 24(10): 853-863.
林 婷. 膠孢炭疽菌杀菌剂抗药性的机制、检测技术及治理研究[D]. 杭州: 浙江农林大学, 2015.
Nakaune R, Nakano M. Benomyl resistance of Colletotrichum acutatum is caused by enhanced expression of β-tubulin 1 gene regulated by putative leucine zipper protein CaBEN1[J]. Fungal Genetics & Biology, 2007, 44(12): 1324-1335.
责任编辑:谢龙莲
