马蓝IGPS基因的克隆、表达分析及原核表达
2021-09-14蔡国倩宁书菊叶齐胡永乐马小毛魏道智
蔡国倩 宁书菊 叶齐 胡永乐 马小毛 魏道智


摘 要:吲哚-3-甘油磷酸合酶(indole-3-glycerol phosphate synthase,IGPS)是广泛参与生物体内色氨酸、生长素等吲哚化合物合成途径中重要的关键酶之一。为了研究BcIGPS在马蓝吲哚类生物碱合成中的作用,基于馬蓝转录组数据,通过RT-PCR技术从马蓝中克隆得到IGPS基因序列,命名为BcIGPS;利用生物信息学分析BcIGPS序列特性;运用qPCR分析BcIGPS在马蓝不同器官及外源诱导处理下的时空表达情况;构建pET-32a-BcIGPS原核表达载体,并优化诱导表达条件。结果表明:BcIGPS(GenBank登录号:MT210517)全长为1176 bp,包含1个开放阅读框(ORF),编码392个氨基酸,具丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)磷酸化位点31个,无跨膜结构,无信号肽,亚细胞定位于叶绿体中。BcIGPS含有product(indole)活性结构域和IGPS、TrpC特异性位点。qPCR分析结果显示,BcIGPS基因在不同器官的相对表达丰度依次为:叶>茎>花>根;其响应茉莉酸甲酯(MeJA)、脱落酸(ABA)、水杨酸(SA)、乙烯利(ETH)外源诱导信号的诱导,经MeJA和ETH处理后,分别在24 h和36 h最高,为初始水平的5.53、6.87倍;在SA处理下,BcIGPS表达响应最为强烈,呈先骤升后骤降的变化趋势,在12 h最高达初始水平的33.13倍;ABA处理后,其表达量变化不显著。所构建的pET-32a-BcIGPS原核表达载体在大肠杆菌BL21中表达,其最适条件为37 ℃、0.4 mmol/L IPTG培养3 h,BcIGPS重组蛋白主要以包涵体形式存在,且蛋白分子量与预测相符。
关键词:马蓝;BcIGPS;基因克隆;表达分析;原核表达
Abstract: Indole-3-glycerol phosphate synthase (IGPS) is one of the most key enzymes involved in the synthesis of indole compounds such as tryptophine and auxin in organisms. In order to study the function of BcIGPS in the synthesis of the indole alkaloids from Baphicacanthus cusia, based on the transcriptome data of B. cusia, the gene sequence of IGPS was obtained by RT-PCR, the BcIGPS sequence characteristics was analyzed by bioinformatics. qPCR analysis was used to analyze the spatiotemporal expression of B. cusia in different organs and exogenous induction. The prokaryotic expression vector of pET-32a-BcIGPS was constructed and the conditions were optimized for inducing expression. Results showed that BcIGPS (GenBank login number: MT210517) contained an open reading frame (ORF) of 1176 bp, encoded 392 amino acids without transmembrane structure and signal peptide. There were 31 phosphorylation sites for Ser, Thr and Tyr. Subcellular localization prediction showed that BcIGPS was located on the chloroplasts. And BcIGPS contained product (indole) active structure domain and specific sites of IGPS and TrpC. The results of qPCR showed that the relative expression abundance of BcIGPS in different organs was leaf>stem>flower>root. It responsed to the induction of exogenous MeJA, SA, ETH. After the treatment of MeJA and ETH, the maximum value was up to 5.53, 6.87 times at 24 h and 36 h respectively. BcIGPS showed the strongest response to SA treatment, the expression level increased quickly and then decreased sharply, more 33.13 times than the initial level at 12 h. After ABA treatment, there was no significant change in the expression level. The prokaryote expression of pET-32a-BcIGPS was constructed successfully and the optimal conditions for expression in E. coli BL21 was 37 ℃, 0.4 mmol/L IPTG and cultured for 3 h. The recombinant BcIGPS protein mainly existed in the form of inclusion body, and the molecular weight of BcIGPS was consistent with the prediction.
Keywords: Baphicacanthus cusia; BcIGPS; gene cloning; expression analysis; prokaryotic expression
马蓝(Baphicacanthus cusia)属爵床科板蓝属多年生草本植物,主要分布在我国亚热带及热带等地区,是重要传统中药材青黛的原植物和染料资源[1]。马蓝全草具药用价值,其根及根茎为南板蓝根[2];由茎叶泡制加工成青黛,具有治疗口疮、喉痹、传染性皮肤病等功效[3]。研究表明,中药青黛的主要药效成分为吲哚类生物碱的靛玉红和靛蓝,靛玉红具有抑制恶性肿瘤等作用,在临床用于治疗慢性粒细胞性白血病;靛蓝是一种天然的抗菌植物色素,普遍应用于食品、印染、化妆品等行业[4-5];因此,靛玉红、靛蓝的合成途径受到诸多领域的广泛关注。
马蓝吲哚类生物碱代谢通常有莽草酸途径(shikimate pathway)[6]和色氨酸途径[7]。在莽草酸代谢途径中,以磷酸烯醇式丙酮酸(PEP)和赤藓糖-4-磷酸(E4P)为底物,经5-烯醇式莽草酸-3-磷酸合成酶(EPSPS)[8]合成5-烯醇式莽草酸-3-磷酸,由分支酸合成酶(CS)[9]催化转变成分支酸,经邻氨基苯甲酸合成酶(ASA/ASB)[10]生成邻氨基苯甲酸,由吲哚-3-甘油磷酸合酶(IGPS)催化生成吲哚-3-甘油酸后,经色氨酸合成酶(TSA)[11]作用下形成吲哚。而在色氨酸代谢途径中,色氨酸直接由色氨酸酶催化为吲哚。由细胞色素P450(CYP450)氧化酶将吲哚氧化为2-羟基吲哚和3-羟基吲哚,再氧化为吲哚酚,吲哚酚进一步加氧、聚合成靛蓝、靛玉红及其他吲哚类物质。因此,研究其代谢途径中的关键基因对于马蓝药效成分积累机制的研究具有重要意义。
吲哚-3-甘油磷酸合酶(IGPS, EC:4.1.1.48)是合成生物体内必需氨基酸色氨酸和植物内源激素吲哚-3-乙酸(IAA)2条途径分支点的重要酶,且可催化生物碱、植物抗毒素和硫代葡萄糖苷等吲哚环状化合物的合成[12]。在菘蓝和微生物工程的靛蓝代谢途径中,IGPS也被认为是调控吲哚类生物碱(靛蓝)合成中的关键酶之一。目前尚未发现有关IGPS作为马蓝关键药效物质合成途径中限速酶的研究报道。因此,本研究拟利用马蓝转录组数据,克隆得到BcIGPS基因序列,对其序列进行生物信息学分析,并分析BcIGPS在马蓝不同组织器官的表达模式及其在不同外源诱导处理下的表达特异性,构建pET-32a-BcIGPS原核表达载体并诱导表达BcIGPS的重組蛋白,以期为后续该基因研究及分子调控机制奠定基础。
1 材料与方法
1.1 材料
马蓝取自福建省农业生态过程与安全监控重点实验室药用植物园,在马蓝旺盛生长期分别取根、茎、叶、当天开放的花,经无菌水洗净后液氮冷冻,于–80 ℃冰箱保存待用。
1.2 方法
1.2.1 激素处理 配置浓度为100 ?mol/L的茉莉酸甲酯(MeJA)、脱落酸(ABA)、水杨酸(SA)、乙烯利(ETH)溶液处理,每种处理3个重复。在处理0、1、2、4、6、8、12、18、24、36、48、72 h后取材,置液氮速冻后,于–80 ℃冰箱保存待用。
1.2.2 RNA提取及cDNA合成 根据RNA提取试剂盒说明书,分别提取不同器官及外源诱导处理后马蓝的总RNA,通过分别检测RNA质量,将质量高的总RNA按照反转录试剂盒说明书反转录成cDNA,于–20 ℃保存待用。
1.2.3 BcIGPS基因的克隆 通过Primer Premier 5.0软件设计BcIGPS基因的引物并分别添加XbaⅠ、SalⅠ酶切位点及相应的保护碱基,BcIGPS的正向引物序列为:5-CTAGTCTAGATCCAT CCTCCATCACTCTG-3和BcIGPS的反向引物序列为:5-ACGCGTCGACAGGAGTATCCAAGTT GTGCTG-3。以马蓝cDNA为模板进行扩增,扩增条件:2×Taq PCR Master Mix 10 μL,上下游引物各1 μL,cDNA模板1 μL,ddH2O 7 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃延伸10 min。扩增产物用1%的琼脂糖凝胶电泳检测。将目的条带回收,连接至Blunt Simple T载体上,转化E. coli DH5α中,涂板,挑取单克隆进行菌液PCR验证,并将阳性菌液送福州铂尚生物有限公司测序。
1.2.4 BcIGPS基因的生物信息分析 利用ORF finder软件查找开放阅读框,采用在线分析软件ExPASy-ProtParam tool分析氨基酸理化性质。利用DNAMAN 8.0软件和NCBI在线Blastp进行同源蛋白序列及进化发育树分析和构建。利用ExPASy-ProtScale、NetNGlyc 3.0 Server软件预测亲/疏水性和磷酸化位点,利用SOPMA、SWISS- MODEL软件分别预测二、三级结构。利用Blast与SMART在线数据库预测结构域,利用SignalIP4.1Server软件预测信号肽,利用TMHMM软件分析跨膜结构域,利用ProtCompv. 9.0软件预测亚细胞定位。
1.2.5 qPCR分析 设计BcIGPS基因的特异引物,正向序列:F-5-ACTTGTTGAGGTACATGAT GAGAC-3;反向序列:R-5-GCAATATCGGCA GGAGTGAA-3。选择β-actin为内参基因,其引物正向序列:F-5-GAGGGCCAAAACAAACTT GA-3;反向序列:R-5-CCCTTATGTGCCTTTGC CTA-3。使用Light Cycler 96实时荧光定量PCR仪进行扩增,每个样品3个重复,根据2-△△CT公式处理数据。
1.2.6 pET-32a-BcIGPS原核表达载体的构建 将测序正确的T-BcIGPS重组质粒和pET-32a载体质粒分别用限制内切酶XbaⅠ、SalⅠ进行双酶切,经电泳检测后,回收酶切目的片段,连接目的基因片段和载体片段,16 ℃金属浴中连接过夜,将连接产物转化至E. coli BL21(DE3)感受态细胞后,涂在含氨苄抗性的LB板进行初步筛选,挑单菌落,培养后提取质粒,经双酶切和菌液PCR鉴定为阳性菌液,送福州铂尚生物有限公司测序。
1.2.7 BcIGPS重组蛋白的诱导表达 将验证正确的阳性菌(pET-32a-BcIGPS)进行振荡培养,按1:100比例将菌液转入含50 ng/μL氨苄抗性的LB液体培养基中,扩大培养至OD600为0.6~0.8;加入浓度分别为0.3、0.4、0.5 mmol/L的IPTG进行诱导表达,诱导条件为37 ℃,200 r/min摇床,振荡培养2、3、4、5、6 h;诱导完成后,在4 ℃,12 000 r/min下离心10 min,倒培养液留菌体,加1 mL磷酸缓冲盐溶液(1×PBS)悬浮菌体,进行超声细胞破碎,设置破碎时工作5 s,间歇10 s,循环30次,破碎后的溶液为总蛋白,经4 ℃,12 000 r/min離心15 min后,总蛋白即分为上清蛋白和沉淀蛋白。将需上样的蛋白经过预处理后,用SDS-PAGE电泳检测重组蛋白的表达。
2 结果与分析
2.1 BcIGPS基因克隆及序列比对
根据RNA提取试剂盒说明书提取马蓝总RNA,通过凝胶电泳检测显示18S、28S两条带。以马蓝cDNA为模板克隆得到BcIGPS基因,测序结果显示,该基因包含一个全长为1176 bp的开放阅读框(ORF)(图1)。通过NCBI在线Blastp对BcIGPS蛋白进行同原序列搜索,选取10种不同物种的IGPS氨基酸序列(图2),结果表明,BcIGPS基因编码的氨基酸序列与蓖麻(Ricinus communis, XP_002532209.1)、毛白杨(Populus tomentosa, AXY97877.1)、南瓜(Cucurbita moschata, XP_022952396.1)、山黄麻(Parasponia andersonii, PON44253.1)、笋瓜(Cucurbita maxima, XP_022969112.1)、甜椒(Capsicum annuum, XP_016563733.1)、夏威夷棉(Gossypium tomentosum, TYH63509.1)、烟草(Nicotiana tabacum, NP_001312356.1)、野生大豆(Glycine soja, KHN38572.1)相似性分别为79.60%、78.98%、83.54%、79.37%、82.42%、81.27%、80.35%、81.74%、81.48%,BcIGPS蛋白与南瓜的IGPS氨基酸序列有着较高的相似性。利用DNAMAN 8.0软件对不同物种的IGPS氨基酸序列进行同源比对分析,结果表明,马蓝的IGPS独自聚成一支,甜椒和烟草聚成一支,其他7种物种聚成一支(图3)。
2.2 BcIGPS理化性质和磷酸化位点预测
采用在线分析软件ExPASy-ProtParam tool预测BcIGPS蛋白理化性质,结果显示,BcIGPS蛋白分子式为C1932H3126N540O565S14,分子量约为43.41 kDa,等电点(pI)为8.42,其中Leu(L)和Ala(A)比例较高分别为10.2%、8.9%。应用软件ExPASy-ProtScale预测分析,正值为疏水值,反之负值为亲水值。在–1.00以下的亲水峰有27处,+1.00以上的疏水峰有19处,表明BcIGPS蛋白是一个亲水性蛋白(图4)。采用NetNGlyc 3.0 Server在线软件对BcIGPS蛋白磷酸化位点进行分析,结果表明,分值在0.5以上的磷酸化位点有31个,其中丝氨酸(Ser)20个,苏氨酸(Thr)10个,酪氨酸(Tyr)1个(图5)。
2.3 BcIGPS蛋白的信号肽、跨膜结构域及亚细胞定位
通过SignalIP 4.1软件预测信号肽,发现BcIGPS蛋白的1~45个氨基酸的平均切割点为0.450,预测分析BcIGPS蛋白的N端不具有信号肽。运用TMHMM 2.0软件预测马蓝IGPS蛋白具有跨膜结构域的可能性很小,表明BcIGPS基因编码的产物不属于跨膜蛋白。采用ProtCompv 9.0在线预测软件对蛋白质做整体定位评分,叶绿体(7.98)远高于线粒体(0.81)、液泡(0.7)、高尔基(0.51)亚细胞器。表明BcIGPS蛋白亚细胞定位于叶绿体与马蓝的光合作用有关。
2.4 BcIGPS蛋白二、三级结构及保守结构域
采用在线软件SOPMA对BcIGPS蛋白二级结构预测表明,BcIGPS蛋白的主要元件由45.15%的α-螺旋、33.93%的无规则卷曲、14.03%的β-折叠、6.89%的β-转角构成二级结构(图6)。运用在线工具SWISS-MODEL模拟出BcIGPS蛋白三级结构(管状和球棒)模型(图7)。通过Blast与SMART数据库预测,BcIGPS蛋白含有关键活性结构域phosphate、ribulose/triose、substrate(anthranilate)、product(indole),特异性位点有PLN02460、IGPS、TrpC,并且属于DRE-TIM-me tallolyase和TIM-phosphate-binding超家族(图8)。
2.5 BcIGPS在不同器官的特异性表达及在不同外源诱导子下的响应情况
通过qPCR检测BcIGPS基因在马蓝不同器官中的相对表达量,结果显示,叶中最高,其次是茎和花,且分别为根的34.78、20.58和10.41倍,根中最低(图9)。表明BcIGPS基因在马蓝叶、茎及花的生长发育中表达较活跃,这与该基因的亚细胞结构定位预测结果相一致。
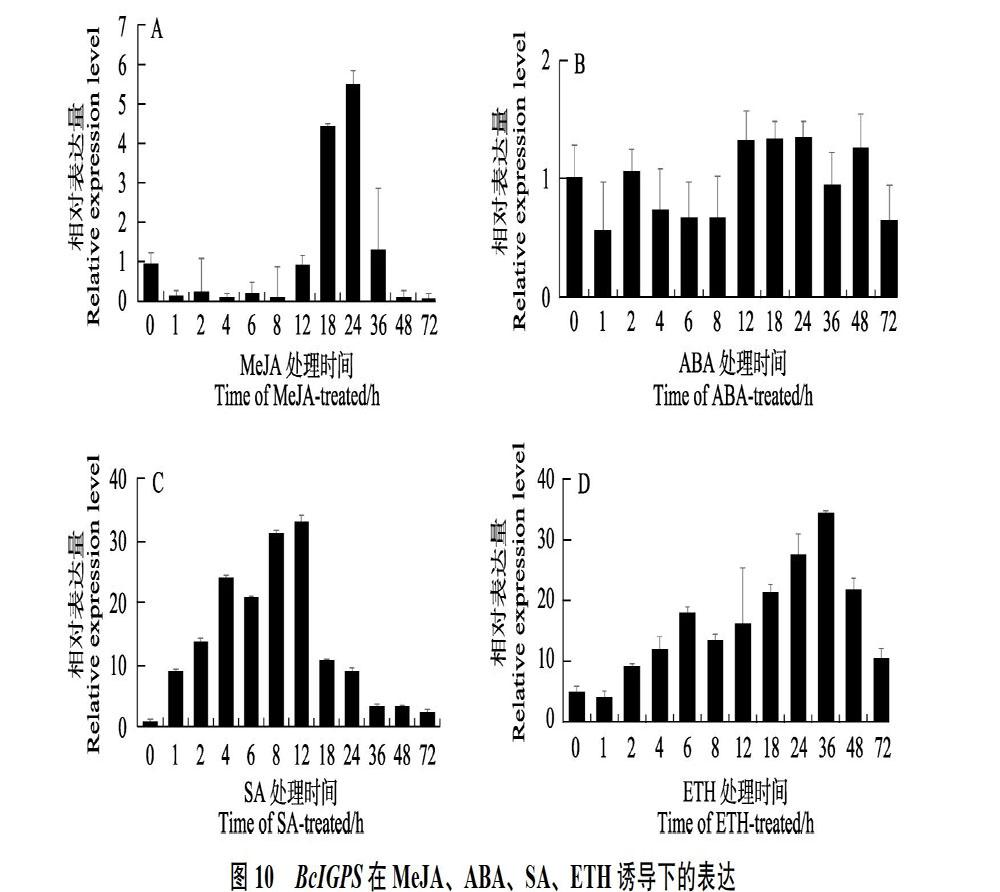
经不同外源诱导子处理后,结果发现,在ABA诱导下,BcIGPS基因表达变化不显著;经MeJA处理后,BcIGPS表达量的整体变化呈先降后升再降的趋势,且在24 h达到最高,是对照组的5.53倍;经ETH诱导36 h后,BcIGPS表达量达到最高,是对照组的6.87倍。SA处理1 h后,BcIGPS表达量快速且持续上升表达,在12 h达到最高,是初始水平的33.13倍(图10)。表明SA、MeJA及ETH可有效调控BcIGPS基因的表达,相比其他诱导子,BcIGPS基因对SA的应答快速且表达显著增强。
2.6 pET-32a-BcIGPS原核表达载体的构建
原核表达载体pET-32a和T-BcIGPS的质粒经内切酶XbaⅠ和SalⅠ分别进行双酶切,通过T4 DNA连接酶,原核表达载体pET-32a-BcIGPS经初步构建后,转化至E. coli BL21(DE3),挑單菌落经培养后,提取质粒进行双酶切鉴定和菌液PCR(图11)。电泳结果显示,pET-32a-BcIGPS原核表达载体经双酶切后,有2条带分别为5200 bp左右的pET-32a和1200 bp左右的BcIGPS。将酶切鉴定的阳性菌液送公司测序,测序结果显示完全一致,说明原核表达载体pET-32a-BcIGPS构建成功。
2.7 BcIGPS重组蛋白的诱导表达
将测序正确的pET-32a-BcIGPS质粒转化至E. coli BL21(DE3),然后进行诱导表达,其条件为:分别加入为0.3~0.5 mmol/L浓度的IPTG,在37 ℃、200 r/min的摇床上振荡培养2~6 h;提取BcIGPS重组蛋白进行SDS-PAGE分析(图12)。由图12可知,在0.4 mmol/L IPTG,经3 h诱导后,含pET-32a-BcIGPS质粒的表达菌株显示目的蛋白条带在约45 kDa处。重组蛋白是由43.41 kDa的BcIGPS和一个分子量约为0.84 kDa的His标签蛋白组成,符合预期BcIGPS蛋白的分子量大小。BcIGPS重组蛋白在沉淀的条带明显亮于上清的条带,表明重组蛋白主要以包涵体的形式存在。
3 讨论
吲哚类生物碱作为一类重要的生物活性成分,其合成途径一直是分子生药学领域研究的热点。林文津[13]、黄玉香[14]参考KEGG代谢途径及菘蓝、长春花、蓼蓝等的吲哚生物碱合成途径,测序并解析了马蓝苯丙氨酸、酪氨酸和色氨酸生物合成途径,结果发现IGPS基因表达处于上调,并推测其参与调控马蓝药效物质青黛的合成。已有研究结果表明,IGPS基因主要有2个功能:一是参与合成植保素途径及植物防御反应,在环境胁迫因子的作用下,IGPS基因蛋白水平表达增加[15];二是调控色氨酸代谢途径,有研究通过产生IGPS缺陷型转基因植物,表现出一些类似生长素缺陷的表型(小莲座和低生育力),同时色氨酸含量显著下降[16]。因此,BcIGPS基因和植物的防御性代谢有密切关系,研究BcIGPS基因不仅对于了解马蓝生长发育过程中的防御机制具有重要作用,而且对马蓝药效成分的合成途径研究具有一定的意义。
实验结果表明,BcIGPS蛋白存在保守结构域,蛋白中含有product(indole)关键活性结构域、TrpC和IGPS特异性结合位点,符合该基因参与合成吲哚环状物质的功能结构特点;此外,有研究发现一些真菌和细菌的L-色氨酸合成途径由7个色氨酸基因编码的5个关键酶完成,其中吲哚-3-甘油磷酸合酶由TrpC基因编码[17-18];经序列分析结果表明,马蓝与蓖麻、南瓜、山黄麻、笋瓜、甜椒、夏威夷棉、烟草、野生大豆等其他双子叶植物的IGPS基因相似度达79%~ 83%,以上实验结果均验证了马蓝IGPS基因的成功克隆。
通过qPCR对马蓝进行组织特异性表达分析,BcIGPS在马蓝的根、茎、叶及花的表达量有明显差异,叶、茎中BcIGPS蛋白的相对表达量比根分别高达34.78、20.58倍,青黛实际生产也是以叶、茎为加工原料器官,说明BcIGPS的存在与马蓝药效物质形成部位的一致。此外,叶和茎也是叶绿体主要分布的器官,这与BcIGPS蛋白定位于叶绿体的预测结果相一致。
外源诱导子与植物的次生代谢关系密切,常用来调节次生代谢产物的合成[19],如白及的苯丙烷[20]、藏红花的藏红花素[21]。在本研究中,发现马蓝BcIGPS基因均响应MeJA、ETH及SA诱导表达且上调,尤其经SA处理后,BcIGPS基因快速响应且强度是MeJA和ETH诱导反应的5~6倍。SA作为生长调节物质,不仅参与植物生长、调节光周期、调控乙烯合成等重要的代谢过程[22],而且可激活双子叶植物的抗旱、抗盐的防御反应,起到信号分子的作用[23-24]。因此,这也表明靛蓝、靛玉红的合成代谢包括在马蓝的次生代谢途径中,其合成与马蓝的防御代谢有关。
4 结论
本研究克隆获得的BcIGPS(GenBank登录号:MT210517)包含一个全长为1176 bp的ORF,编码392个氨基酸,定位于叶绿体中,成功构建pET-32a-BcIGPS原核表达载体并实现了高效表达。BcIGPS基因可强烈响应外源诱导子SA的诱导,该基因在马蓝生长发育中起到增强相关抗胁迫代谢的能力。该研究结果为进一步对马蓝吲哚类生物碱代谢调控研究提供科学依据。
参考文献
杨成梓, 刘小芬, 范世明. 药用植物马蓝的资源调查研究[J]. 中国现代中药, 2012, 14(3): 33-35, 38.
肖春霞. 黔产南板蓝根中抗流感病毒化学成分的研究[D]. 贵阳: 贵州大学, 2018.
杨步青, 陈建斌, 李新雄. 建青黛及其原植物马蓝的研究进展[J]. 海峡药学, 2008, 20(12): 72-76.
周江波, 邓小红. 天然靛蓝植物生化及分子生物学研究进展[J]. 北方园艺, 2018(1): 160-166.
张海超, 张轩萌. 中国古代蓝染植物考辨及相关问题研究[J]. 自然科学史研究, 2015, 34(3): 330-341.
陈 园, 赵淑娟. 微生物莽草酸代谢途径的研究进展[J]. 江苏农业科学, 2019, 47(7): 19-23.
王 莉, 史玲玲, 张艳霞, 等. 植物次生代谢物途径及其研究进展[J]. 武汉植物学研究, 2007, 25(5): 500-508.
Macheroux P, Schmid J, Amrhein N, et al. A unique reaction in a common pathway: mechanism and function of chorismate synthase in the shikimate pathway[J]. Planta, 1999, 207(3): 325.
于 剑, 叶 齐, 宁书菊, 等. 马蓝等79种植物分支酸合成酶的生物信息学分析[J]. 中国中药杂志, 2018, 43(4): 721-730.
张青磊. 马蓝吲哚类生物碱合成关键基因ASA和ASB的克隆与功能研究[D]. 厦门: 华侨大学, 2017.
公培民, 宁书菊, 叶 齐, 等. 马蓝色氨酸合成酶基因的克隆、序列及表达分析[J]. 分子植物育种, 2020, 18(3): 873-881.
Shah J. The salicylic acid loop in plant defense[J]. Current Opinion in Plant Biology, 2003, 6(4): 365-371.
林文津. 福建马蓝有效成分累积及其分子基础研究[D]. 福州: 福建农林大学, 2015.
黄玉香. 马蓝药效物质形成关键基因的挖掘与功能研究[D]. 厦门: 华侨大学, 2017.
刘新仿, 欧阳剑, 何奕昆, 等. 拟南芥吲哚-3-甘油磷酸合酶免疫分析[J]. 植物学报, 1999, 41(7): 3-5.
Müller A, Weiler E W. Indolic constituents and indole-3- acetic acid biosynthesis in the wild-type and a tryptophan auxotroph mutant of Arabidopsis thaliana[J]. Planta, 2000, 211(6): 855-863.
Gerth M L, Nigon L V, Patrick W M. Characterization of the indole-3-glycerol phosphate synthase from Pseudomonas aeruginosa PAO1[J]. The Protein Journal, 2012, 31(5): 359-365.
Arif M, Rashid N, Perveen S, et al. Extremely stable indole-3-glycerol-phosphate synthase from hyperthermophilic archaeon Pyrococcus furiosus[J]. Extremophiles, 2019, 23(1): 69-77.
張 睿, 王秀娟, 高 伟. 植物激素对次生代谢产物的调控研究[J]. 中国中药杂志, 2020, 45(17): 4205-4210.
罗才林, 李 林, 陈 立, 等. 白及苯丙氨酸解氨酶基因的克隆、序列特征及激素响应表达分析[J]. 中草药, 2019, 50(3): 694-701.
赖成霞, 玛依拉·玉素音,等. 藏红花酸糖基转移酶UGTCs4基因的克隆、生物信息学及表达分析[J]. 中草药, 2020, 51(4): 1044-1051.
Endo J, Takahashi W, Ikegami T, et al. Induction of flowering by inducers of systemic acquired resistance in the lemna plant[J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(1): 183-185.
Shah J. The salicylic acid loop in plant defense[J]. Current Opinion in Plant Biology, 2003, 6(4): 365-371.
向小亮, 宁书菊, 黄延龄, 等. 外源水杨酸对马蓝叶片中蛋白水平表达的影响[J]. 应用生态学报, 2010, 21(3): 689-693.
责任编辑:黄东杰
