超声波处理对采后甜柿品质及相关酶活性的影响
2021-09-14刘梦培孙文文韩卫娟傅建敏索玉静
刘梦培,孙文文,韩卫娟,傅建敏,索玉静,*,纵 伟,*
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450002;2.国家林业和草原局泡桐研究开发中心,河南郑州 450003)
柿(Diospyros kakiThunb.)为柿科(Ebenaceae)柿属(Diospyros),是我国主要经济林树种之一,具有重要的经济、生态和社会价值[1]。据2018 年联合国粮农组织统计,我国柿栽培面积约98.15 万 hm2,年产量达421.64 万 t,均居世界之首,分别占世界的91.32%和73.32%[2−4]。“阳丰”甜柿作为种植面积最广泛的甜柿品种之一,主要分布在山西、陕西、河北、湖北等地。其果实香甜多汁,含有丰富的糖、维生素、矿物质、胡萝卜素等营养物质,不仅可以清热润肺和健脾涩肠,还能起到治疗咳嗽和止血的作用,深受消费者喜爱[5−6],但在贮藏期间因受到内源乙烯的影响,果实容易软化、褐变,耐贮性差[7]。因此,适当的贮藏保鲜技术对于延长采后柿果实的贮藏期极其重要。目前已有的保鲜技术有物理保鲜(气调贮藏保鲜)[8]、化学保鲜(亚硫酸氢钠保鲜)[9]和生物保鲜(基因工程保鲜)[10],但这些保鲜技术因成本过高、存在化学试剂的残留和操作麻烦等缺点而未得到大量的推广应用[11]。
与传统保鲜方法相比,超声波保鲜技术具有条件温和、安全、清洁和无副作用等特点[12]。其作用机理主要依赖于空化效应,空化效应使液体介质中产生大量微小气泡,气泡在运动过程中产生强烈的局部高温和高压,可有效杀灭果蔬表面微生物、降解农药残留、抑制酶活、调控质构和颜色等采后品质[13−14]。陈广艳[15]对沂州木瓜进行了超声波处理保鲜效果的研究,研究发现经超声处理后的果实可较好的保持维 C和可滴定酸含量,且果实硬度保持时间长,可溶性固形物转换得到较好抑制,与对照组相比,果实质量损失率及腐烂率均明显降低。Aday 等[16]以草莓为试材,研究表明经过超声波处理的草莓与未处理的草莓相比其硬度差异显著。Wang 等[17]研究了超声技术对采后圣女果腐败微生物、品质和抗氧化能力的影响,发现超声波能有效地减少腐败微生物,通过抑制乙烯产生和呼吸速率来延缓采后成熟,从而保持圣女果的果实硬度、风味、酶活性、抗氧化剂(总酚、总黄酮)和总抗氧化能力。针对超声波技术在柿果实贮藏保鲜中的应用鲜有报道。
本实验以“阳丰”甜柿为试材,研究超声波处理后的柿果实在温度(20±2)℃、相对湿度 85%~90%条件下贮藏0、5、10、15、20 d 时,果实硬度、色差、含水量、可溶性固形物(SSC)、可滴定酸(TA),果胶组成、总钙离子含量和相关酶活性的变化规律,以期为超声波技术在采后柿果实保鲜方面的应用提供参考。
1 材料与方法
1.1 材料与仪器
甜柿 于2019 年10 月24 日采自中国林业科学研究院经济林研究开发中心原阳试验基地,品种为“阳丰”,果实呈扁圆形,果面橙红色,果肉为橙红色,采收时要求果形端正、着色均匀、大小相对一致、无病虫害和机械损伤的果实,采收当天运至实验室进行处理;贮藏盒 175 mm×135 mm×75 mm,北京懋林福祥工贸有限公司;EDTA、氢氧化钠、无水乙酸钠、氯化钠、酒石酸钾钠 均为分析纯,天津大茂化学试剂公司;无水甲醇、无水乙醇、丙酮 均为分析纯,天津市富宇精细化工公司;3.5-二硝基水杨酸、咔唑均为分析纯,天津市光复精细化工研究所;三氯甲烷、浓硝酸 均为分析纯,洛阳昊华化学试剂有限公司;浓硫酸 优级纯,洛阳昊华化学试剂有限公司;亚硫酸钠 分析纯,天津市科密欧公司;结晶酚 分析纯,罗恩试剂;CDTA、D-葡萄糖 分析纯,阿拉丁;PVPP、溴麝香草酚蓝 均为分析纯,生工生物工程(上海)股份有限公司;D-半乳糖醛酸、多聚半乳糖醛酸 均为分析纯,源叶生物。
JY92-2D 型超声波仪 宁波新芝生物科技有限公司;HC-3618R 高速冷冻离心机 安徽中科中佳科学仪器有限公司;TU1810 紫外可见分光光度计 北京普析通用仪器有限责任公司;JP-400B 高速多功能粉碎机 浙江永康市久品工贸有限公司;GY-4 数字型硬度计 浙江乐清市艾德堡仪器有限公司;PAL-1 型便携式手持折光仪 日本 Atago 公司;SC-80C 型色差计 北京康光光学仪器有限公司;MB23水分分析仪 奥豪斯仪器(常州)有限公司;FE28 型pH 计 瑞士梅特勒-托利多仪器有限公司;BC / BD-429H 型低温冰柜 山东青岛海尔股份有限公司;MARS6 微波消解仪 美国 CEM 公司;AA240FS 原子吸收仪 美国Varian 公司。
1.2 实验方法
1.2.1 果实处理 将柿果实随机分成2 组,清水组和超声组,每组处理果实约24 kg。清水处理条件为浸泡 30 min,(25±2)℃;超声波处理条件为420 W,30 min,(25±2)℃[18],处理完的柿果实晾干后,放入贮藏盒中,每盒装 4 个果实,在温度( 20±2)℃、湿度85%~90% 下贮藏,于 0、5、10、15、20 d 时取样测定,每组每次取10 个果实进行指标的测定。
1.2.2 感官指标的测定
1.2.2.1 果皮颜色的测定 用 SC-80C 全自动色差仪反射模式进行果皮颜色的测量,随附的标准白板用于校准测量柿果实的表面色差。在柿果实的赤道面附近相对应的位置各取一个点进行测定,取平均值。读取L*值(亮度)、a*值(红色/绿色)和b*值(黄色/蓝色)的值,总色差(ΔE)[18]表示色度差的大小:ΔE=[(L*−L0*)2+(a*−a0*)2+(b*−b0*)2]1/2(其中L0*、a0*和b0*是第 0 d 对照样品的值)。
1.2.2.2 腐烂率测定 腐烂率(%)= 腐烂果实个数/果实总个数×100
1.2.2.3 萼片观察 观察萼片的果萼片伸展方向、卷曲姿态和重叠度。
1.2.3 硬度的测定 用 GY-4 果实硬度计在柿果实赤道面位置取三个点进行测量,探头直径 11.1 mm,将探针垂直指向平面,均匀施加压力至刻度线,读取数值。
1.2.4 SSC 含量 的测定 用PAL-1 数显折光糖度仪测定可溶性固形物含量。
1.2.5 TA 含量的测定 用酸碱滴定法测定可滴定酸的含量[19]。
1.2.6 含水量的测定 用 MB23 水分分析仪测定果实含水量[20]。
1.2.7 细胞壁果胶组分含量的测定 细胞壁果胶多糖组分的提取和分离参考齐秀东等[21]的方法。准确称取 5 g 液氮冷藏保存的果肉,研磨,加 12 mL 80%乙醇,80 ℃水浴20 min,冷却后离心,弃上清,用12 mL甲醇和氯仿(1:1)混合液去除蛋白质等有机杂质,离心弃上清,再用 12 mL 80%乙醇和丙酮各洗 2 遍,45 ℃下干燥至恒重,得细胞壁物质。
称取烘干的细胞壁物质 100 mg,8 mL ddH2O 30 ℃ 恒温浸提 2 h 后离心得水溶性果胶(WSP),8 mL 50 mmol·L−1CDTA(pH6.5,含 50 mmol·L−1乙酸钠)浸提 6 h 后离心得离子结合果胶(ISP),8 mL 50 mmol·L−1Na2CO3(含2 mmol·L−1CDTA)4 ℃ 静置 12 h 后离心得共价结合果胶(CSP)。以半乳糖醛酸为标准,用咔唑比色法测定各果胶组分。
1.2.8 果胶降解酶活性的测定 多聚半乳糖醛酸酶(PG)的提取和测定参考 Ren 等[22]的方法并加以改进。称取 5 g 柿果实样品,研磨,加 20 mL 预冷 95%乙醇,冰浴条件下研磨匀浆后,低温放置 10 min,后离心。倾去上清液,向沉淀物中再加入 10 mL 预冷80% 乙醇,振荡,低温静置 10 min 后离心。再倾去上清液,向沉淀物中再加入 5 mL 预冷提取缓冲液,于 4 ℃ 放置 20 min,离心后收集上清液即为酶提取液。用比色法测定其含量。PG 活性以每分钟每克果肉在 37 ℃催化半乳糖醛酸水解生成半乳糖醛酸的质量表示,单位μg/(min·g)。
果胶裂解酶(PL)的提取和测定参考Zhi 等[23]的方法并加以改进。称取1 g 柿果实样品,加 5 mL 50 mmol Ttris-HCl 缓冲液(pH 8.5),在4 ℃、10000×g 离心15 min,收集上清液为酶提取液。然后将 1.5 mL 上清液加入到3.5 mL 50 mmol Ttris-HCl 缓冲液(pH8.5)中,37 ℃反应30 min,用分光光度计测量232 nm 处的吸光度。PL 活性被定义为每分钟作用果胶产生 1 μmol 双键所需的酶量,单位为 U/g。
果胶甲酯酶(PME/PE)的提取参考Ren 等[22]的方法,称取1 g 柿果实样品,加6 mL 含 10 g/L PVPP的 8.8% NaCl 溶液,在4 ℃反应 1 h 后,在4 ℃、10000×g 离心 20 min,收集上清液,用氢氧化钠调节至pH 7.5 即为酶提取液。PE 的测定参考Guo 等[24]的方法并加以改进,取 2 mL 0.5%(w/v)果胶溶液,0.15 mL 0.01% 溴麝香草酚蓝,0.7 mL 蒸馏水,0.15 mL酶提取液,混合均匀,在25 °C 下保温30 min。测定620 nm 处的吸光度。PE 活性被定义为每克果肉每分钟吸光度值的变化,单位为 ΔOD/(g·min)。
1.2.9 总钙离子含量的测定 参考 GB 5009.92-2016,用火焰原子吸收光谱法测定柿果实中钙离子的含量。称取 0.3 g 柿果实样品,加入 8 mL 硝酸,与MARS6 微波消解仪中进行微波消解。将消解液转移至25 mL 容量瓶中,以蒸馏水定容。使用AA240FS原子吸收仪测定总钙离子含量。
1.3 数据处理
采用Origin 8.5 和SPSS 25 对数据进行统计分析。P<0.05 为显著性差异。
2 结果与分析
2.1 柿果实的理化指标分析
在贮藏 20 d 内,柿果实没有发生腐烂的现象,同时果萼片伸展方向为直立、卷曲姿态呈中部捏合状、不重叠,且在整个贮藏期变化不明显。不同处理柿果实的理化指标如图 1 所示。果实硬度是反映果实质地的一个重要指标。由图 1 A 可知,随着贮藏天数的增加,柿果实的硬度显著性降低(P<0.05),说明柿果实在逐渐后熟变软。但在整个贮藏期间,超声处理的柿果实硬度都显著高于对照组(P<0.05),相比对照,贮藏第 15 d 和 20 d,硬度分别提高 3.74 kg/cm2和2.97 kg/cm2。水分是柿子口感的基础,也是保鲜的关键指标[2]。由图 1 B 可知,贮藏的前 10 d,果实水分含量持续上升,其两组变化差异较小,其后熟过程中自身的生理生化反应对柿果含水量的影响较大;随着贮藏时间的延长,两组之间水分含量开始出现差异,在第 20 d 时,超声处理组和对照组含水量分别下降到 81.17% 和 80.77%。超声处理组水分含量仍然高于对照组,说明超声处理可保持柿果实较高的水分含量。
SSC 的含量对水果的营养价值,风味口感等方面有着重要影响,是呼吸代谢的主要底物。SSC 含量的变化是衡量柿果实品质和耐贮藏性的一个重要指标[25−26]。由图 1 C 可知,在贮藏期间,超声处理后的果实 SSC 含量一直呈显著性增加的趋势(P<0.05),对照组的 SSC 含量先增加后趋于稳定,说明超声处理可以保持柿果实较高的 SSC 含量。TA含量会对果实的口味、风味、耐贮藏性等产生影响[27]。TA 含量会随着细胞呼吸和果实衰老而被逐渐地分解,所以 TA 的含量是衡量柿果实保鲜品质的重要指标。由图 1 D 可知,随着贮藏天数的增加,柿果实的 TA 含量逐渐下降,这可能是柿果实中的有机酸在呼吸代谢过程中发生了氧化作用,导致了 TA 含量的下降[27]。两组对比变化差异不显著(P>0.05),说明超声处理对柿果实 TA 含量影响不大。色泽是表征果实品质的重要指标。由图 1 E 可知,随着贮藏天数的增加,果实的L*值整体呈降低趋势,在第 5、10 d和 20 d 时,超声处理的柿果实L*值都显著性高于对照组(P<0.05),说明超声处理对保持柿果皮的亮度有积极影响。由图 1 F 可知,在贮藏期间,超声处理后的果实ΔE显著性降低(P<0.05),且两组对比变化差异显著(P<0.05),超声处理的ΔE从 12.95 下降到9.89,下降了 3.05,对照组的ΔE从 10.97 下降到6.58,下降了 4.39。其中,超声处理的柿果实ΔE显著性高于对照组(P<0.05),最大差值为 3.31,说明超声处理对果实ΔE的降低有抑制作用。

图1 不同处理柿果实理化指标变化Fig.1 Changes in physical and chemical indexes of persimmon fruits in different treatments
2.2 柿果实果胶含量的变化
果胶是细胞壁的重要组成部分,是反映果实硬度变化的重要相关参数。随着果实的成熟,果胶物质会逐渐与纤维素分离形成易溶于水的果胶,使细胞壁结构受到破坏,导致果实硬度的下降[1]。由图 2 A 可知,贮藏的前 15 d,柿果实 WSP 含量显著性上升(P<0.05),与 0 d 相比,在 15 d 时超声处理组和对照组分别上升 0.96% 和 0.80%。贮藏 15 d 后 WSP 出现下降的趋势,与 15 d 相比,在 20 d 时超声处理组和对照组分别下降 0.67% 和 0.45%。由图 2 B 可知,在贮藏期间,ISP 的含量在前 5 d 降低,在 5~15 d显著性上升(P<0.05)。与 5 d 相比,在 15 d 时超声处理组和对照组分别增加 1.19% 和 1.38%,在 15 d后含量下降,且超声处理组 ISP 含量显著性低于对照组(P<0.05)。果胶的不同变化可能是因为果实细胞壁中不同溶解性果胶代谢模式并不是此消彼长的关系。在果实成熟软化过程中,细胞壁组分(包括果胶)会发生溶解、侧链断裂、解聚、去甲酯化、直接降解和溶胀等多种变化,从而影响果实质地变化的模式[28]。由图 2 C 可知,贮藏期间,对照组的 CSP 含量先降低后显著性升高(P<0.05),超声处理组 CSP 含量整体呈先上升后下降的趋势,且在第 10 d 之后,显著低于对照组(P<0.05)。在贮藏前期,超声处理的WSP 含量显著性高于对照组(P<0.05),这可能是由于超声处理产生了过强的空化作用,而空化作用产生的机械能促进了柿果实的细胞壁降解,使得贮藏前期,经超声处理后的果实 WSP 含量高于对照组[1]。
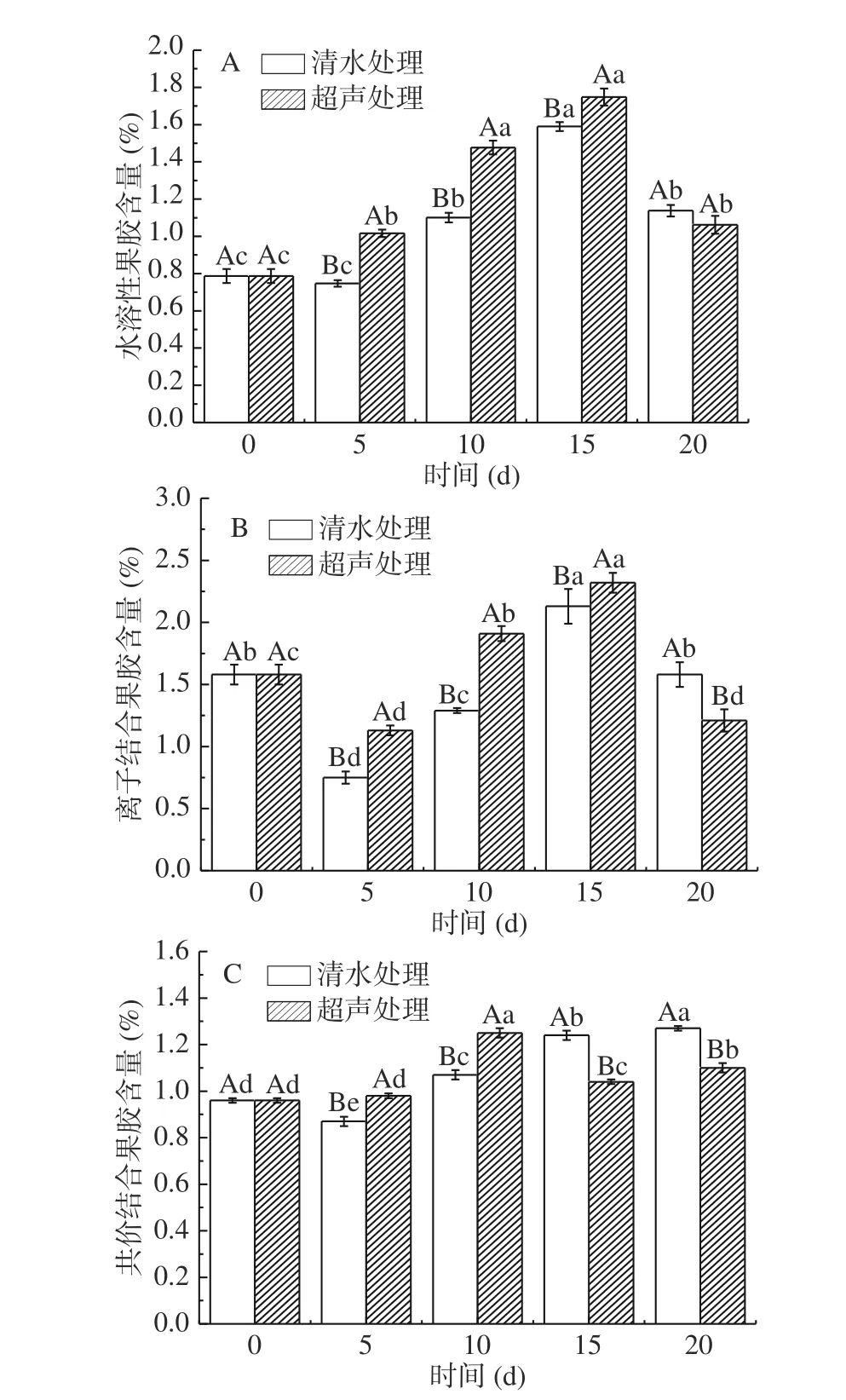
图2 不同处理柿果实的果胶含量变化Fig.2 Changes in pectin content of persimmon fruits with different treatments
2.3 柿果实果胶降解酶活性的变化
果胶降解酶是指分解果胶物质的多种酶的总称,主要包括 PG、PE 和 PL 等,这些酶会作用于果实中细胞壁的降解,是研究果实质地软化的重要指标[29]。图 3 A 显示,贮藏前 15 d,对照组柿果实的PG 活力呈显著上升的趋势(P<0.05),超声处理组在第 10 d 时下降,这可能是样本之间的差异性造成的,与 0 d 相比,在 15 d 时超声处理组和对照组分别增加 10.48 μg/(min·g)和 9.03 μg/(min·g)。第 20 d 时,处理组比对照组降低 8.79 μg/(min·g);图 3 B 显示,贮藏期间,柿果实的 PE 活力呈先上升后下降的趋势,两组变化差异显著(P<0.05),第 15 d 时,超声处理组的 PE 活力比对照组降低 3.31 ΔOD/(g·min),这与李江阔等[1]在柿果实采后保鲜中的研究结果一致;图 3 C 显示,贮藏期间,超声处理后柿果实的 PL 活力显著性低于对照组(P<0.05),第 20 d 时差异最显著(P<0.05),两者相差 1.47 U/g。由图 3 可知,经超声处理后的柿果实果胶降解酶(PG/PE/PL)的酶活低于对照组,说明超声处理可以抑制果实中果胶降解酶(PG/PE/PL)的活力,减少柿果实中细胞壁物质(果胶酯酸及果胶酸)的水解,从而减缓柿果实的软化,延长其货架期。
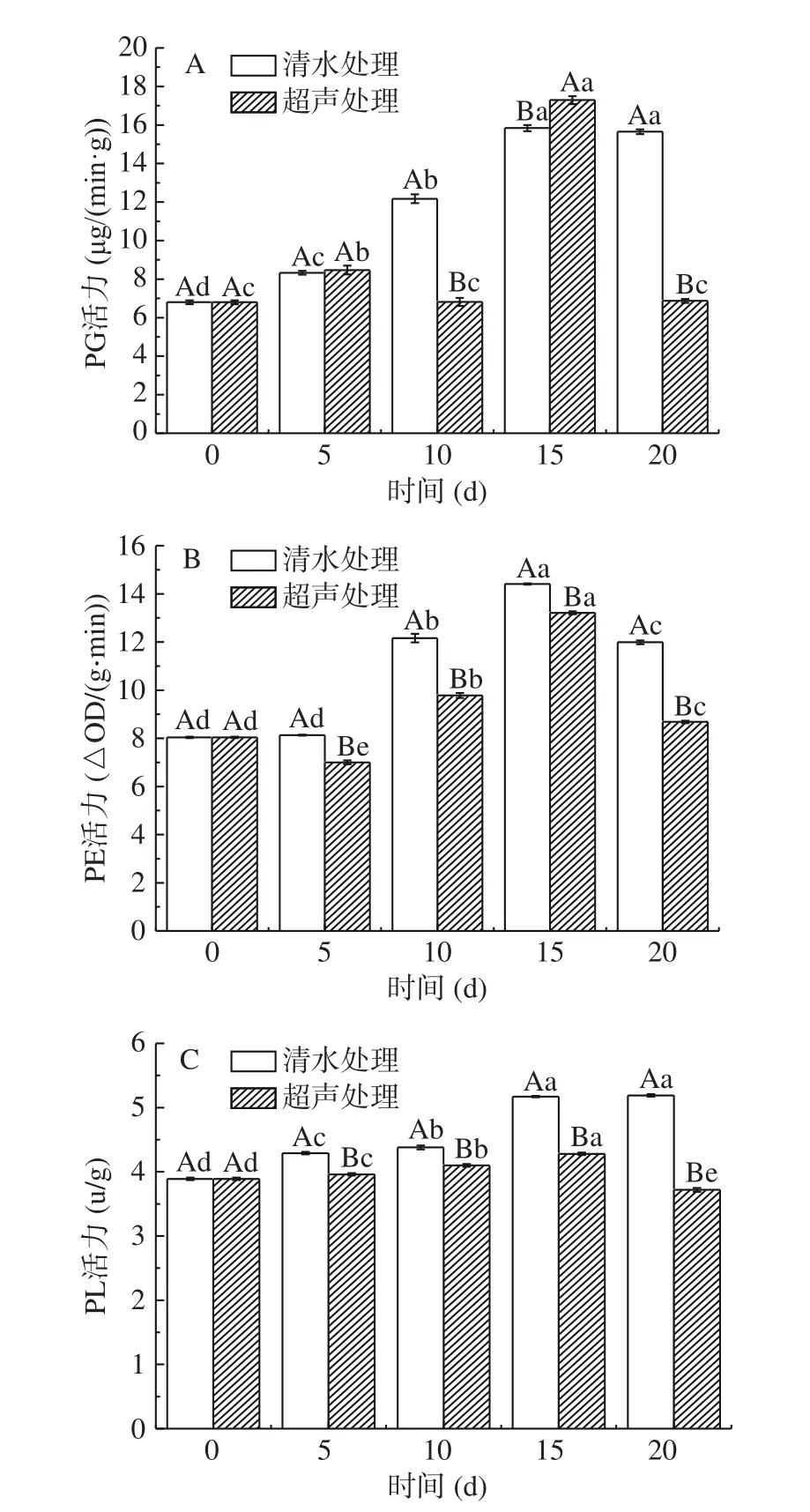
图3 不同处理柿果实果胶降解酶活性变化Fig.3 Changes of pectin degrading enzyme activity in persimmon fruit with different treatments
2.4 柿果实总钙离子含量的变化
钙具有维持细胞壁、细胞膜的结构及功能和调节控制离子环境与酶活性等的生理功能,是研究果实保鲜的重要指标[30]。由图 4 可知,在贮藏期间,柿果实的钙离子含量呈先上升后下降的趋势,第 15 d时含量最高,超声处理组和对照组分别达到了104.14 mg/kg 和93.53 mg/kg。在贮藏期间,两组果实的钙含量差异显著(P<0.05),第 20 d 时,超声处理后的果实钙离子含量比对照组增加 22.28 mg/kg。这与 Zhi 等[23]在枣果实中的研究结论一致,说明超声处理可以抑制柿果实中钙离子含量的降低。柯玉清等[31]指出果实中钙含量与其采后呼吸强度密切相关,对于跃变型果实,钙与其呼吸强度呈负相关;钙还可激活果实内固有抗菌物质活性,从而诱导果实产生抗病性或增强其抗病能力。超声处理可能通过抑制柿果实钙含量的降低,从而保持柿果实较高的硬度。
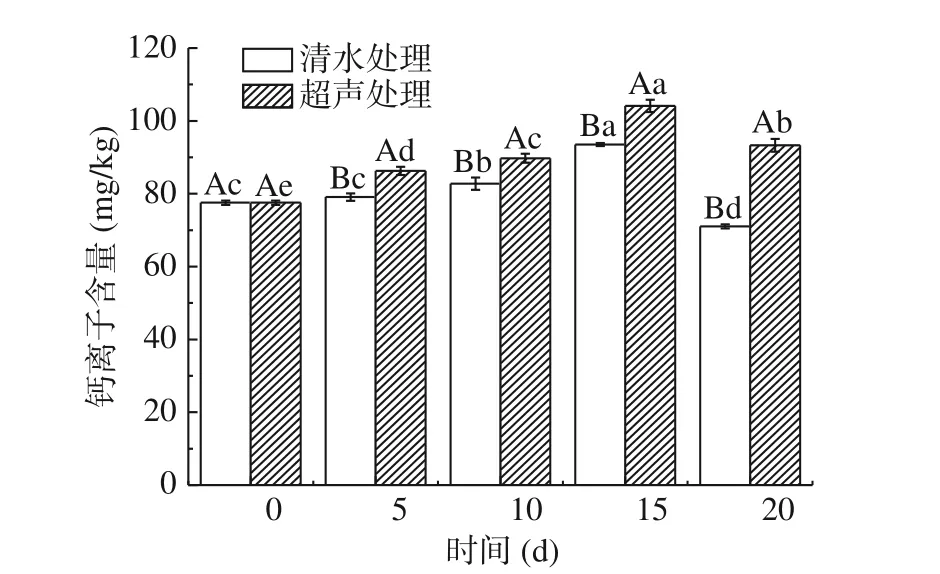
图4 不同处理柿果实钙离子含量变化Fig.4 Changes of calcium ion content in persimmon fruits with different treatments
3 结论
本研究采用超声波技术处理采后柿果实,通过硬度、果胶组分与降解酶活性的分析,探讨超声波技术对柿果实保鲜效果的影响。研究发现,超声处理后果实的硬度及含水量均显著高于对照组(P<0.05),15 d时两组硬度差异最显著(P<0.05),经超声处理后的硬度比对照组高 3.74 kg/cm2。超声处理后可保持果实较高的 SSC 含量,随着贮藏时间的延长超声处理后果实的L*值和ΔE值显著高于对照组(P<0.05),ΔE最大差值为 3.31。20 d 时,三种果胶降解酶(PG/PE/PL)含量显著低于对照组(P<0.05),超声处理组 PG、PE 和 PL 的活力分别比对照降低了 8.79 μg/(min·g)、3.31 ΔOD/(g·min)和 1.47 U/g,钙离子含量提高了 22.28 mg/kg。综合表明,超声波技术能够有效延缓柿果实的软化,保持果实的最佳品质,延长果实市场供应期,在柿果实的保鲜中具有较好的应用前景。
