气管滴注PM2.5混悬液对肺纤维化小鼠的影响及新对叶百部碱的干预作用
2021-09-14钱秀惠汤小艳许翔鸿
钱秀惠,孙 静,付 三,汤小艳,许翔鸿,张 勉
(中国药科大学中药学院,南京211198)
灰霾主要由SO2、氮氧化物和可吸入颗粒物组成。流行病学研究表明,可吸入颗粒物(particu‐late matter,PM)浓度的升高与人群疾病的发病率和病死率密切相关[1]。PM2.5是指空气动力学当量直径不超过2.5µm的颗粒物,能够透过细胞膜进入下呼吸道,沉积于支气管和肺泡,并可透过肺泡壁入侵整个血液循环系统,可导致肺部、心血管、中枢神经等多部位疾病的发生和加重[1-6]。目前普遍认为PM2.5的致病机制主要是引起肺部炎性反应和氧化应激损伤,进而影响心血管系统和神经系统[1-3]。肺纤维化是一种慢性进行性发展的间质性肺疾病,表现为进行性细胞外基质过度沉积,肺组织结构破坏及肺功能逐步丧失,患者多死于进行性加重的肺纤维化所致的呼吸衰竭,病死率高,且其发病率呈逐年上升趋势[7-8]。关于PM2.5对呼吸系统影响的研究主要集中于肺损伤,对肺纤维化的报道较少[9-12],且PM2.5给药方式、次数和剂量等差别较大,大多没有考虑雾霾天气中PM2.5的浓度,现实指导意义有限。因此,本研究以我国颁布的PM2.5浓度与空气污染等级的关系为依据[13-14],确定PM2.5的给药浓度范围;在此基础上研究了PM2.5单独滴注(对正常小鼠的影响)、与博来霉素(BLM)联合滴注(对肺纤维化小鼠的影响)以及PM2.5滴注次数对正常小鼠和肺纤维化小鼠的影响。本研究结果对于健康者和肺部疾病患者如何应对雾霾天气具有一定的指导意义。
百部是润肺止咳的传统中药,对叶百部(StemonatuberosaL.)是中药百部的主要基源之一,新对叶百部碱(neotuberostemonine,NTS)是对叶百部的主要的活性成分,具有止咳、改善肺损伤和肺纤维化的作用[15-18]。本研究拟在探讨PM2.5对BLM诱导的小鼠肺纤维化影响的基础上,研究NTS对PM2.5与BLM联合诱导给药的小鼠肺纤维化是否具有改善作用。
1 材料
1.1 药品与试剂
盐酸博来霉素(bleomycin,BLM,浙江海正辉瑞制药有限公司);尼达尼布(nintedanib,Nib,济南轩德化工有限公司);新对叶百部碱(neotuberoste‐monine,NTS)为本课题组从对叶百部(Stemonatu⁃berosaL.)块根中分得,其纯度大于98%(HPLC归一化法)[19];水合氯醛(上海阿拉丁生化科技股份有限公司)。α-SMA抗体(中国武汉Proteintech公司);TGF-β抗体(美国Cell Signaling Technology公司);GAPDH(上海Abways公司);羊抗兔IgG(H+L)HRP(联科生物有限公司)。羟脯氨酸(HYP)试剂盒(南京建成生物工程研究所);RIPA裂解液、超敏ECL化学发光试剂盒、BCA试剂盒(碧云天生物技术研究所)。其余试剂均为市售分析纯。
1.2仪器
TH-150F型智能中流量TSP(total suspended particle,空气总悬浮微粒)采样器(南京长祺环保设备有限公司);DW-86L386式超低温冰箱(青岛海尔特种电器有限公司);3700型低温高速离心机(日本久保田株式会社);冷冻干燥机(日本东京理化器械株式会社);酶标仪、电泳及转膜系统(美国Bio-Rad公司)。
1.3动物
清洁级雄性ICR小鼠,6周龄,体重22~24 g,购于扬州大学比较医学中心,实验动物许可证号为SCXK(苏)2017-0007。实验动物饲养于温度24~26℃、相对湿度50%~60%、昼夜节律为12 h/12 h的环境中,自由饮水、进食。动物实验前先适应性饲养1周。本实验的动物饲养和动物实验均严格遵守《中国药科大学伦理委员会章程》的规章和制度。
2 方 法
2.1 PM2.5药液制备分法
将TSP采集器置于室外(中国药科大学江宁校区)24 h,按照操作说明取下PM2.5收集滤片,剪碎,加双蒸水50 mL超声20 min,过滤。滤液于5 000 r/min离心20 min,弃上层,加双蒸水50 mL超声,重复上述步骤4次得到PM2.5混悬液,冷冻干燥即得。称取适量PM2.5粉末,充分分散于0.9%生理盐水中,制成所需浓度的PM2.5药液。现用现配,用前混匀。
2.2 小鼠模型制备及给药方法
2.2.1 模型制备方法 小鼠禁食不禁水12 h,4%水合氯醛麻醉后固定,无创法气管滴入所需浓度的药液50µL,将鼠板直立,旋转1 min,静置1 min,放回鼠笼休息。BLM剂量为1.5、3 U/kg,于第0天(D0)天滴注。PM2.5剂量为5 mg/kg(经预实验确定),分别滴注3次(D1、D8、D15)或6次(D1、D4、D8、D11、D15、D18),实验动物饲养至第21天。第22天处死小鼠,取肺组织,分别进行病理切片和相关指标的检测。
2.2.2 NTS给药方案 博来霉素滴注后的第8天(D8)开始,给药组和阳性药组小鼠分别灌胃给予NTS(30 mg/kg)和Nib(30 mg/kg),假手术组和模型组小鼠给予同体积的0.9%生理盐水,每天1次,连续给药至第21天。第22天处死小鼠,取肺组织,分别进行病理切片和相关指标的检测。
2.3 肺组织病理切片制作及评价方法
10%中性福尔马林溶液固定的肺组织制作常规石蜡切片(4µm厚),苏木精-伊红(HE)或Mas‐son染色。HE染色切片由专业研究人员于光学显微镜下阅片,根据肺泡隔是否增厚、肺内血管和气管周围是否有炎性细胞浸润、支气管上皮细胞是否变性脱落以及肺组织是否充血”进行炎性评分,每项的病变由基本正常到重度依次标记为0、1、2、3、4、5分,累加4项分数为炎性评分。Masson染色切片于光学显微镜下观察胶原纤维(蓝色)的分布情况,每张组织切片选取上、下、左、右和中间5个视野进行拍照,采用Image J软件选定并计算每张照片蓝色胶原部分面积和除空白外的总组织面积,计算胶原容积分数(CVF,collagen volume frac‐tion),CVF(%)=蓝色胶原面积/总组织面积×100。
2.4 羟脯氨酸含量测定
小鼠肺组织适量冷冻干燥至恒重,按照羟脯氨酸试剂盒说明书进行羟脯氨酸含量的测定。
2.5 α-SMA和TGF-β蛋白表达测定
小鼠肺组织适量,加入RIPA裂解液,充分匀浆裂解后,于4℃、12 000 r/min离心10 min,取上清液,BCA法测定蛋白浓度,Westernblot方法检测α-SMA和TGF-β的蛋白表达水平。
2.6 统计学分析
采用IBM SPSS Statistics 22.0软件进行统计学分析,数据均以xˉ±s表示,单因素方差分析(One-Way ANOVA)检验方差齐性。两两比较采用独立样本t检验,组间多重比较采用LSD检验(方差齐性)或Tamhane′s T2检验(方差不齐性)。因素主效应及其交互效应采用析因设计方差分析。以P<0.05表示差异具有统计学意义。
3 结 果
3.1 BLM剂量和PM2.5频次对肺纤维化小鼠的影响
为了探索BLM剂量与PM2.5给药次数对小鼠肺纤维化模型的影响,采用析因实验设计研究了BLM剂量(0、1.5、3.0 U/kg)和PM2.5混悬液(5 mg/kg,经预实验确定)给药频次(0、3、6次,即每周0次或1次或2次)对小鼠肺纤维化的影响。具体通过考察小鼠单给予PM2.5混悬液3次(P3)或6次(P6),或单给予BLM 1.5 U/kg(B1)或3U/kg(B2),或给予BLM 1.5U/kg+PM2.5混 悬 液3次(C13)或6次(C16),或给予BLM 3U/kg+PM2.5混悬液3次(C23)或6次(C26)的肺纤维化相关指标变化来进行分析。实验方案和结果如表1、图1所示。与假手术(sham)组相比,除P3组外其余各组的HYP含量均显著升高;各组肺组织切片的HE炎性评分均显著高于假手术组;除P3、P6、B1组外其余各组肺组织切片(Masson染色)的胶原沉积分数(CVF)均显著高于假手术组,说明BLM高剂量组(P<0.05)和各联合给药组(P<0.01)小鼠均发生了实质性肺纤维化。与B1组相比,联合给药C13、C16组小鼠HYP含量、HE炎性评分和胶原沉积分数CVF均显著高于B1组;与B2组相比,联合给药的C23、C26组小鼠主要表现为胶原沉积分数CVF显著升高。与P3组相比,C13、C23组小鼠HYP含量、炎性评分和CVF均显著高于P3组。与P6组比,C16、C26组小鼠的HYP含量和CVF显著升高。
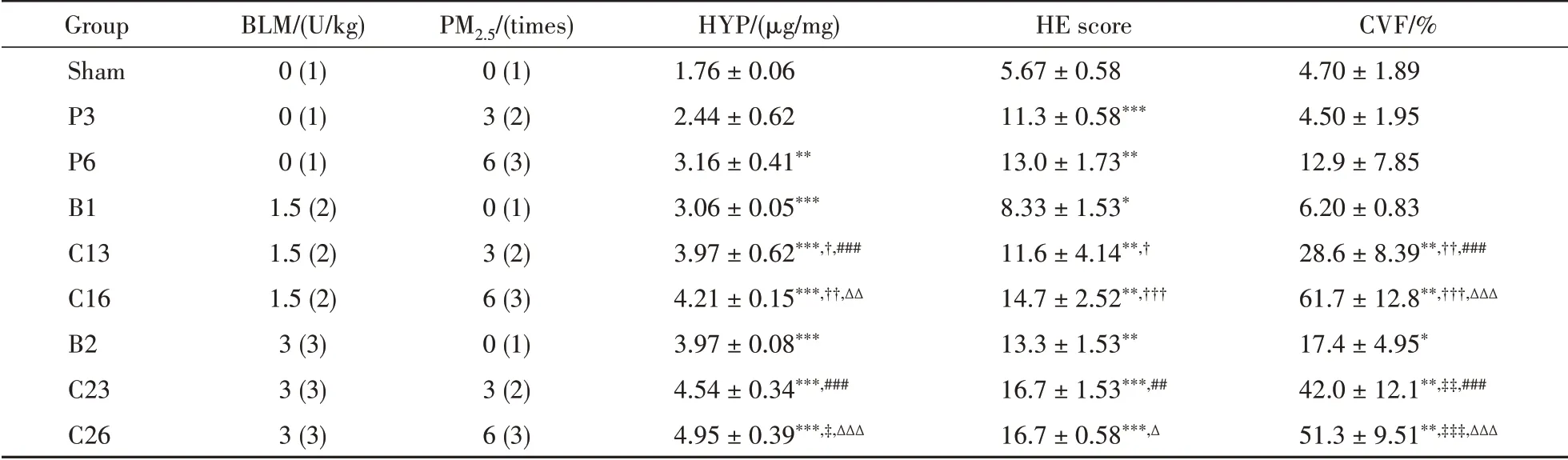
Table 1 Factorial design groups and experimental results(xˉ±s,n=5)
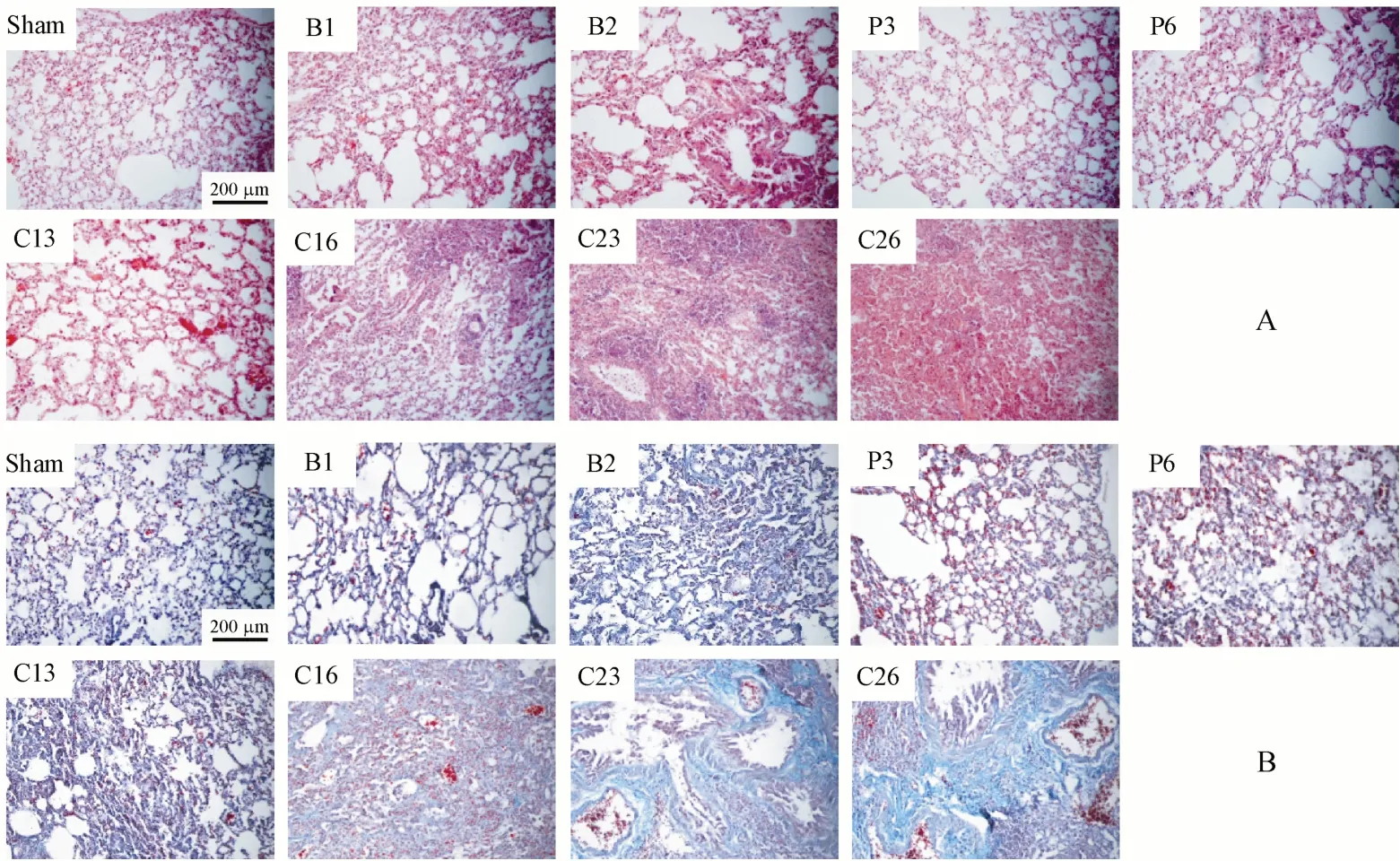
Figure 1 Effects of BLM dose and PM2.5 administration times on pulmonary fibrosis in miceThe mice grouping scheme and dosing plan are shown in Table 1.BLM were intratracheally given to mice on day 0 and PM2.5 on days 1,8,15(3 times)or on days 1,4,8,11,15,18(6 times),and kept until day 21A:Lung injury was assessed by HE staining(×100);B:Collagen deposition was assessed by Masson´s trichrome staining(blue,×100)
析因实验设计结果的方差分析见表2,BLM剂量和PM2.5频次对HYP、HE评分和胶原沉积分数CVF均有显著影响(P<0.01),二者的交互作用仅对CVF有一定影响(P<0.05)。从F来看,BLM浓度对HYP含量和CVF的影响大于PM2.5给药次数的影响,而PM2.5给药次数对HE评分的影响大于BLM剂量的影响。从方差分析结果看,BLM剂量为3 U/kg、PM2.5给药6次时小鼠肺纤维化极为严重,不太适合用于考察药物的药效;且当BLM浓度为3 U/kg时,小鼠病死率也较高。因此选择BLM剂量1.5 U/kg、PM2.5给药3或6次为造模方案。
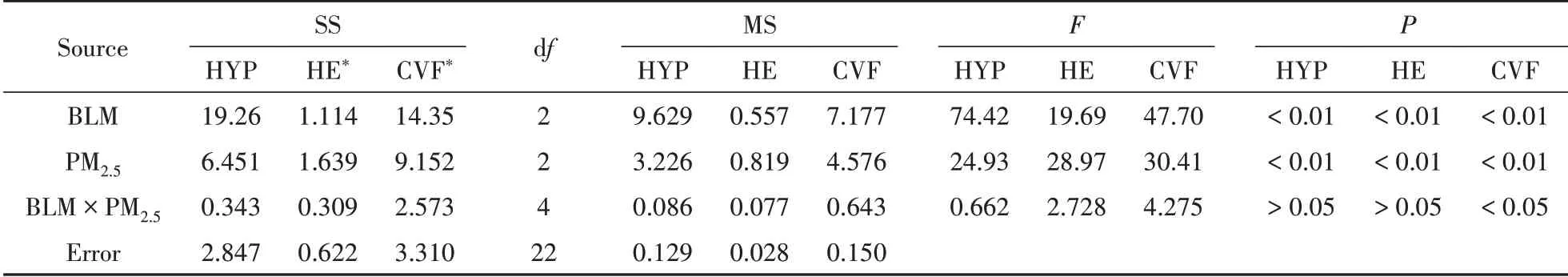
Table 2 Analysis of variance forBLM dose and PM2.5 frequency
3.2 NTS对PM2.5与BLM联合造模肺纤维化小鼠的影响
综合上述实验结果,以BLM(1.5 U/kg)、PM2.5给药3次为模型M1,以BLM(1.5 U/kg)、PM2.5给药6次为模型M2,以美国FDA于2014批准的治疗肺纤维化药物尼达尼布(nintedanib,Nib)[20]为阳性药,研究新对叶百部碱(NTS)对M1和M2模型小鼠的影响,实验方案如表3所示。从小鼠体重和肺系数来看(图2),小鼠体重整体来说差别不大;NTS1组的肺系数较之M1组降低(P<0.05),而NTS2组较之M2组差异不显著。小鼠肺组织HE、Masson染色结果(图3)显示,NTS1和NTS2均有降低M1和M2炎性评分的趋势;NTS1组较之M1模型组可显著降低CVF(P<0.01),NTS2组较之M2模型组亦可明显降低CVF,但由于数据离散度大而无统计学意义。从α-SMA和TGF-β蛋白表达(图4)来看,NTS可显著降低M1或M2模型组的α-SMA表达(P<0.01、0.05),但是对TGF-β影响不大。
4 讨 论
肺组织损伤后如果不能正常修复,就会引起成纤维细胞的异常大量增殖并转分化为肌成纤维细胞,后者分泌大量的细胞外基质(胶原蛋白)而导致肺纤维化发生[7]。羟脯氨酸(HYP)是胶原中特有的氨基酸[21],其含量可间接反映胶原蛋白的沉积程度;α-SMA蛋白是肌成纤维细胞的标志性蛋白[22],可反映成纤维细胞转分化的程度;而TGFβ是公认的最强促纤维化因子,能够直接诱导成纤维细胞转分化[23]。因此,本实验选用以上常用指标和组织病理切片(结合半定量分析)对肺纤维化模型和药效进行了评价。
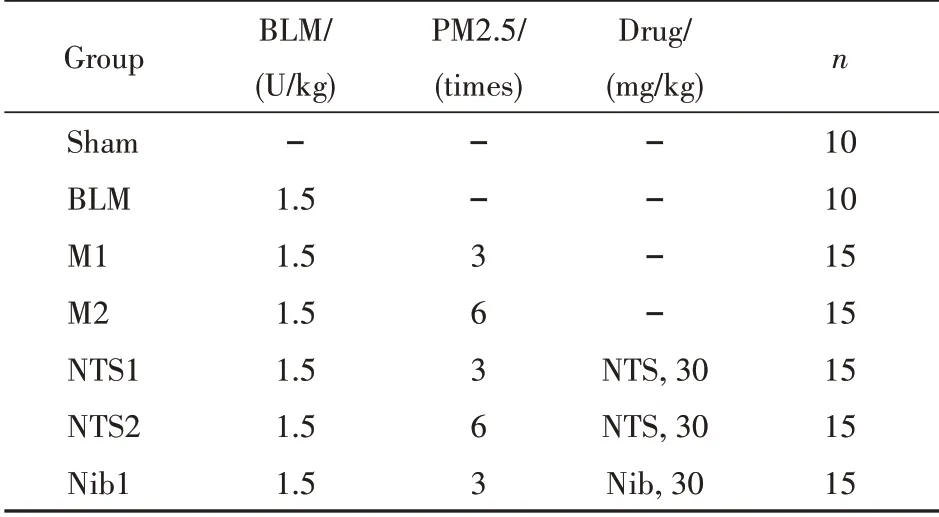
Table 3 Preparation of pulmonary fibrosis model and dosage regimen of NTS
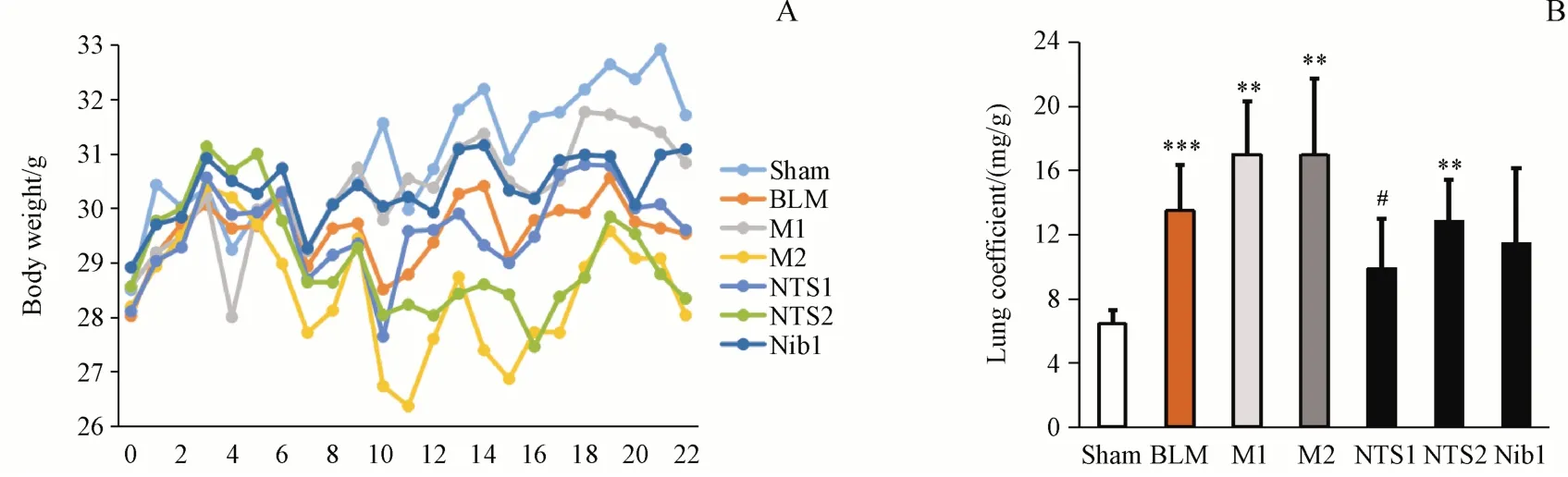
Figure 2 Effect of NTS on body weight and lung coefficient in mice with pulmonary fibrosis(xˉ±s,n=9-11)1.5 U/kg BLM was intratracheally given to mice on day 0,and 5 mg/kg PM2.5 was intratracheally given on days 1,8,15(M1 model)or on days 1,4,8,11,15,18(M2 model).NTS and Nib(positive drug)were orally given to mice from day 8 to day 21A:Changes of body weight;B:Lung coefficient**P<0.01,***P<0.001 vs sham group;#P<0.05 vs M1 group;Tamhane´s T2 test for B
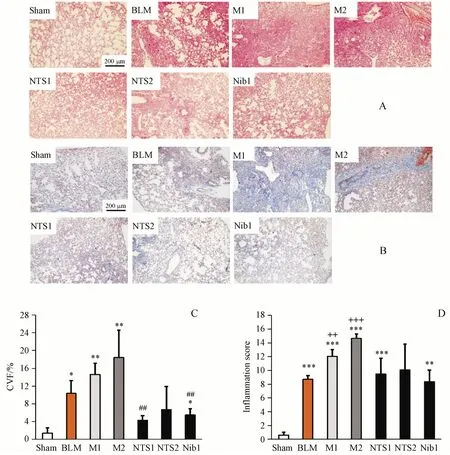
Figure 3 Effect of NTS on histopathological changes of lung tissue in mice with pulmonary fibrosisA:HE staining lung section(×100);B:Masson staining lung section(×100,collagen stained in blue);C:inflammatory score(xˉ±s,n=5);D:colla‐gen volume fraction(CVF%=collagen area/total tissue area×100%,xˉ±s,n=5)*P<0.05,**P<0.01,***P<0.001 vs sham group;++P<0.01,+++P<0.001 v s BLM group;##P<0.01 vs M1 group;Tamhane´s T2 test for C and D
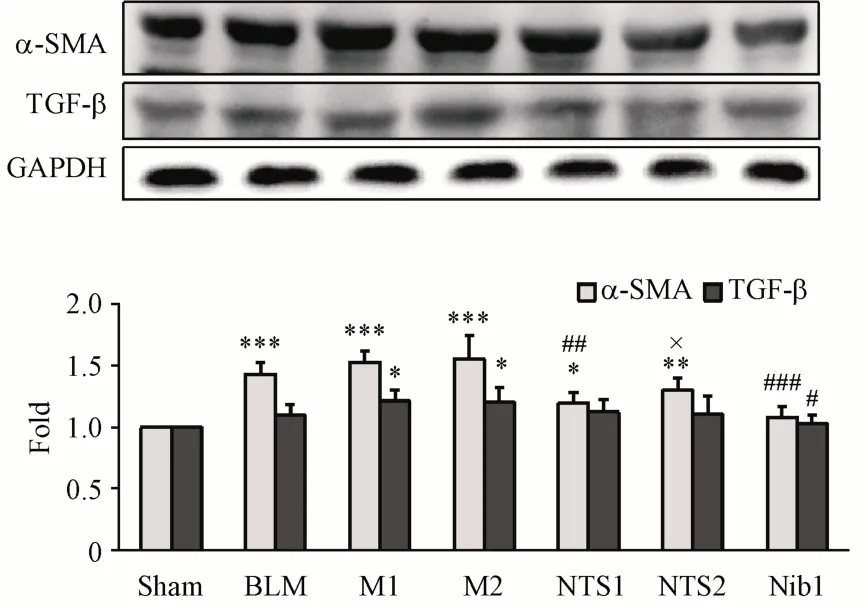
Figure 4 Effects of NTS onα-SMA and TGF-βlevels in mice with pulmonary fibrosisα-SMA and TGF-βlevels were evaluated by Western blot(xˉ±s,n=3)*P<0.05,**P<0.01,***P<0.001 vs sham group;#P<0.05,##P<0.01,###P<0.001 v s M1 group;×P<0.05 vs M2 group;LSD-test
我国2012年发布的《环境空气质量指数(AQI)技术规定(试行)》和《环境空气质量标准》[13-14],根据24 h PM2.5的平均值规定了0~500µg/m³8个浓度限值,PM2.5与空气质量的关系为:0~35µg/m³为优,35~75µg/m³为良,75~115µg/m³为轻度污染,115~150µg/m³为中度污染,150~250µg/m³为重度污染,大于250µg/m³为严重污染。据文献报道,成年人的呼吸速率约为16.5 m3/d,进入肺部的空气为呼吸速率的0.75(气体交换比)[24],因此一个成年人24 h吸入的空气量约为12.4 m³。如果PM2.5的平均浓度为250µg/m³,则24 h吸入的PM2.5为3.09 mg,按60 kg体重计,每千克体重为0.052 mg,折算成小鼠给药剂量为0.465≈0.50 mg/kg。因此,小鼠给药5 mg/kg是0.5 mg/kg(250µg/m³)的10倍,即相当于PM2.5浓度为2 500µg/m³。
预实验结果显示,BLM与PM2.5混合后滴注(第0天),小鼠纤维化程度明显小于非混合式的联合滴注(BLM第0天、PM2.5第1天);5、10 mg/kg的PM2.5与BLM联合给药均能明显加重BLM引起的肺纤维化,但高剂量时小鼠病死率高。因此本实验采用了5 mg/kg PM2.5、非混合式的联合给药方法,并采用析因实验设计进一步优化BLM剂量和PM2.5给药次数。结果显示,单独的PM2.5滴注3次只有HE评分较之假手术组明显升高,滴注6次时HYP和HE评分显著增加但胶原容积分数CVF无显著升高,表明PM2.5即使多次给药引起肺纤维化的可能性也较小。但也有研究显示,虽然PM2.5短期暴露(5.4 mg/kg、每3天1次、共10次)不会立即导致肺纤维化,但停止暴露后随着时间的延长可能会逐渐发展为肺纤维化[25]。但是,PM2.5与BLM联合造模各组小鼠的胶原容积分数CVF大大增加,说明二者的相互作用对胶原沉积影响显著,即PM2.5可大大加重BLM引起的肺纤维化。NTS对于PM2.5和BLM联合造成的肺纤维化具有较好的修复作用。
关于PM2.5对肺纤维化的影响,临床流行病学调查研究的结果并不一致[26-27]。从病理学研究结果来看,造模方法有PM2.5+BLM联合造模[9-10]和PM2.5单独造模[11-12],基本都认同PM2.5对于肺纤维化具有促进作用。从PM2.5的滴注剂量来看,与BLM联合造模周期为21 d,PM2.5剂量为单次滴注3.75 mg/kg(大鼠,约相当于小鼠5.6 mg/kg)[9]或100 mg/kg[10];PM2.5独立造模周期为28 d,PM2.5剂量为每小鼠每d0.1 mg(0.1 mg/25 g=4 mg/kg)[11]或50 mg/kg、每周2次(大鼠,约相当于小鼠75 mg/kg)[12]。按照给药剂量与PM2.5浓度的换算,小鼠给药剂量75~100 mg/kg相当于大气PM2.5浓度37 500~50 000µg/m³,估计这样的浓度在自然状态下极难达到。
本研究结果显示,单纯的PM2.5对正常人的影响主要是引发肺部炎症,如果浓度低或持续时间短则能够自愈,不会发展成肺纤维化;但是对于有肺纤维化疾病(或其他呼吸道或肺部疾病)的人则影响较大,会极大地加速或加重原有疾病的发展。NTS对实验性肺纤维化具有较好的疗效。
