植物菌根块菌分子鉴定及菌丝培养基优化的研究
2021-09-13樊莉娟张国珍张冰冰徐莺秦小波
樊莉娟 张国珍 张冰冰 徐莺 秦小波

摘 要:塊菌属(Tuber)是由真菌感染其适宜植物根系形成,部分块菌如法国黑孢块菌(T. melanosporum)和中国印度块菌(T. indicum)等为珍稀药食两用菌,具有很高的经济价值。对块菌的过度挖掘造成野生块菌资源匮乏,块菌人工栽培技术则是实现块菌产业可持续性发展的重要基础。目前国内外人工栽培主要采用块菌子实体匀浆制成的子囊孢子悬浮液,与人工种植苗木根系共生。利用块菌菌丝替代子实体孢子悬浮液进行接种,具有减少对块菌子实体的依赖性和生产成本、保护林下块菌野生资源、促进块菌人工繁育进程的积极意义,但需要成熟高效的菌丝培养技术。该研究从云南、陕西等地林下采取块菌样品,在ITS分子鉴定并纯化得到纯种菌丝的基础上,以菌丝直径为指标,经单因素实验和4因素3水平正交实验L9(34),筛选得出最适宜的菌丝生长培养基。结果表明:(1)形态和ITS分子鉴定得到的13份块菌样品分属印度块菌(T. indicum)和假凹陷块菌(T. pseudoexcavatum)两种。(2)纯化的印度块菌菌丝培养基的最佳碳源为马铃薯浸出液,最佳氮源为酵母膏,VB1对印度块菌菌丝生长并无显著性促进作用。(3)最佳的碳源、氮源、无机盐组合为马铃薯浸出液150 g·L-1、酵母膏3 g·L-1、MgSO4 2 g·L-1、KH2PO4 2 g·L-1。25 ℃,自然pH下培养8 d菌丝直径可达49.44 mm。
关键词:块菌属,ITS,菌丝,固体培养基,优化
中图分类号:Q943.1
文献标识码:A
文章编号:1000-3142(2021)08-1288-08
Abstract: Tuber is a type of fungus underground, formed by infecting suitable plant roots. And some species such as T. melanosporum and T. indicum are rare and valuable for both medicine and food, and have high economic values. The over excavation of Tuber has caused a shortage of wild Tuber resources, and the artificial cultivation technology of Tuber is an important foundation for the sustainable development of the Tuber industry. At present, the ascosporic suspension made from the homogenate of the fruiting body, is mainly used in the artificial cultivation, which is symbiotic with the roots of the planting seedlings. It is valuable for reducing the dependence on the fruiting body of Tuber and the production cost, protecting the wild resources of Tuber under the forest and promoting the process of artificial propagation of Tuber, to use the hyphae of Tuber instead of the spore suspension for inoculation, but it needs mature and efficient technology for hyphae culture. Tuber samples in this study were taken from the forests of Yunnan, Shaanxi and other places. Then, ITS sequence analysis was carried out to identify species and purify hyphaes. The most suitable hyphae growth medium was selected by the L9(34) orthogonal test (four factors with three levels), using the hyphae diameter as an index. The results were as follows: (1) The 13 Tuber samples identified by morphological and ITS molecular identification belonged to T. indicum and T. pseudoexcavatum. (2) The optimum carbon source for T. indicum hyphae was potato extract, and the optimum nitrogen source was yeast extract. However, VB1 had no significant promotion effect on the hyphae growth of T. indicum. (3) The optimal combination of carbon, nitrogen and inorganic salts was potato extract 150 g·L-1, yeast extract 3 g·L-1, MgSO4 2 g·L-1, and KH2PO4 2 g·L-1. The diameter of hyphae can reach 49.44 mm, which is cultured at 25 ℃ and natural pH for 8 d.
Key words: Tuber, ITS, hyphae, solid medium, optimization
塊菌属(Tuber)是由土壤真菌感染其共生的植物根系形成(王曙光和林先贵,2001)。全世界已知块菌种类超过180种,主要分布在法国、意大利(Bonito et al., 2010)以及中国的四川、云南、新疆、西藏等地(张介平和刘培贵,2015)。块菌富含蛋白质、维生素、氨基酸和矿物质等营养物质,风味独特(陶恺和刘波,1990),其含有的α-雄烷醇、块菌多糖具有提升免疫力、抗肿瘤与抗氧化等重要功效(曹晋忠等,2011),价格昂贵,异常珍稀,是重要的经济真菌(邓晓娟等,2019)。
近年来由于开发过度,野生块菌产量显著减少,开展其人工栽培是其必然趋势。目前国内外主要采用块菌子实体匀浆制成的子囊孢子悬浮液,接种于适宜的人工种植宿主苗木根系共生,模拟野生生长环境来进行半人工栽培。但是,子实体中的害虫和病原体以及其他菌根真菌会污染植物根系,影响块菌菌根形成。并且每株植物根系均接种多个孢子,且子囊孢子是有性孢子,因此,其菌根成分可能互不相同,难以适应特定的土壤和气候条件(Iotti et al., 2016)。特别是由于块菌本身价值就很高,造成子实体匀浆接种成本也高,存在过程繁琐、周期长、产量低、对自然环境条件依赖严重等问题(胡炳福等,2010)。Iotti et al.(2016)报道将勃氏块菌的纯培养菌丝代替子实体匀浆孢子悬浮液,接种于宿主苗木获得菌根,并成功产生子实体。该技术不仅降低了其根系污染的风险,而且极大地节约了生产成本。印度块菌作为中国主要商业块菌,采用印度块菌菌丝接种而获得菌根及子实体的案例,目前尚未有报道。因此,本研究从块菌的分子鉴定着手,通过筛选优良的印度块菌母种菌丝培养基,获得优良菌丝,旨在为后续的印度块菌菌丝接种植物根系、获得菌根和子实体提供理论依据和支持,对降低成本、加快其人工栽培进程具有重要价值,还促进了林下块菌菌根的资源保护。
1材料与方法
1.1 试验材料
从陕西、云南等地林下采取块菌子实体见图1。宿主苗木见表1,经初步形态鉴定后组织分离培养获得纯种菌丝。
1.2 方法
1.2.1 菌丝分离纯化 以PDA为纯化培养基,采用组织分离法进行(周建平等,2017)。
1.2.2 基于rDNA ITS序列的分子鉴定
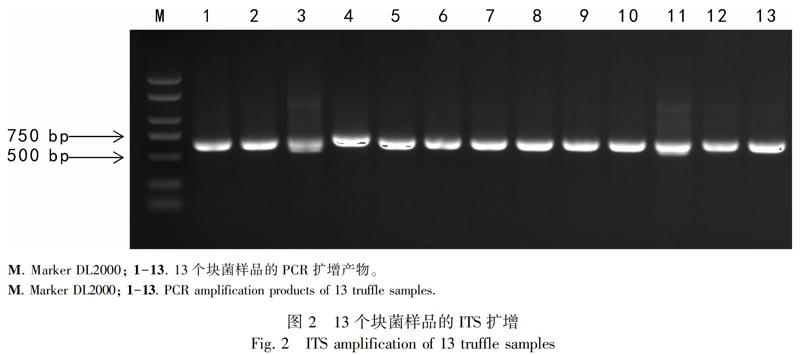
1.2.2.1 样品DNA提取及rDNA ITS序列扩增 采用植物DNA提取试剂盒 (天根生化北京有限公司)提取块菌子实体组织DNA。采用真菌ITS序列通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对样品rDNA ITS序列进行扩增。PCR体系:2×primestar Mix 高保真酶25 μL、模板2 μL、引物各2 μL、ddH2O 19 μL。扩增程序:98 ℃预变性2 min,35个循环(98 ℃变性30 s,55 ℃退火10 s,72 ℃延伸10 s),72 ℃再延伸2 min,12 ℃保存。1%琼脂糖凝胶电泳检测条带大小,凝胶回收目的条带。
1.2.2.2 目的条带的载体构建、测序及序列比对分析 采用T4 Quick Blunt试剂盒(诺唯赞生物科技有限公司)连接目的条带至T4载体中,由上海生工生物工程技术服务有限公司测序。将所测ITS序列利用BLAST程序与NCBI中的核酸数据库进行同源性比对,以相似性比对得分最高的参考序列确定所测样品的物种。
1.2.3单因素试验 碳源筛选:分别以葡萄糖20 g·L-1、马铃薯200 g·L-1、蔗糖20 g·L-1、麦芽糖20 g·L-1作为碳源。其他成分:蛋白胨2 g·L-1,KH2PO4 1 g·L-1,MgSO4 1 g·L-1,VB1 0.05 g·L-1,琼脂粉20 g·L-1。
氮源筛选:分别以蛋白胨2 g·L-1、酵母膏2 g·L-1、牛肉膏2 g·L-1、氯化铵2 g·L-1、硝酸铵2 g·L-1作为氮源。其他成分:葡萄糖20 g·L-1,KH2PO4 1 g·L-1,MgSO4 1 g·L-1,VB1 0.05 g·L-1,琼脂粉20 g·L-1。
VB1筛选:将VB1作为变量,分别设置空白对照组与VB1组。其他成分:葡萄糖20 g·L-1,蛋白胨2 g·L-1,KH2PO4 1 g·L-1,MgSO4 1 g·L-1,VB1 0.05 g·L-1,琼脂粉20 g·L-1。
各设置3个重复,自然pH,置于25 ℃培养(马欣燕等,2016),7 d后统计菌丝生长直径。数据统计及显著性分析采用GraphPad Prism 5软件及SPSS 22.0软件的ANOVA 方法完成。
1.2.4 正交试验 将单因素试验筛选出的最佳因子,结合前人研究表明对食用菌菌丝有促进作用的MgSO4及KH2PO4两个因素(何明霞等,2009;马欣燕等,2016)进行正交试验,以筛选各因素的最佳组合,各设置4个重复,培养条件同上。正交试验极差分析采用Minitab 17软件完成。
2 结果与分析
2.1 基于ITS序列分子鉴定
以子实体提取的DNA为模板,采取真菌通用引物ITS1和ITS4进行PCR扩增,13个样品均扩增出清晰条带,大小约600 bp(图2)。将样品序列在NCBI核酸数据库中进行比对,共匹配出3种块菌:印度块菌(Tuber indicum)、假凹陷块菌(T. pseudoexcavatum)和中国块菌(T. sinense)(表1)。由于目前中国块菌和印度块菌已被鉴定为同种(Chen et al., 2011),故本次调查获得的块菌实际只有2个种。
2.2 块菌菌丝分离
菌丝提取DNA后,进行ITS序列鉴定比对后确定为印度块菌。
2.3 单因素试验不同碳源对印度块菌菌丝生长的影响
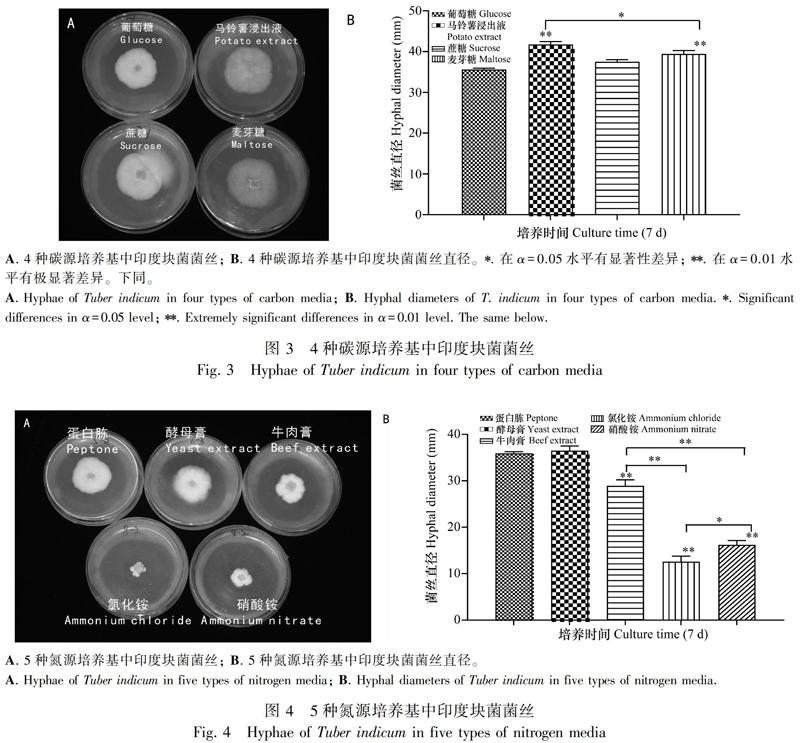
以菌丝直径为衡量指标,判断不同碳源对印度块菌菌丝生长的影响(图3)。发现4种碳源均能较好地被印度块菌所利用,而马铃薯浸出液培养基和麦芽糖培养基上的菌丝直径明显大于葡萄糖与蔗糖培养基(图3:A)。其中,马铃薯浸出液组、麦芽糖组与葡萄糖组在α=0.01水平上具有极显著差异;马铃薯浸出液组与麦芽糖组在α=0.05水平上也具有显著性差异,故马铃薯浸出液为本试验中块菌最佳碳源,采用马铃薯进行后续正交试验(图3:B)。
2.4 单因素试验不同氮源对印度块菌菌丝生长的影响
因食用菌对无机氮源和有机氮源均能进行吸收利用,且部分食用菌对无机氮源利用率更高(牛玉蓉等,2013),故本次以菌丝直径为衡量指标,以蛋白胨为对照,对两类氮源均进行了试验(图4)。有机氮源和无机氮源对菌落直径的影响在α=0.01水平上极显著差异,前者的效果明显好于后者,但牛肉膏的效果要逊于蛋白胨和酵母膏。在无机氮源中,硝酸铵的效果要优于氯化铵,在α=0.05水平上显著差异。综上结果表明,印度块菌对5种氮源的吸收利用率为酵母膏>蛋白胨>牛肉膏>硝酸铵>氯化铵,因此,本研究采用酵母膏进行后续正交试验。
2.5 VB1对印度块菌菌丝生长的影响
前人研究证明,VB1对某些食用菌如鸡枞菌丝、草原白蘑菌丝等生长有促进作用(王小丹等,2011;马荣山和方蕊,2011)。但是在本试验中,VB1对块菌的生长并无显著性促进作用(图5)。因此,从实际生产利用的成本出发,在培养母种菌丝时,未将VB1纳入后续正交试验。
2.6 正交试验筛选最佳培养基
将单因素试验所得的最佳碳源、最佳氮源,以及前人研究所得的MgSO4及KH2PO4按L9(34)4因素3水平设计正交试验,复选优化印度块菌菌丝生长的固体培养基(表2)。极差R的大小代表各个因素在不同水平时对菌丝直径影响程度的大小,其中极差R越大,则此因素在不同水平对菌丝直径的影响就越大(Gregory et al., 2013),故碳源马铃薯浸出液对印度块菌菌丝生长直径影响最大,MgSO4次之,再次为酵母膏,最后为KH2PO4。
k值代表同一因素不同水平对菌丝直径的影响,其中k值较大者代表此水平对菌丝直径有较好的促进作用(陈文强等,2005),因此,本研究中的印度块菌菌丝生长的最佳培养条件为A1B3C3D3,即马铃薯浸出液150 g·L-1、酵母膏3 g·L-1、MgSO4 2 g·L-1、KH2PO4 2 g·L-1。
3 讨论与结论
块菌营养物质丰富,但因资源稀缺、采摘难度大等多种因素,造成其价格极昂贵,人工培育将成为其必然发展趋势(郭尚等,2014)。块菌菌丝对比子实体匀浆孢子悬浮液,具有易获得、易保存、纯化程度高、成本低等优点。本研究获得了印度块菌菌丝最适宜母种培养基,该结果不仅促进了印度块菌的人工培育进程,而且能促进林下块菌菌根的资源保护。
在多数食用菌碳源筛选中,最佳碳源多为葡萄糖、蔗糖以及麦芽糖等(陈文强等,2002;徐瑞雅等,2007;何明霞等,2009)。葡萄糖是多数食用菌良好同化利用的碳源,但并非是所有食用菌最好的碳源。马铃薯浸出液的主要成分为淀粉物质,据报道,葡萄糖经高温灭菌后还原糖含量降低,而可溶性淀粉经高温灭菌处理后产生复杂变化,还原糖含量升高,更容易被一些食用菌菌丝吸收利用,例如,香菇、柳松茸在高温灭菌的可溶性淀粉为唯一碳源的培养基中生长最快,蛹虫草在间歇灭菌的可溶性淀粉为唯一碳源的培养基中生长最快(何培新等,2003)。本研究中,印度块菌培养基的最适碳源为马铃薯浸出液,可能是印度块菌菌丝能产生高活性的淀粉酶快速分解淀粉。另外据报道,马鈴薯含有多种营养物质、酶类、生理活性物质以及矿物质等微量元素(吕巨智等,2009;丁红瑾,2013),具有丰富的营养价值。邓晓娟等(2019)在印度块菌子囊果内细菌的群落结构研究中,发现其细菌物种丰富,群落结构复杂,包括4属40种,其中变形菌门、拟杆菌门和放线菌门的物种占总物种数的99.7%,是其优势细菌。其中放线菌门产生的多种酶类,变形菌门的固氮细菌有效固氮,多种细菌产生的复杂影响有利于印度块菌的菌丝生长和子囊果的形成(Streiblová et al., 2012)。马铃薯作为印度块菌的最适碳源,可能是马铃薯浸出液中的有关酶类等生物活性物质,以及矿物质等微量元素弥补了块菌子囊果中细菌产生的有效活性物质,从而促进印度块菌菌丝的生长。块菌菌根是与其适宜苗木的根系共生而形成,马铃薯块茎作为一种变态茎,其中可能含有与块菌共生苗木根系的类似成分,而促进块菌菌丝的生长,这暗示也许可从植物的根茎中分离出可促进块菌菌丝生长的物质,我们将在以后的工作中进行实验探索和验证。
本研究结果表明,VB1对印度块菌的菌丝生长并无促进作用,相反,VB1对某些食用菌如鸡枞菌丝、草原白蘑菌丝等生长则有促进作用(王小丹等,2011;马荣山和方蕊,2011)。目前块菌尚无相关研究涉及维生素的应用机理,猜测可能是印度块菌长期与宿主植物根系共生,多种细菌影响子囊果的生态适应性,使得形成无需VB1的独特性质,但具体的机理等还需进一步研究。
综合本研究结果,最后得出印度块菌优化母种培养基配方为马铃薯浸出液150 g·L-1、酵母膏3 g·L-1、MgSO4 2 g·L-1、KH2PO4 2 g·L-1,在25 ℃下培养8 d后可使菌丝直径达49.44 mm。本研究为印度块菌利用菌丝代替子实体匀浆孢子悬浮液接种于宿主根系产生子实体提供了研究基础,可解决子实体匀浆孢子悬浮液的高成本、过程繁琐以及子实体匀浆孢子中其他真菌污染植物根系等问题。同时,如何将优化固体培养基上长出的印度块菌菌丝运用于后续的人工接种及栽培还需进一步研究。
参考文献:
BONITO GM, GRYGANSKYI AP, TRAPPE JM, et al., 2010. A global meta-analysis of Tuber ITS rDNA sequences:Species diversity, host association and long-distance dispersal [J]. Mol Ecol, 19(22): 4994-5008.
CAO JZ, WEI L, SU H, et al., 2011. Study on extraction and anti-oxidant activity of crude polvsaccharides from Tuber indicum [J]. J Shanxi Univ (Nat Sci Ed), 34 (1): 137-142. [曹晋忠, 魏磊, 苏红, 等, 2011. 印度块菌粗多糖的提取及抗氧化活性研究 [J]. 山西大学学报(自然科学版), 34(1): 137-142.]
CHEN J, GUO SX, LIU PG, 2011. Species recognition and cryptic species in the Tuber indicum complex [J]. PLoS ONE, 6(1): e14625.
CHEN WQ, DENG BW, CHEN YG, et al., 2005. Selection of liquid medium for schinophyllum commune by L9 (3-4) orthogonal design [J]. J Food Sci Biotechnol, 24 (4): 38-41. [陈文强, 邓百万, 陈永刚, 等, 2005. 用L9(3~4)正交试验筛选裂褶菌液体培养基 [J]. 食品与生物技术学报, 24(4): 38-41.]
CHEN WQ, ZHOU XW, DENG BW, 2002. A preliminary study on the selection of mother culture media of Agaricus blazei Mürrill [J]. Acta Edul Fung, 9(2): 31-34. [陈文强, 周选围, 邓百万, 2002. 姬松茸母种培养基筛选研究初报 [J]. 食用菌学报, 9(2): 31-34.]
DENG XJ, LIU JL, YAN XF, et al., 2019. Community composition of bacteria associated with ascocarps of Tuber indicum using traditional culture method and roche 454 high-throughput sequencing [J]. Biodivers Sci, 26(12): 1318-1324. [鄧晓娟, 刘建利, 闫兴富, 等, 2019. 用传统分离培养法和高通量测序技术分析印度块菌子囊果内细菌的群落结构 [J]. 生物多样性, 26(12): 1318-1324.]
DING HJ, 2013. Effects of calcium treatment on main components and physiological and biochemical indexes of potato during storage [D].Yinchuan: Ningxia University. [丁红瑾, 2013. 钙处理对贮藏期马铃薯主要成分及生理生化指标的影响 [D]. 银川:宁夏大学.]
GREGORY B, SMITH ME, MICHAEL N, et al., 2013. Historical biogeography and diversification of truffles in the Tuberaceae and their newly identified southern hemisphere sister lineage [J]. PLoS ONE, 8(1): e52765.
GUO S, LI Y, ZHAO ZL, et al., 2014. Research status, problems and prospects of truffles [J]. Edib Fung, 6(1): 4-6. [郭尚, 李渊, 赵照林, 等, 2014. 块菌的研究现状、问题及展望 [J]. 食用菌, 6(1): 4-6.]
HE MX, ZHANG CX, JI KP, et al., 2009. Screening of carbon and nitrogen sources and inorganic salts mycelium culture medium of Phlebopus portentosus [J]. J Yunnan Agric Univ (Nat Sci Ed), 24(5): 145-149. [何明霞, 张春霞, 纪开萍, 等, 2009. 暗褐网柄牛肝菌菌丝体培养基的碳源、氮源及无机盐的筛选研究 [J]. 云南农业大学学报(自然科学版), 24(5): 145-149.]
HE PX, XU Y, ZHANG CK, 2003. A study on assimilation of glucose and soluble starch of 8 mushrooms [J]. J Henan Inst Sci Technol(Nat Sci Ed), 31(3): 28-30. [何培新, 徐燕, 张长铠, 2003. 8种食用菌同化利用葡萄糖和可溶性淀粉的探讨 [J]. 河南科技学院学报(自然科学版), 31(3): 28-30.]
HU BF, YUAN XM, YU JY, et al., 2010. Successful introduced cultivation of Tuber indicum in Guizhou [J]. For By-Prod Spec Chin, (2): 1. [胡炳福, 远香美, 余金勇, 等, 2010. 印度块菌栽培在贵州首获成功 [J]. 中国林副特产, (2): 1.]
IOTTI M, PIATTONI F, LEONARDI P, et al., 2016. First evidence for truffle production from plants inoculated with mycelial pure cultures [J]. Mycorrhiza, 26(7): 793-798.
L JZ, RAN H, JIANG JC, et al., 2009. Nutrients and health value of potato [J]. Food Nutr Chin, (3): 53-54. [吕巨智, 染和, 姜建初, 2009. 马铃薯的营养成分及保健价值 [J]. 中国食物与营养, (3): 53-54.]
MA RS, FANG R, 2011. Isolation of Tricholoma mongolicum and test of mycelium growth [J]. J Shenyang Agric Univ, 42(1): 69-73. [马荣山, 方蕊, 2011. 草原白蘑菌种分离及菌丝体生长因子的筛选 [J]. 沈阳农业大学学报, 42(1): 69-73.]
MA XY, WANG GZ, GUO CJ, 2016. Screening of Tuber indicum liquid medium by orthogonal design [J]. Jiangsu Agric Sci, 44(3): 200-203. [马欣燕, 王国正, 郭成金, 2016. 正交试验设计法筛选印度块菌液体培养基 [J]. 江苏农业科学, 44(3): 200-203.]
NIU YR, WANG MH, ZHANG GQ, et al., 2013. ITS sequence analysis of strain obtained from wild Suillus granulatus fruit bodies and opitimization of selected parameters [J]. Acta Edul Fung, 20(4): 6-10. [牛玉蓉, 王明花, 张国庆, 等, 2013. 点柄粘盖牛肝菌菌种分子鉴定与最适培养条件研究 [J]. 食用菌学报, 20(4): 6-10.]
STREIBLOV E, GRYNDLEROV H, GRYNDLER M, 2012. Truffle brlé: An efficient fungal life strategy [J]. Fems Microbiol Ecol, 80(1): 1-8.
TAO K, LIU B, 1990. Ecological and nutritional value of Tuber sinense [J]. J Shanxi Univ (Nat Sci Ed), 13(3): 319-321. [陶恺, 刘波, 1990. 中国块菌的生态和营养价值 [J]. 山西大学学报(自然科学版), 13(3): 319-321.]
TEDERSOO L, MAY TW, SMITH ME, 2010. Ectomycorrhizal lifestyle in fungi: Global diversity, distribution, and evolution of phylogenetic lineages [J]. Mycorrhiza, 20(4): 217-263.
WANG SG, LIN XG, 2001. Effect of mycorrhiza on bioremediation of polluted soil [J]. Rural Eco-Environ, 17(1): 56-59. [王曙光, 林先贵, 2001. 菌根在污染土壤生物修复中的作用 [J]. 生态与农村环境学报, 17(1): 56-59.]
WANG XD, LIU Q, CAI H, et al., 2011. A study on the solid culture of termitomyces Albuminosus mycelium [J]. J Neijiang Norm Univ, 25(2): 460-461. [王小丹, 刘强, 蔡虹, 等, 2011. 鸡枞菌丝的固体培养研究 [J]. 内江师范学院学报, 25(2): 460-461.]
XU RY, QI ZG, JIA NB, et al., 2007. Study on the best stock culture media of three kinds of mushrooms [J]. J Hebei Agric Sci, 11(1): 23-24. [徐瑞雅, 齐志广, 贾耐兵, 等, 2007. 食用菌最佳母种培养基的筛选 [J]. 河北农业科学, 11(1): 23-24.]
ZHANG JP, LIU PG, 2015. Ecological features associated with Tuber sinoaestivum [J]. Acta Edul Fung, 22(1): 34-40. [張介平, 刘培贵, 2015. 中华夏块菌及其生态学研究 [J]. 食用菌学报, 22(1): 34-40.]
ZHOU JP, CHENG J, XU D, et al., 2017. Mycelium isolation and species identification of Panzhihua truffle [J]. J Panzhihua Univ, 34(2): 1-5. [周建平, 程君, 徐德, 等, 2017. 攀枝花块菌菌丝体的分离及种属鉴定 [J]. 攀枝花学院学报, 34(2): 1-5.]
(责任编辑 周翠鸣)
