行星保护中微生物快速检测技术研究进展
2021-09-13孙儒馨付玉明
孙儒馨,付玉明
(1. 北京航空航天大学 生物与医学工程学院,北京 100191; 2. 北京航空航天大学 生物医学工程高精尖创新中心,北京 100083)
0 引 言
自人类开始探索太阳系以来,可能存在生命的行星一直是科学家们的重点关注对象.而对于外层空间环境而言,近年来人类频繁的航天探索活动导致其发生了诸多难以避免且不可逆的变化,可能会给地外行星地质和地外生命起源等研究带来不可预知的影响.在采样返回时,也存在外太空物质威胁地球环境和人类安全的风险.行星保护[1]旨在规范和约束各国航天机构,确保执行行星保护项目的航天器在发射和返回过程中,能够有效避免正向污染和逆向污染.因此,航天器表面微生物检测对行星保护在保护地球生物安全和保证地外生命起源探索方面具有重要意义[2-3].部分欧美国家已开展行星保护工作近六十年,积累了大量的工作经验,具有较高的技术水平和相对完整的技术体系.相较于欧美等国,中国行星保护技术研究目前尚处于起步阶段,而随着中国深空探测事业的不断发展和火星探测任务的实施,发展中国的行星保护微生物检测技术体系,已成为中国履行国际行星保护公约的迫切需求.
根据空间研究委员会(Committee on Space Research,COSPAR)出台的行星保护任务类别和要求[4],各国航天机构和组织必须在生产、运输及发射等阶段对航天器进行微生物检测,以确保达到行星保护相关要求.早在上世纪六十年代美国Ranger 3号[5]项目伊始,便有科学家提出对航天器进行清洁和微生物检测的建议并得以实施;在Viking program[6]任务中,更是对航天器进行了超过6 000次的微生物采样检测;欧洲空间标准化合作组织(European Cooperation for Space Standardization,ECSS)在2006年明确了防止太阳系内目标天体与地月系之间交叉污染的规范[7],规定了航天器的可携带微生物量和检测方法;在2010年,美国国家航空航天局(National Aeronautics and Space Administration,NASA)出台了执行行星保护政策的航天硬件微生物检测手册[8],确立了以培养方法为主、T-ATP和LAL检测为辅的行星保护微生物检测技术体系.囿于培养法微生物检测时间限制,难以实时得到航天器表面微生物信息;同时,实验室可培养微生物只占到微生物总数的0.1%~10%[9],会严重低估航天器表面微生物量.因此,发展不依赖于培养的微生物快速检测技术,形成完备的航天器微生物快速检测技术体系,满足不同航天发射任务的行星保护需求,是当前行星保护微生物检测技术的重要发展方向.
本文综述了目前行星保护中使用的微生物快速检测方法和有望应用于行星保护的微生物快速检测方法,对各方法的研究现状和存在的不足进行了分析,并在此基础上,提出中国行星保护微生物快速检测技术体系的设想和建议.
1 现行行星保护微生物快速检测方法
1.1 ATP荧光检测法
基于三磷酸腺苷(Adenosine triphosphate,ATP)生物发光的微生物检测在20世纪60年代初开始流行,最近的创新将这项技术推向了最先进的微生物检测前沿.ATP荧光检测法基于萤火虫荧光发光原理,使用含有荧光素和荧光素酶的生物发光试剂,在ATP供能和荧光素酶(在镁离子和氧分子存在的条件下)催化下,最终生成氧化荧光素、二氧化碳并发出荧光,是通过检测荧光强度确定ATP含量对微生物进行定量的方法.目前,科研人员可以严格定量给定样本的活微生物(胞内ATP)和总微生物负荷(Total-ATP),将微生物直接裂解可测定总微生物负荷,裂解前加入ATP消除剂可测定活微生物负荷.
根据NASA标准分析实验,James等[10]对ATP检测方法进行了标定,并提出了适用于行星保护的检测标准.为满足执行行星保护任务的航天器在组装、运输和测试过程中大量的检测操作,密理博(Millipore)公司为NASA开发了一款快速微生物检测系统(Rapid microbial detection system,RMDS)[11],结合了膜过滤、ATP生物发光和基于光子检测的图像检测和分析方法.该技术已被用于快速量化(可检测只含有一个菌落的样品)微生物污染,得到的结果与基于培养的方法具有极好的相关性.为了实现快速的内生孢子测定[12],行星保护官在此项技术中增添了80℃热休克15分钟处理的操作,去除非孢子态微生物,以确保温育过程中长出的菌落均来源于孢子.通过将ATP检测与简单的热休克样品制备策略相结合,达到快速检测产孢微生物的目的,如此,可实现常规微生物检测和微生物孢子检测.经测试验证,选取Checklite HS试剂作为RDMS荧光素酶制剂,将RMDS检测时间由18~24小时缩短至5小时,实验检测出7种分离自洁净室的芽孢杆菌.
ATP荧光检测法的优势在于检测全程仅需几分钟,可直接读取结果实现即时测定,但因其只能间接反应微生物的含量,所以更多情况下是用于反映被检测物体的污染情况,而无法得到菌落结构信息.因此,多在航天器硬件的最终检测之前使用该检测方法对待检测的硬件进行初筛,以确定是否存在微生物污染,在检测和报告航天器表面最终微生物污染结果之前,用于快速评估是否需要对航天器表面进行清洁或其他处理.
1.2 LPS鲎试剂检测法
革兰氏阴性菌外膜上有丰富的脂多糖[13](Lipopolysaccharide,LPS)存在,科学家们研究发现鲎遭受革兰氏阴性菌侵染时,其变形细胞会启动高度特异的酶级联反应,这种级联反应由革兰氏阴性细菌外膜中的LPS引起.因此,科学家们依据此现象提出了鲎试剂检测法(Limulus amebocyte lysate,LAL)[14]来检测LPS.其反应原理为:鲎的血液内含有一种变形细胞,胞浆内存在着大量的致密颗粒,包含凝血酶、因子C、因子B和凝血酶原.LPS与鲎试剂接触后可激活因子C,激活的因子C又可激活因子B;另外,β-葡聚糖能够激活因子G,激活的因子B或G可激活凝血酶原使之转变为凝血酶,凝血酶使可溶性的纤维蛋白原转化为纤维蛋白,令鲎试剂变为凝胶状态[15-16],如图1所示.同时,凝血酶对鲎三肽具有酰氨酶活性,可使对硝基苯胺游离而发生显色反应,以颜色变化确定微生物数量.鲎试剂试验可分别进行定性和定量检测,具体可分为凝胶法、动态显色法、终点显色法、动态浊度法和终点浊度法,此方法也被美国测试与材料学会用作E2144-01方法[17]的基础.目前,通常使用商用试剂盒(Charles River Laboratories,Wilmington,MA)进行快速便捷的检测.
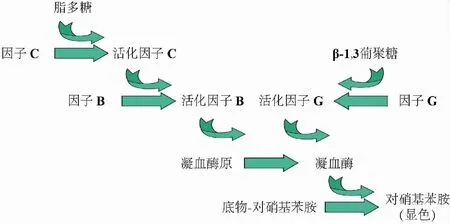
图1 LOCAD-PTS酶级联反应原理图
Maule等[18]依据此原理提出了LOCAD-PTS(Lab-On-a-Chip Application Development Portable Test System)装置,已用于国际空间站的在轨检测.设备[19-20]由读取器、反应盒、拭子装置和配件组成.LOCAD-PTS的读取器包含了手持的综合分光光度计、加热器和泵,内置电子器件和软件用于反应盒内各项反应的控制.反应盒嵌于读取器中,内置有程式化软件,用于操控凹槽内的液体流动.拭子装置由手持吸液管和擦拭装置组成,可完成采样及样品与反应试剂混合.样品液与鲎试剂发生反应,颜色变化的程度取决于微生物的数量.
此方法操作简单、快捷经济,灵敏度较高,检测范围较大 (0.006~300 EU/mL) ,已被NASA认可引入行星保护微生物检测补充方法.但是,实验证明pH值是影响鲎试剂试验的重要因素,过酸或过碱都会对LPS的检测造成抑制而出现假阴性;多种金属离子、反应条件、盐浓度过高、洗涤剂或其他有机物的存在和鲎试剂溶解时间等因素则会导致假阳性结果的出现.LPS仅存在于革兰氏阴性菌中,导致该方法难以与革兰氏阳性微生物孢子倒板检测法相联系,因此,该方法多用作航天器硬件整体清洁度的指示器.
1.3 AMP检测法
相较于现有的微生物检测方法,单磷酸腺苷(Adenosine monophosphate,AMP)检测方法[21]不涉及培养过程,可以实现快速检测的目的,目前还未有相关成型设备的报道.该方法可用于微生物孢子检测,原因在于处于休眠体状态的孢子代谢率极低,只含有极其微量的ATP[22],直接使用ATP检测方法难以实现检测目的,而研究发现[23]孢子中含有大量AMP,因此,可作为检测微生物孢子的生物标志物,其检测过程如图2所示.将样品制备为悬浮液,第一次热休克时保持温度为80℃,热激15分钟,杀死未形成孢子的微生物和营养细胞.悬浮液低加速度离心洗涤后重悬于含有磷酸腺苷脱氨酶溶液中,去除细胞外ATP和AMP.对溶液再次进行低加速度离心洗涤后重悬于蒸馏水中.第二次热休克时保持温度为100℃,持续10分钟,使AMP从孢子中完全释放.使用市售的含有丙酮酸激酶和正磷酸二激酶的生物发光剂处理样品,从而产生与通过氧化磷酸化从AMP转化而来的ATP浓度成比例的荧光.通过使用标准实验室发光计来测量发光即可得到样品中的微生物数量信息.在针对八种芽孢杆菌的实验[24]中,该方法能够检测到悬浮液中的孢子,且检测下限可达到亚飞摩尔水平,对应于每个样品含有不超过100个孢子.
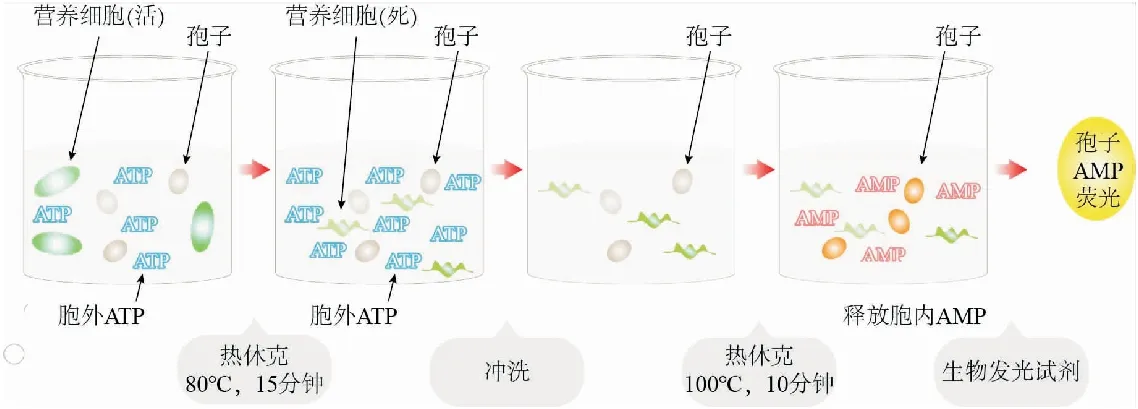
图2 细菌孢子快速检测程序
此种方法在2009年1月刊登于《NASA技术简报》[25]被用作行星保护标准微生物检测方法的补充,与ATP荧光检测法相比只多了两步热激和酶处理过程,便可以实现对微生物孢子的快速检测,可使用ATP荧光检测法的相应设备,具备较好的兼容性.其缺点与ATP检测法相近,因无法增殖的死亡细菌也含有AMP,会导致在检测数值上高于培养法[21, 25],且无法进行分类鉴定.因此,AMP检测法被NASA应用于评估环境样本的微生物孢子总数.
1.4 PMA联动荧光检测法
PMA联动荧光检测法[26]由叠氮溴化丙锭(Propidium monoazide,PMA)处理和荧光原位杂交[27](Fluorescence in situ hybridization,FISH)显微技术结合而成.PMA可通过受损的膜进入细胞内,因而能够区分活菌细胞和死菌细胞,PMA经可见光激活后可插入并最终与DNA共价键合.共价结合的DNA不会参与后续的分子操作和分析.因此,可用适当浓度的PMA处理微生物样品,并在进行总基因组DNA提取之前暴露于可见光,从而得到仅包含活菌DNA的提取物.PMA联动荧光检测法的基本原理是:PMA由受损的膜结构进入死细胞和孢子并插入到DNA当中.PMA具有光活性叠氮化物基团,暴露于亮白光时能够与DNA共价交联.这种光活化效应会导致PMA-DNA复合物的形成,使得死菌细胞和孢子中的DNA在FISH测定过程中无法进行杂交反应,因而不会检测到死菌细胞和孢子.
该技术首次发表在2012年9月的《NASA技术简报》上[28],被NASA用作行星保护微生物检测补充方法,其新颖之处在于能够实现微生物细胞和孢子的可视化,通过特定手段和化学预处理,可检测到样品中无法培养的微生物.PMA仅能进入热灭活的孢子,从而排除了FISH分析时其对后续杂交反应的影响.这种PMA-FISH结合的方法是在航天器相关环境中检测内生孢子的有力工具,囿于行星保护对检测仪器体积和检测的要求,该方法目前仅应用于地面检测,NASA正在开发适用于行星保护的小型PMA联动荧光检测仪.
1.5 MALDI-TOF质谱检测法
MALDI-TOF MS(Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry)[29]作为一种快速、高通量的微生物鉴定技术已得到广泛应用[30].MALDI是用激光照射样品与基质形成的共结晶薄膜,基质从激光中吸收能量传递给生物分子使其电离.TOF能够检测离子在电场作用下加速飞行到达检测器的时间,测定离子的质荷比(Mass charge ratio,M/Z).MALDI-TOF质谱检测法与16S rRNA基因测序方法相比具有更高的准确性,有研究发现沙福芽孢杆菌(Bacillussafensis)、短小芽孢杆菌(Bacilluspumilus)、漳州芽孢杆菌(Bacilluszhangzhouensis)和澳大利亚芽孢杆菌(Bacillusaustralimaris)在16S rRNA序列中共有>99.9%的序列相似性,但是它们的整个基因组DNA序列仅具有54%~66%的同源性[31].又如维罗纳气单胞菌(Aeromonasveronii)基因组中包含6个不同的16S基因拷贝,每个拷贝的差异最大为1.5%[32-33],可能会产生不同的检测结果,从而使16S rRNA序列鉴定结果出现错误.而MALDI-TOF MS能够获取较大范围蛋白质的独特DNA分子标记,能够清楚地区分两个密切相关物种之间的差异.因为该技术依赖于质谱数据库中的参考菌株[34],在实施基于MALDI-TOF MS的微生物鉴定研究中,多人使用16S rRNA技术验证了自建数据库的准确性[35].
为了完成行星保护的检测要求,NASA喷气推进实验室(Jet Propulsion Laboratory,JPL)收集了以下任务的分离菌株:Viking(1 296个)、Mars Odyssey(90个)、Phoenix(209个)、Mars Pathfinder(47个)、Mars Exploration Rovers(395个)、Mars Science Laboratory(1 123个)建立质谱数据库.该MALDI-TOF MS数据库用于实时、准确和高通量鉴定航天器装配洁净室中的微生物分离物.JPL结合使用MALDI-TOF MS和16S rRNA测序方法,对从凤凰号火星着陆器收集到的微生物分离株[36]进行了鉴定.使用MALDI-TOF MS鉴定了637种分离株,发现在鉴别出的438种微生物中有320个(73%)分离株属于成孢属.使用16S rRNA测序方法无法使用MALDI-TOF MS方法鉴定的样品,在用16S rRNA鉴定的405个分离株中,有312个(77%)分离株被鉴定为成孢属.两种方法共鉴定出626个分离株,有460(74%)个分离株为成孢属.
此方法在提出伊始,其检测准确度受限于数据库,随着JPL不断的从航天器和相关洁净室环境中获得微生物分离株对定制数据库[37]进行持续更新,该技术所能够鉴定出的物种的准确性大大提高,但是该方法所使用的整个设备体积较大,现有技术难以实现仪器的小型化,因此,MALDI-TOF质谱检测法目前多用于航天器硬件和相关表面的微生物检测,欲实现在轨应用还需进一步发展.
1.6 PCR检测法
PCR(Polymerase Chain Reaction,PCR)方法可直接从样品中提取DNA,无需培养即可用于分子微生物多样性分析,使用自动IG Autolyser DNA提取器(Instant Genetics,Menlo Park,CA)对样本进行DNA提取.按照规定的PCR条件和克隆程序,使用相应引物对待测样品进行PCR扩增,根据相似性对带型进行分组,并对每个不同带型组的代表性成员进行双向测序.通过将单个16S[38]或18S rDNA序列与NCBI数据库中的序列进行比较,使用PAUP软件构建系统进化树来确定微生物的系统发育关系,得到所需的微生物信息.
荧光定量实时PCR(Quantitative real time PCR,qRT-PCR)能够进行准确、快速的核酸定量分析,其PCR扩增原理与普通PCR扩增原理相同,只是在PCR扩增时加入利用同位素、荧光素等进行标记的引物,使用引物和荧光探针同时与模板特异性结合扩增,扩增的结果通过荧光信号采集系统实时采集信号,连接输送到计算机分析处理系统得出量化的结果实时输出.它主要包括TaqManTM探针法和SYBR Green Ⅰ染料法.Cremonesi[39]使用TaqManTM探针法针对蜡样芽孢杆菌和其他微生物的特定基因进行探针设计,实现同时对23种细菌进行鉴定.Forghani等[40]使用SYBR Green Ⅰ染料法对蜡样芽孢杆菌(Bacilluscereus)、单核细胞增生李斯特菌(Listeriamonocytogenes)和金黄色葡萄球菌(Staphylococcusaureus)进行检测.因此,qPCR技术[41]也被作为重要方法引入到了行星保护中,用于微生物负荷分析[42],并且采用16S rRNA qPCR和16S rRNA PMA-qPCR技术进行航天器总微生物和活微生物检测[20].
2006年欧洲航天局(European Space Agency,ESA)资助的SAMPLE实验项目,使用Q-PCR法和FISH技术对国际空间站样本进行检测,建立起适于空间应用的采样和DNA分离技术.Vesper等[43]使用了qPCR方法对国际空间站样本进行了产毒青霉菌的检测,指出了qPCR技术的在轨应用前景.2017年,英国牛津纳米孔技术公司研制的手持式DNA测序仪MinION[44]搭乘ATK OA-7天鹅座补给飞船运至国际空间站进行DNA测序.NASA开发了一套分子生物学实验系统Wetlab-2,包括液体RNA样本制备模块、流体传输装置、一体式冻干PCR分析仪、离心机和实时PCR热循环仪,可用于处理微重力条件下的生物样本,实现在轨实时基因表达分析.
PCR技术使用样品量少,可对样品进行定性和定量分析,既可得到样品的菌落结构信息,又可得到样品的微生物数量信息,但是对操作过程的要求较高,在样品DNA纯化过程中出现的扩增反应抑制物以及DNA提取的随机误差,会出现假阴性结果;而扩增产物的污染又会引起假阳性结果.相比来说,qPCR能够实现全封闭反应,减少了产物污染,具有特异性强、灵敏度高的特性,能够快速准确的定量极微量的DNA,但由于荧光探针的种类及检测光源的局限性,又相对的限制了该方法的应用能力.
2 潜在的行星保护微生物检测技术
目前,除去上述提到的已应用于行星保护的微生物检测方法、补充方法和检测装置外,DPA检测法、拉曼光谱法和基于微流控技术的微生物检测方法等技术也有望引入行星保护微生物检测技术,以期更为快速准确地得到航天器表面微生物污染情况.表1对文中所提到的已有成品设备或可实现设备小型化的微生物检测方法的检测对象、检测时间、技术特点以及设备小型化可能与否进行了比较.

表1 微生物检测方法特点比较表
ATP荧光检测法具有操作简单、检测时间短的优点,可以实现现场实时检测得到微生物总量.目前,市面上有多种手持式ATP检测仪可供选择,配合专用试剂盒可测得胞内ATP含量信息,得到样品中的菌落数信息;LPS检测法以LPS为生物标志物,可获取微生物总量信息,因LPS仅存在于革兰氏阴性菌中,而无法体现待测样中的革兰氏阳性菌的数量信息,LOCAD-PTS装置因其适用于在轨检测的优点,被NASA应用于国际空间站在轨检测;PCR检测法随着近年来PCR技术的发展和第四代纳米孔测序技术的提出,已具备了检测结果准确可靠、通量高、检测设备小型化和满足地面与在轨检测,以及可进行菌种鉴别的优点,使其成为今后行星保护微生物快速检测技术的重点发展方向;拉曼光谱法因实现了设备小型化,也在行星保护微生物检测方面表现出极大优势,具有检测下限低、分辨率高和可实现无损检测的优点,通过光谱结果与数据库进行比对,即可获得微生物种类信息.
2.1 DPA检测法
在执行行星保护时,微生物会通过产生孢子来抵抗消杀操作造成的恶劣条件,吡啶二羧酸(Pyridine-2,6-dicarboxylic acid,DPA)是孢子的主要成分,占到孢子干重的15%[45].因此,DPA可作为孢子的生物标志物.目前,已发表了多种检测DPA的方法,例如:比色法[46]、表面增强拉曼光谱法[47]、电化学检测法[48]和荧光检测法[49].其中,荧光检测法具有价格便宜、灵敏度高、检测速度快等优点.基于稀土元素的DPA荧光检测因Ln3+-DPA络合物具有尖锐的窄带发射、较大的斯托克斯位移和长寿命的激发态而受到普遍欢迎.DPA具有三齿配体结构,可与镧系金属铽和铕络合形成配合物,在DPA最大紫外吸收波长(290 nm)激发下,分别在544 nm和615 nm处产生强烈的发光现象,以检测荧光强度来对孢子中的DPA进行定量,进而确定微生物孢子量.Donmez等[50]将化学性质稳定、光稳定性高、水溶性好、易表面功能化的金纳米颗粒应用于生物分子检测的荧光传感体系[51],检测限可达到0.1 mM.Liang等[52]选用了镧系金属铕为发光离子,使用环己二胺四乙酸(Trans-1,2-Diaminocyclohexane-N,N,N’,N’-tetraacetic acid hydrate,CyDTA)为螯合剂制备荧光络合物,检出限低至0.3 nM,可检测到104个孢子,低于炭疽杆菌孢子的感染量.
DPA检测法能够进行高灵敏度的快速检测,方便研究人员得到待检测样品的微生物孢子量信息.作为一种间接检测方法,其存在无法鉴别孢子种类的不足,也有研究发现DPA性质稳定,经过高温和酸碱氧化剂等处理之后仍能稳定存在. 因此,如何消除已无繁殖能力孢子的DPA,使结果免于残留DPA干扰是该方法今后改进的重要方向.
2.2 拉曼光谱法
拉曼光谱技术具备多个优点:无损检测、高分辨、无需培养、检测速度快等,已经成为一种行之有效的微生物检测方法.Bronk[53]首次给出了微生物的SERS谱图,证明了革兰氏阴性菌与革兰氏阳性菌表面的SERS信号存在差异,由此开启了拉曼光谱技术检测微生物的序幕.根据不同种属微生物的表面蛋白、脂类以及糖链分子因基因不同而存在差异,在拉曼光谱不同位置显示不同强度信号的特点,科学家们使用拉曼光谱法描述微生物之间的差异,实现微生物原位检测和鉴别的目的.Dekter[54]发现在1 155 cm-1~1 157 cm-1和1 516 cm-1~1 522 cm-1两个区域的类胡萝卜素多烯链有较强拉曼峰,且在革兰氏阴性菌和革兰氏阳性菌中存在明显差异.在785 nm激发光的拉曼光谱中,革兰氏阴性细菌在1 157 cm-1和1 521 cm-1处的拉曼光谱强度普遍强于革兰氏阳性细菌.通过实验对200个样本进行快速鉴别,其准确率达到92%.有研究人员设计并制备了拉曼沉默区探针,能够提高拉曼信号的信噪比[55-56].SERS探针由3部分构成:SERS基底(通常为AuNPs[57],AgNPs[58]和Au-AgNPs[59])、拉曼信号分子和识别分子.目前,4-巯基苯甲酸(4-MBA)[60]、4-氨基硫酚(4-ATP)[61]、罗丹明6G(Rh6))[62]、4-巯基吡啶(4-MPY)[63]和5,5-二硫双-2-硝基苯甲酸(DTNB)[64]已被成功应用到基于SERS的微生物检测中.金纳米粒子表面结合核酸适配体[65]探针和金包覆磁性纳米粒子[66]制备成的基底可使检测限达到3~10 cfu / mL.
拉曼光谱相比于荧光分析方法,可实现无损检测,可对微生物的部分生理过程进行监测.随着拉曼检测设备的小型化,手持拉曼仪被应用于微生物检测,通过与微生物拉曼光谱数据库中的结果对比即可得到微生物的数量和种属结果,最终实现简单、快速的微生物检测.
2.3 基于微流控技术的微生物检测法
流式细胞术(Flow cytometer,FCM)是一种简单、快速和准确的方法,其中颗粒开始保持在液体流动状态中,然后逐个连续地通过激发光源,最后根据记录下来的发射信号分析单个颗粒的性质[67-68].流式细胞仪是包含液流系统、光学系统、检测系统和分析系统,可对细胞进行分选和自动分析的设备.样品颗粒在液体中保持着流动状态,连续地通过激发光源,根据记录的发射信号可分析单个颗粒的性质,具有灵敏度高、检测快速的特点.2011年,INO公司为加拿大太空局(Canadian Space Agency,CSA)研制了一款基于微流技术的小型流式细胞仪[69](Miniaturized flow cytometer,MFCM),主要用于血液和其他体液样本的生理指标检测,但未见该技术和设备应用于微生物检测的报道.
微流控技术结合了微机电系统、纳米技术和分子生物学技术,能够在微小空间内对样品进行预处理、反应或分析,具备集成化和检测设备小型化的功能[70].在基片上构建微流道、微泵、微反应器和微混合器等结构,可实现微生物样品制备、微流体控制、生化反应和分析等操作,在微芯片上实现实验室所具备的功能[71],并快速的得到检测结果[72].
Zhe等[73]设计微流控芯片来检测细菌DNA,芯片基材选用聚二甲基硅氧烷(Polydimethylsiloxane,PDMS),包括一个固相萃取室、两个独立通道和一个多环介导等温扩增室,成功地在2 h内检测出了3种细菌,检出限为102CFU/100 μL;Wang等[74]在多通道微流控芯片系统中,使用CdSe/ZnS量子点标记鼠伤寒沙门氏菌,提高了检测灵敏度,检出限达到37 CFU/mL,并成功应用于猪肉样品的鼠伤寒沙门氏菌检测;Rafal等[75]利用微流控芯片进行DNA/RNA的提取和实时荧光PCR检测,设计的多个微腔满足多个样品同时检测的需求,应用新的光学检测方法成功应用于沙门氏菌、霍乱弧菌等致病菌检测;2011年,北京理工大学团队研制出微流控芯片基因扩增装置[76],可实现快速的温度循环以缩短扩增时间,可实现温度的精确控制以提高扩增效率,可降低试剂和样品的消耗,可减少干扰和交叉污染.装置设有微流控芯片、步进电机、转盘、温控器和加样模块.该装置于2011年成功搭载神舟八号,圆满完成了在轨条件下自动进行人类基因微流控芯片扩增实验,实现了中国微流控芯片技术在太空领域的应用.
微流控芯片具有便捷、高效、高通量等优点,以微流控技术、微机电技术、纳米技术与分子生物学相结合的检测设备被大量应用,为行星保护微生物检测提供了新思路,也为在轨实时检测技术的发展提供理论基础和技术支持,是今后行星保护快速微生物检测方法的重要发展方向.
3 中国行星保护微生物检测技术体系设想
对于航天器组装环境中的微生物检测,俄罗斯、美国和欧洲部分国家等已经开展了多项研究,形成了较为完善的体系,并且在微生物的快速检测技术和设备方面也取得了较大的进展.但是从航天器在轨微生物检测和地面检测的经验来看,针对极端环境中存在的微生物检测仍然存在灵敏度不足、耗时长、无法鉴别微生物种类等缺点.经典的微生物检测技术还是以平板培养法为主,ATP检测法、LAL检测法、PCR方法等都只作为行星保护微生物检测方法的补充.随着微流控技术日益成熟,及其在快速生物分子检测[77-78]的应用日渐增多,将微流控技术与传统的ATP生物荧光和DPA[79- 80]检测等技术结合,会进一步提高微生物检测技术的灵敏度,建立航天器表面微生物拉曼光谱数据库,使用便携式拉曼检测仪进行微生物快速检测等方法都是今后快速微生物检测技术发展的重要方向.随着检测设备的集成化和便携化,一般性的微生物检测方法也有望应用于行星保护微生物检测过程.
鉴于此,对中国行星保护微生物检测技术体系的建立提出以下设想:
1) 在航天器零部件早期设计加工环节开展微生物检测,将行星保护微生物负荷要求纳入考虑范围,避免在后续组装过程中出现死角,保证后续环节检测结果的有效性,保障行星保护任务圆满完成.
2) 行星保护微生物检测技术体系的建立,不仅包括对现有检测技术的应用场景和应用参数的确定,还应包括对检测技术与航天器材料耦合特性的考量.现有的微生物快速检测技术无法同时兼顾快速、高精度、高灵敏度和微生物种类鉴别,因此,应针对不同的检测目的和要求,以及不同航天器材料选取对应的检测方法.
3) 建立完备的行星保护微生物检测技术体系,应兼顾航天器在转运、组装等各阶段所处环境的微生物群落结构特征和具体消杀操作对航天器表面微生物结构的影响,有针对性地选择适宜的微生物检测手段,保证检测的有效性,减少不必要操作所造成的人力物力浪费.
4)在建立中国行星保护微生物检测技术体系的过程中,除借鉴他国已有经验之外,还应利用食品卫生等行业现有的微生物快速检测技术,实现中国突破.
4 结 语
随着我国载人航天事业的逐步推进,为更好地完成行星保护正向防护过程中的微生物快速检测,我国相关单位对微生物快速检测技术应用和设备制造的要求逐渐提高,因此,提出中国航天器微生物检测技术体系和技术标准,是今后的重点研究方向.目前,微生物检测技术主要采用常规培养与快速检测相结合的方式.常规培养方法具有很大的时间滞后性,又因绝大多数微生物不可培养,难以获得环境中全部的微生物信息,且会增大二次污染风险;微生物快速检测方法具有灵敏度高,检测速度快的特点,通过与常规培养方法相结合,可达到理想效果.
