高脂饲养C57BL/6J小鼠肾周脂肪组织炎性反应的评估
2021-09-13李梓玉
杨 永,李梓玉,杨 伟,刘 勇,2*
(1.西南医科大学附属医院 病理科, 四川 泸州 646000; 2.核医学与分子影像四川省重点实验室,四川 泸州 646000)
随着现代人的生活方式转变以及生活水平的提高,肥胖人群逐年增多,肥胖的危害性日益凸显,既往文献报道,肥胖通常伴随低度慢性炎性反应[1]。肥胖所导致的机体多种代谢异常,包括胰岛素抵抗、脂代谢紊乱、糖代谢紊乱改变等与慢性炎性反应密切相关[2]。
巨噬细胞是分布于机体多种组织的一种重要免疫细胞。在适当的刺激下,巨噬细胞被激活为一种炎症状态,可以大致分为M1型和M2型两类,两者在功能和标志物等方面具有显著差异。M1型表达CD11c,M2型表达CD206,M1型响应Th1型细胞因子呈促炎的表型,释放IL-6、IL-1β等促炎性因子。M2型响应Th2型细胞因子呈抗炎的表型,释放IL-4、IL-10、IL-13、TGF-β1、Fn1等抗炎性因子。因此促进M1型向M2型转化,可以达到减轻脂肪组织炎性反应并改善脂肪组织功能障碍的目的,肥胖引起的脂肪组织炎性反应浸润的炎细胞以M1型巨噬细胞为主,肥胖时脂肪组织功能失调,导致脂肪组织内部缺氧继而发生坏死,能进一步吸引巨噬细胞聚集,促进脂肪组织功能失调和炎性反应之间的恶性循环[3-4]。脂肪组织巨噬细胞(adipose tissue macrophages,ATMs)的聚集、蓄积并在脂肪组织局部原位增殖等是慢性炎性反应相关肥胖和机体多种代谢性疾病的主要关键病因。本研究采用高脂饲养(high-fat diet, HFD)的C57BL/6J肥胖小鼠,检测其肾周脂肪组织炎性因子及炎细胞浸润情况,评估本实验所造的肥胖相关肾病模型肾周脂肪组织是否存在炎性反应。
1 材料与方法
1.1 材料
1.1.2 主要试剂:CD206、TGF-β1、Fn1、IL-10单克隆抗体(厦门慧嘉生物科技有限公司);TNF-α、IL-1β、CD11c、MCP-1单克隆抗体和F4/80单克隆抗体(Abcam公司)。
1.2 方法
1.2.1 小鼠的分组及处理:将小鼠随机分为对照组(control组)及高脂饲养组(HFD组),每组6只,对照组饲喂正常饲料(脂肪14%,蛋白质26%,碳水化合物60%),高脂饲养组在适应性喂食正常饲料1周后接受连续14周的高脂饲料(脂肪45%,蛋白质20%,碳水化合物35%)饲养(D12451; Research Diet,New Brunswick,NJ)。14周末处死小鼠,剥离双侧肾脏及肾周脂肪。
1.2.2 用RT-qPCR检测肾周脂肪组织中TNF-α、CD11c、IL-1β、MCP-1、IL-10、TGF-β1、CD206和Fn1 mRNA的表达量:收集肾周脂肪组织,浸泡在RNA later中,首先进行肾周脂肪组织总RNA抽提:从RNA later中取出肾周脂肪组织,4 ℃下充分匀浆,吸取上清,移入不含RNA酶的离心管内,加入氯仿200 μL,经过15 s剧烈振荡后,放在冰上静置2 min,经12 000×g离心15 min,将离心后的上清液转入新的无RNA酶离心管,加异丙醇500 μL,充分混匀,静置10 min,12 000×g离心10 min,弃上清,用75%乙醇1 mL洗涤,再经过7 500×g心5 min,弃上清;用100 μL RNase-Free 水溶解即为提取的总RNA。立即进行后续的反转录反应。
1.2.3 免疫组织化学检测肾周脂肪及肾实质F4/80、CD68和LCA的表达:制作白片,脱蜡至水;二甲苯Ⅰ、II处理后,梯度乙醇脱水各5 min;抗原修复:2% EDTA修复液(pH=9.0)进行高压修复;室温下3%甲醇浸泡;再分别滴加一抗和第二抗,分别在27 ℃孵育60 min、30 min;DAB显色,苏木素复染;0.1%稀盐酸分化,饱和碳酸锂反蓝;显微镜下观察并采集图片。运用Image-Pro Plus 6.0彩色图像分析软件进行定量分析:选取切片中棕黃色阳性染色区域,分析各视野下阳性吸光度(intensive absorbance,IA)及阳性面积(area),计算平均吸光度(IA/area×100%)。
1.3 统计学分析

2 结果
2.1 肾周脂肪组织巨噬细胞极化表型
与对照组相比,高脂饲养组肾周脂肪组织TNF-α、CD11C、IL-1β、MCP-1基因的mRNA表达水平上调(P<0.05)(图1)。
2.2 肾周围脂肪组织及肾脏实质内ATMs及炎细胞
肾周脂肪组织内出现较多量的以ATMs浸润为主的炎细胞,与对照组相比,高脂饲养组肾周脂肪巨噬细胞标志物F4/80, CD68及炎细胞广谱标志物LCA的表达均呈高表达(P<0.05)(图2~4,表1)。
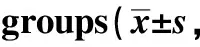
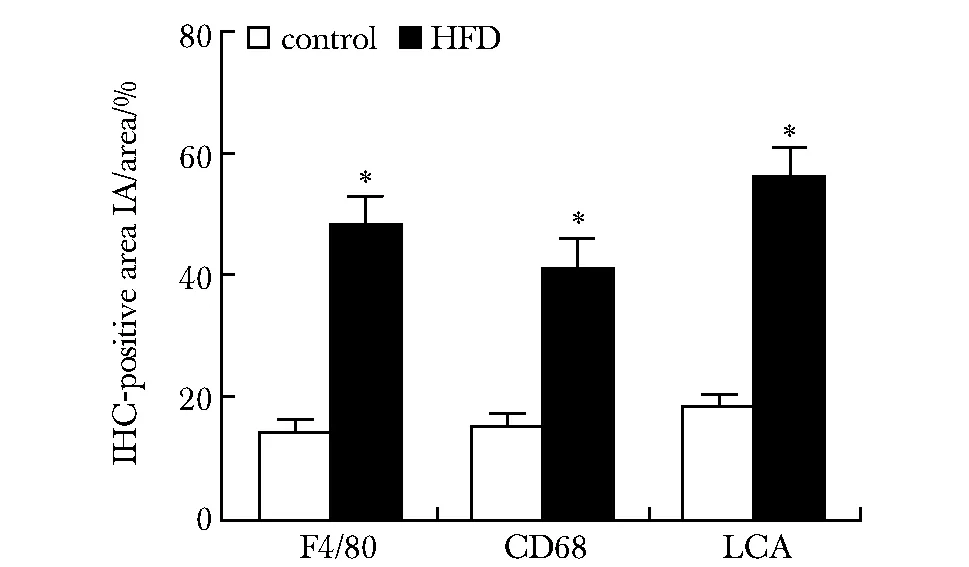
表1 两组小鼠肾周脂肪组织中F4/80、CD68和LCA蛋白免疫组化平均吸光度值比较

*P<0.05 compared with control group图1 两组小鼠肾周脂肪组织各炎性因子mRNA的相对表达量比较
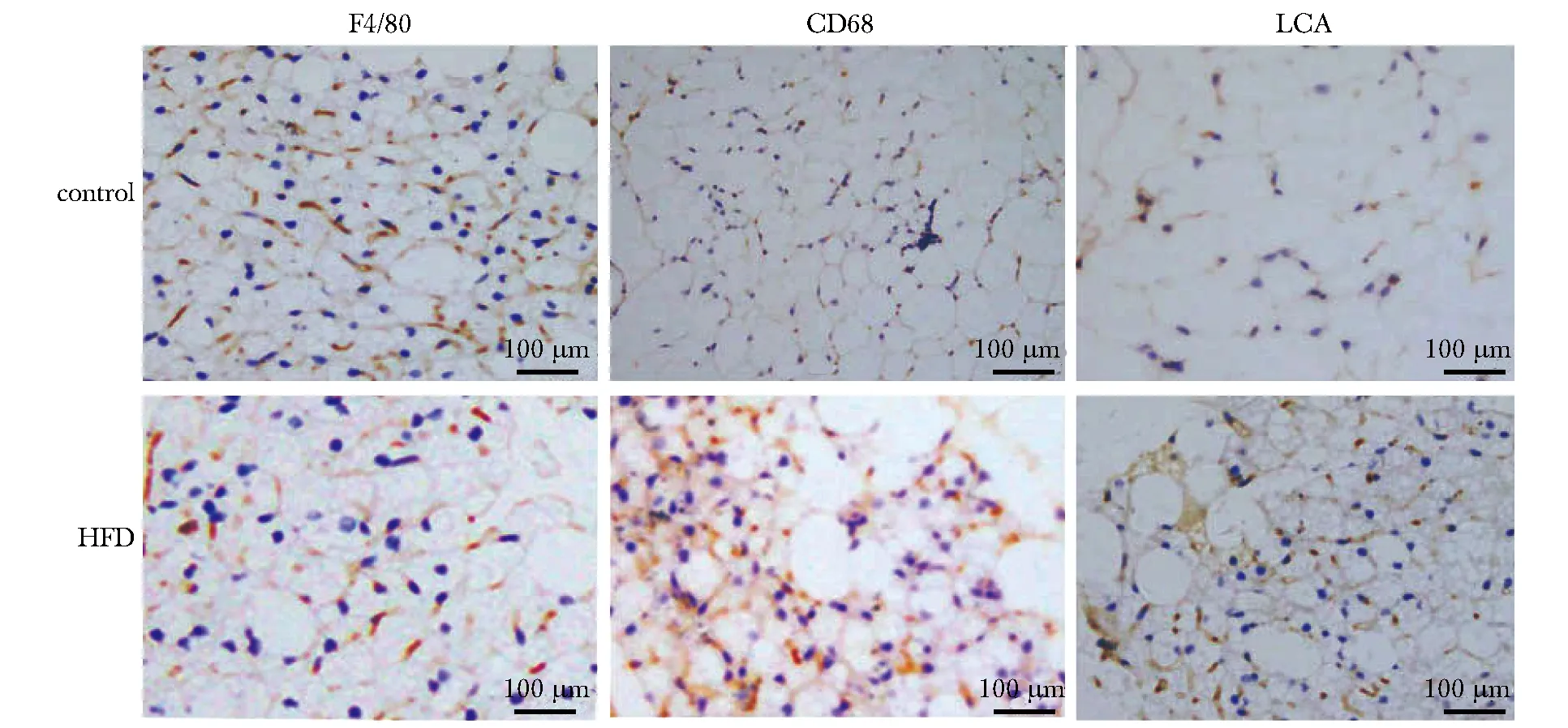
图2 免疫组化显示两组小鼠肾周脂肪组织F4/80、CD68和LCA蛋白的表达
3 讨论
全球的肥胖人口明显增加使人类健康面临极大的问题,给全球公共卫生领域带来巨大挑战,流行病学研究表明肥胖与胰岛素抵抗、脂代谢紊乱、心血管疾病、慢性炎症等密切联系,巨噬细胞向M2型方向转化有助于调节肥胖相关的炎性反应和胰岛素抵抗,已成为肥胖相关代谢性疾病的新疗法的重要靶点[5]。肿瘤坏死因子-α(TNF-α)在肥胖的动物模型脂肪组织内分泌量增加,这是首次将肥胖与炎性反应联系起来[6]。肥胖条件下,脂肪组织主要浸润的炎细胞是促炎性的M1型巨噬细胞[7-8]。M1型巨噬细胞能释放促炎性因子(如IL-1β、IL-6等),炎性因子进一步刺激M1型巨噬细胞分泌炎性因子,募集更多M1型巨噬细胞,最终形成脂肪组织功能障碍与炎性反应的恶性循环,并且炎性因子干扰脂肪细胞的胰岛素相关信号通路,可导致胰岛素抵抗的发生[9-10]。
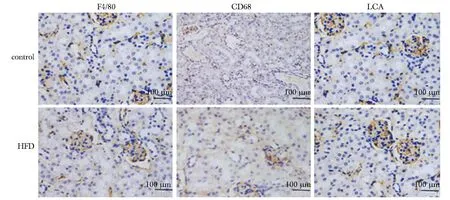
图3 免疫组化显示两组小鼠肾实质F4/80、CD68和LCA蛋白的表达Fig 3 F4/80, CD68 and LCA proteins in renal parenchyma of mice in two groups by immunohistochemistry(×200)
IHC.immunohistochemistry;*P<0.05 compared with control group图4 两组小鼠肾周脂肪组织巨噬细胞定量分析Fig 4 Quantitative analysis of macrophages in perirenal adipose tissue of mice in two groups
巨噬细胞相关标志物在高脂饲养小鼠白色脂肪组织中的表达量升高,巨噬细胞较特异的标志物F4/80阳性,并且阳性比例明显升高[11]。因此,本研究选用了较为特异的巨噬细胞标志物F4/80,但也存在低表达及检测不到的情况,因此,选择了其他巨噬细胞标志物CD68联合使用[12],此外还选用了炎细胞广谱标志物LCA对肾实质及肾周脂肪组织进行标记,结果提示HFD组肾周脂肪组织和肾实质内都发生了炎性反应,但主要发生在肾周脂肪组织。RT-qPCR检测结果发现HFD组肾周脂肪组织中主要为M1型巨噬细胞分泌的炎性因子,而M2型巨噬细胞分泌的炎性因子没有明显升高,可能是高脂饮食诱导的肥胖相关肾病肾周脂肪炎性反应主要为促炎型巨噬细胞M1型主导。本研究结果与大多数关于肥胖导致的脂肪组织炎性反应特点较为一致;推测其作用机制与高脂饮食介导TLR-4炎性信号通路活化并产生大量炎性因子有关。
大量研究结果表明,肥胖引起的脂肪组织炎性反应主要以M1型巨噬细胞浸润为主的原因与TLR4-MyD88信号通路密切相关,TLR4-MyD88信号通路刺激ATMs分泌白细胞介素-1β(IL-1β),通过IL-1β刺激骨髓增生,从而单核细胞趋化进入又形成新的ATMs,如此形成恶性循环,结果就是使脂肪组织内巨噬细胞数量急剧增加,脂肪组织炎性反应加重[13-14]。有学者通过动物实验研究发现高脂饮食可介导TLR-4信号通路活化,使IL-1β、IL-6等炎性因子在脂肪组织中的含量升高,从而导致机体出现代谢异常等改变[15]。巨噬细胞M1型与M2型的调节是一个较为复杂的过程。干扰ATMs的蓄积、募集以及在脂肪组织局部原位增殖并促进ATMs向M2型方向转化可能成为预防和治疗肥胖相关代谢异常性疾病的靶点。
