宁夏枸杞果实细胞壁蛋白适宜提取方法研究
2021-09-13张琛,杨建军,王晨,马洁,杨涓,刘根红,郑蕊,郑国琦
张琛,杨建军,王晨,马洁,杨涓,刘根红,郑蕊,郑国琦


摘要:【目的】探索適合宁夏枸杞果实细胞壁蛋白提取方法,为后续进行宁夏枸杞蛋白质组学研究提供技术支持。【方法】以宁夏枸杞果实为试验材料,采用六步洗脱法去除胞浆蛋白,然后通过定量和电泳比较氯化钙提取法、氯化锂提取法、氯化钙加氯化锂结合提取法和苯酚提取法对细胞壁蛋白的提取效果,通过双向电泳与液相色谱对所得细胞壁蛋白进行验证。【结果】六步洗脱法可较好地除去胞浆蛋白与其他干扰物质,4种方法对宁夏枸杞果实细胞壁蛋白的提取效果排序为:氯化钙提取法(272 μg/g)>苯酚提取法(261 μg/g)>氯化钙加氯化锂结合提取法(217 μg/g)>氯化锂提取法(176 μg/g)。裂解液I[7 mol/L尿素、2 mol/L硫脲、30 g/L 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、50 g/L 二硫苏糖醇(DTT)]溶解蛋白质效果更优,蛋白质定量浓度更高、电泳条带更多、更清晰。氯化钙提取所得蛋白质样品双向电泳结果较好,蛋白质点数较多、清晰度和分辨率较高;通过液相色谱可看出氯化钙提取的细胞壁蛋白肽段种类多,且大部分相对丰度较高,并含有低丰度蛋白质。所测蛋白质分类中有细胞壁定位的蛋白质。【结论】氯化钙单独提取蛋白质样品的方法是宁夏枸杞果实细胞壁蛋白提取最优方法,所得蛋白质样品已达到进行蛋白质组学研究的标准。
关键词: 宁夏枸杞;细胞壁蛋白;提取方法
中图分类号: S567.19 文献标志码: A 文章编号:2095-1191(2021)09-2534-09
Optimization of extraction method of the cell wall protein of Lycium barbarum L.
ZHANG Chen1, YANG Jian-jun2, WANG Chen1, MA Jie1, YANG Juan1,
LIU Gen-hong1, ZHENG Rui1, ZHENG Guo-qi1*
(1College of Life Science, Ningxia University, Yinchuan 750021, China; 2Ningxia Rural Economic
Management Station, Yinchuan 750002, China)
Abstract:【Objective】To explore the suitable extraction scheme of cell wall protein from Lycium barbarum L. fruit,which provided technical support for the subsequent proteomic research of L. barbarum L. 【Method】Using L. barbarum L. fruit as experimental material and six-step elution method was used to remove cytoplasm proteins,then comparing cell wall protein extraction effect with calcium chloride extraction method,lithium chloride extraction method,calcium chloride plus lithium chloride extraction method and phenol extraction method by protein quantitation and electrophoresis. Cell wall proteins were examined by two dimensional electrophoresis(2-DE) and liquid chromatography(LC). 【Result】Cytoplasmic protein and other interfering substances could be removed better using the six-step elution method. The extraction effect of the four methods on cell wall protein of L. barbarum L. fruit was ranked as follows: calcium chloride extraction method(272 μg/g)>phenol extraction method(261 μg/g)>calcium chloride plus lithium chloride extraction me-thod(217 μg/g)>lithium chloride extraction method(176 μg/g). The dissolution effect of lysis buffer I[7 mol/L urea,2 mol/L thiourea,30 g/L 3-[3-(cholamidopropyl) dimethylamino]-1-propanesulfonate (CHAPS),50 g/L dithiothreitol(DTT)] was better,the quantitative concentration of protein was higher,and the electrophoretic bands were more and clearer. The results of two-dimensional electrophoresis of the protein samples extracted by calcium chloride were better,with more protein spots,higher clarity and resolution,and the liquid chromatography showed that there were many kinds of cell wall protein peptides extracted by calcium chloride method,and most of them had high relative abundance,and contained low abundance proteins. In the classification of the tested proteins,some proteins located on the cell wall. 【Conclusion】The method of extracting protein sample by calcium chloride alone is the best method to extract cell wall proteins from Ningxia L. barbarum L. fruit,and the obtained protein sample has reached the standard of proteomics research.
Key words: Lycium barbarum L.; cell wall proteins; extraction method
Foundation item: National Natural Science Foundation of China(81760682,31660363);Ningxia Natural Science Foundation (2020AAC03097);Ningxia Lycium barbarum Industry Development Center Project(2020)
0 引言
【研究意義】宁夏枸杞(Lycium barbarum L.)为茄科枸杞属植物,是我国重要的药用植物资源(国家药典委员会,2015)。其果实干燥后为驰名中外的名贵中药材枸杞子,枸杞子的药理作用使其一直受到中外医学与食疗专家的高度重视,而枸杞多糖被公认是枸杞子中最重要的药用成分。枸杞多糖是一种细胞壁多糖,提纯后以-O-连接的糖蛋白,属于type Ⅱ类型的阿拉伯半乳聚糖蛋白(Arabinogalactan proteins,AGPs)之一(田庚元,2003;Redgwell et al.,2011)。AGP是植物细胞壁蛋白中富含羟脯氨酸的糖蛋白(HRGP)超家族中高度糖基化的成员,可能与果实成熟期间细胞扩张有关(Leszczuk et al.,2019)。已有研究发现枸杞多糖在果实转色期和成熟期(果实膨大阶段)大量增加(Zheng et al.,2010;Bao et al.,2016)。枸杞多糖的积累具有一定的时空特异性,与其积累相关的蛋白质或酶必然也呈动态变化。为确定与枸杞多糖积累相关的关键蛋白质或酶,需开展枸杞果实细胞壁差异化蛋白质组学方面的研究。细胞壁蛋白质组学技术可促进枸杞多糖积累生理生化机制的研究(Kambiranda et al.,2016)。细胞壁蛋白(Cell wall proteins,CWPs)分离是细胞壁蛋白质组学研究的重要部分,而植物细胞壁蛋白质因其特殊的定位和在提取时易受到胞浆蛋白污染的特性,使得其提取和分离较其他细胞器分布的蛋白质更加困难(Lee et al.,2004)。因此,研究宁夏枸杞细胞壁蛋白适宜提取方法,对使用细胞壁蛋白质组学技术研究枸杞多糖积累的生理生化机制有重要意义,同时对进一步调控枸杞品质具有重要的理论和实践指导意义。【前人研究进展】植物细胞壁在植物生长发育过程中发挥着重要作用,参与植物细胞的生长、分化、抗逆和细胞间的相互识别等许多重要的生命活动(Jamet et al.,2010;刘艳丽等,2018)。植物细胞壁是一个复合结构,在构成细胞壁的成分中,约90%是多糖,约10%是蛋白质、酶类及脂肪酸,其中细胞壁蛋白是细胞壁生命活动的主要承担者,与细胞壁结构形成、细胞壁成分修饰、细胞生长和信号传导以及与质膜蛋白的相互作用等过程密不可分(Wang and Komatsu,2016;刘艳丽等,2018)。近年来,各种组学技术的发展为研究发育成熟过程中果实品质变化的机理提供了强有力的手段,而细胞壁蛋白质组学已成为一个活跃的研究领域。植物细胞壁蛋白质组学研究始于2000年,现已在苜宿(Watson et al.,2004;Verdonk et al.,2012;Printz et al.,2015)、黄瓜(孟祥南等,2015)、杨树(陈颖等,2015)、小麦、拟南芥(Canut et al.,2017;Duruflé et al.,2017)、大豆、番茄等多种植物上进行研究,且这些植物在细胞壁蛋白提取和分离鉴定上也取得了明显突破(Jamet et al.,2010;刘艳丽等,2018)。由于提取时单一提取剂有时难以获得高质量细胞壁蛋白,因此也常用二步法或三步法进行细胞壁蛋白提取,如Canut等(2017)、Duruflé等(2017)使用二步法(氯化钙和氯化锂)提取拟南芥各组织细胞壁蛋白。提取苜蓿茎细胞壁蛋白时,三步法(氯化钙、EGTA和氯化锂)(Printz et al.,2015)效果优于二步法(EGTA和氯化锂)(Verdonk et al.,2012)。陈颖等(2015)分别使用氯化锂和氯化钙提取杨树叶片细胞壁蛋白,结果发现氯化钙所提蛋白质电泳条带更清晰,浓度也高于氯化锂所提蛋白。【本研究切入点】不少学者对枸杞进行了研究(田庚元,2003;郑蕊,2012;马丽娟等,2020;张鑫等,2020),但关于枸杞细胞壁蛋白质组学研究却未见报道。不同细胞壁蛋白质材料的获取也已有不少研究(Watson et al.,2004;Verdonk et al.,2012;Printz et al.,2015;Canut et al.,2017;Duruflé et al.,2017),但能否应用于枸杞尚不确定。【拟解决的关键问题】以宁夏枸杞果实为材料,使用六步洗脱法分离出细胞壁组分,采用不同提取法对枸杞细胞壁蛋白进行提取,通过定量和电泳结果比较选出最优提取方法,并对比分析不同裂解液对定量和电泳结果的影响,同时通过双向电泳与液相色谱对所得细胞壁蛋白进行验证,以期筛选出一种适宜提取宁夏枸杞果实细胞壁蛋白的方法,为宁夏枸杞细胞壁蛋白质组学研究提供技术支持。
1 材料与方法
1. 1 试验材料
宁夏枸杞果实由宁夏育新枸杞种业有限公司提供。选取6年生宁杞1号植株,在盛花期标记5000朵,分别选取花后8、24和34 d的枸杞果实进行采摘,所采果实即为青果、转色果和红果,液氮速冻,带回实验室于-80 ℃保存备用。主要试剂:牛血清蛋白(LR,国药集团化学试剂有限公司);考马斯亮蓝G-250(LR,Biotopped);无水氯化钙、无水氯化锂、无水乙酸钠、氯化钠、尿素、硫脲(AR,天津市大茂化学试剂厂);丙酮(AR,国药集团化学试剂有限公司);苯酚(重蒸试剂,北京索莱宝科技有限公司);二硫苏糖醇(DTT)、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、十二烷基硫酸钠(SDS)(AR,Bio-Rad)。主要仪器设备:高速冷冻离心机(Thermo);恒温振荡器(常州国华电器有限公司);HYQ-2121A混匀器(美国精骐有限公司);电泳仪(GE Healthcare EPS601);Easy nLC色谱系统(Thermo Scientific);DYCZ-24EN电泳仪(北京六一生物科技有限公司);DYY-6C型电泳仪电源(北京六一仪器厂)。
1. 2 细胞壁物质提取与胞浆蛋白去除
细胞壁组分提取参照Watson等(2004)的方法进行。从-80 ℃冰箱中取10 g枸杞果实(青果、转色果和红果),放入-20 ℃冰箱中回软,取出后迅速去中轴胎座,放入培养皿中称量,液氮研磨。将研磨好的组织转移到50 mL离心管中,用匀浆缓冲液(50 mmol/L乙酸钠、50 mmol/L氯化钠和30 mmol/L抗坏血酸)冲洗研钵和研杵,共30 mL,振荡20 min,13000×g离心20 min;在离心后的沉淀中再加入30 mL匀浆缓冲液,振荡20 min,13000×g离心20 min;将2次离心所得上清液合并后混匀为W1。之后依次对沉淀进行5次洗脱,每次使用洗脱液60 mL[5次洗脱液分别为:①洗脱缓冲液1(100 mmol/L氯化钠)、②双蒸水、③丙酮(80%,v/v)、④丙酮(80%,v/v)、⑤洗脱缓冲液2(10 mmol/L氯化钠)];每次洗脱将对应洗脱液分为两部分先后加入沉淀,振荡20 min,13000×g离心20 min,将2次离心所得上清液合并后混匀,分别为W2、W3、W4、W5和W6。最终6次洗脱所得上清液为胞浆蛋白,沉淀冻干后即为细胞壁组分。每种果实试验重复3次。
1. 3 胞浆蛋白提取与纯化
分别给红果六步洗脱中每步所得上清液(胞浆蛋白)加入15%三氯乙酸,沉淀2 h,13000×g离心20 min,弃除上清液,将沉淀转移至1.5 mL EP管中,13000×g离心20 min,弃除上清液,用丙酮清洗沉淀3次,每次清洗后13000×g离心20 min。所得沉淀即为胞浆蛋白。
1. 4 裂解液选择与蛋白质含量测定
取六步胞浆蛋白样品(红果),分别加入100 μL裂解液I(7 mol/L尿素、2 mol/L硫脲、30 g/L CHAPS、50 g/L DTT)和裂解液II(9 mol/L尿素、30 g/L CHAPS、50 g/L DTT)进行裂解,用光滑的玻璃棒捣碎,27 ℃水浴30 min,涡旋几秒钟,重复多次,直到蛋白质裂解充分。于常温下1000×g离心30 s,上清液用于定量和电泳。分别在每管中取20 μL进行定量,蛋白质定量采用考马斯亮蓝G-250染色法(高俊凤,2006)进行,以牛血清蛋白作为标准蛋白质。最终通过定量结果和电泳结果进行裂解液的筛选。
1. 5 细胞壁蛋白提取
分别用4种方法制备细胞壁蛋白样品,通过定量和电泳结果比较选出适用于宁夏枸杞果实细胞壁蛋白提取的最优方法。
1. 5. 1 氯化钙加氯化锂结合提取法 将六步洗脱后的沉淀(青果、转色果和红果)置于50 mL离心管内,加入7.5 mL提取缓冲液1(氯化钙缓冲液),将离心管放入低温盒中,倾斜管子,固定在摇床轻摇1 h,13000×g离心30 min,收集上清液至锥形瓶中;然后在沉淀中加入7.5 mL提取缓冲液2(氯化锂溶液),将离心管放入低温盒中,倾斜管子,固定在摇床轻摇1 h,13000×g离心30 min,收集上清液至锥形瓶中。将提取缓冲液1和提取缓冲液2提取的上清液合并,加入2倍体积的80%丙酮,孵育30 min,13000×g离心20 min,收集沉淀,将上清液漂洗3次,每次漂洗后离心,并收集沉淀在相同标号的EP管中,于4 ℃下13000×g离心5 min。冻干处理所得沉淀即为蛋白质样品。
1. 5. 2 氯化钙提取法 将六步洗脱后的沉淀(青果、转色果和红果)置于50 mL离心管内,加入7.5 mL提取缓冲液1(氯化钙缓冲液),将离心管放入低温盒中,倾斜管子,固定在摇床轻摇1 h,13000×g离心30 min,收集上清液至锥形瓶中,重复此步骤。将2次提取的上清液合并,加入2倍体积的80%丙酮,孵育30 min,13000×g离心20 min,收集沉淀,将上清液漂洗3次,每次漂洗后离心并收集沉淀在相同標号的EP管中,于4 ℃下13000×g离心5 min。冻干处理所得沉淀即为蛋白质样品。
1. 5. 3 氯化锂提取法 将六步洗脱后的沉淀(青果、转色果和红果)置于50 mL离心管内,加入7.5 mL提取缓冲液2(氯化锂缓冲液),将离心管放入低温盒中,倾斜管子,固定在摇床轻摇1 h,13000×g离心30 min,收集上清液至锥形瓶中,重复此步骤。将2次提取的上清液合并,加入2倍体积的80%丙酮,孵育30 min,13000×g离心20 min,收集沉淀,将上清液漂洗3次,每次漂洗后离心,并收集沉淀在相同标号的EP管中,于4 ℃下13000×g离心5 min。冻干处理所得沉淀即为蛋白质样品。
1. 5. 4 苯酚提取法 苯酚提取法参照H.蒂勒门特等(2013)的方法进行。将六步洗脱后的沉淀(青果、转色果和红果)用15 mL提取缓冲液重新悬浮,悬浮液与同体积冰冷的Tris-缓冲苯酚(pH=8)混合,在4 ℃下振荡30 min,4 ℃下孵育2 h,并在4 ℃下13000×g离心20 min。样品从上到下分为有机相、水相和沉淀相,小心地将上层苯酚转移至新的离心管中(注意避免碰触中间层),而底部的水相用等体积苯酚反萃取。向苯酚相中加入5倍体积含0.1 mol/L乙酸氨的冷甲醇溶液,使蛋白质沉淀。颠倒振荡离心管,在-20 ℃下沉淀至少4 h,或过夜。离心沉淀蛋白质(13000×g、30 min、4 ℃),回收沉淀蛋白质,再用含0.1 mol/L乙酸铵的冷甲醇溶液漂洗回收沉淀3次,最后用预冷的80%(v/v)2倍体积的丙酮漂洗3次。在每次漂洗后,样品均需离心(13000×g、5 min、4 ℃)。冻干处理所得沉淀即为蛋白质样品。
将以上4种提取法所得蛋白质样品加入100 μL蛋白质裂解液I,充分裂解后取上清液20 μL进行定量和25 μL上样电泳。
1. 6 SDS-PAGE电泳
1. 6. 1 1-D电泳 胞浆蛋白电泳:取青果、转色果和红果六步洗脱液裂解后的前2步上清液10 μL、后4步25 μL点样(W1:39 μg,W2:3.5 μg,W3:6.2 μg,W4:4.0 μg,W5:2.8 μg,W6:2.8 μg),进行1-D电泳分析。凝胶电泳分离胶浓度12%,浓缩胶浓度4%,初始电压110 V,至溴酚蓝前沿到达分离胶后改为210 V恒压,电泳直至溴酚蓝到达分离胶底部1 cm时终止电泳,考马斯亮蓝染色。
不同方法提取的细胞壁蛋白电泳:取不同方法提取的细胞壁蛋白样品裂解后25 μL上清液点样(氯化钙加氯化锂结合提取法:271 μg,氯化钙提取法:340 μg,氯化锂提取法:220.5 μg,苯酚提取法:327 μg),进行1-D电泳分析。
氯化钙提取不同时期果实细胞壁蛋白电泳:取氯化钙提取的3种果实(青果、转色果和红果)细胞壁蛋白样品裂解后20 μL上样,进行1-D电泳分析。
1. 6. 2 2-D电泳 2-D电泳参照郑蕊(2012)的方法,并有所改变。取氯化钙提取法提得青果(A3)蛋白质样品150 ?g,加入100 ?L上样缓冲液(10% SDS、0.5%溴酚蓝、50%甘油、500 mmol/L DTT、250 mmol/L Tris-HCl,pH 6.8),沸水浴5 min,进行12.5% SDS-PAGE电泳(恒流14 mA,90 min),考马斯亮蓝染色。
1. 7 液相色谱检测
取氯化钙提取法提得青果(A3)蛋白质裂解后溶液30 ?L,采用Wi?niewski等(2009)的方法进行酶切。高效液相色谱将样品采用纳升流速的HPLC液相系统EasynLC进行分离。缓冲液A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱以95%的A液平衡,樣品由自动进样器上样到上样柱(Thermo Scientific Acclaim PepMap100,100 μm×2 cm,nano Viper C18),经分析柱(Thermo Scientific EASY Column,10 cm,ID 75 μm,3 μm,C18-A2)分离,流速300 nL/min。使用Proteome Discoverer-MASCOT分析软件对结果进行分析,查询数据库为Uniprot Solanoideae数据库。
2 结果与分析
2. 1 裂解液的比较与细胞壁组分的确定
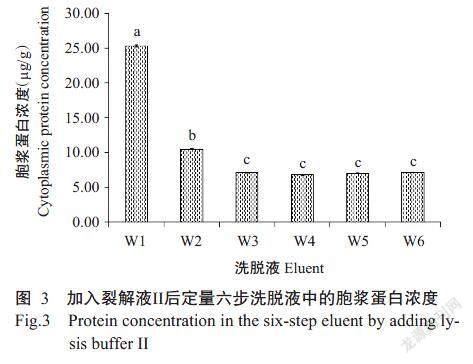
红果的六步洗脱所提取的胞浆蛋白加入裂解液I后定量和电泳结果如图1和图2所示,加入裂解液II后定量和电泳结果如图3和图4所示。加入裂解液I后,后5步洗脱液胞浆蛋白浓度显著低于第1步洗脱液胞浆蛋白(P<0.05,下同)(图1);加入裂解液II后,后5步洗脱液胞浆蛋白浓度显著低于第1步洗脱液胞浆蛋白浓度,后4步洗脱液胞浆蛋白浓度显著低于第2步洗脱液胞浆蛋白浓度(图3)。对比后发现使用裂解液I后所测得蛋白质浓度明显高于加入裂解液II。如图2所示,加入裂解液I后,前3步还可看到清晰的蛋白质条带,后5步洗脱液电泳图已无明显背景;而加入裂解液II后,电泳图无明显背景与清晰蛋白质条带(图4)。结果表明裂解液I效果优于裂解液II,到最后一步胞浆蛋白已经几乎洗脱完全。
2. 2 宁夏枸杞果实细胞壁蛋白提取方法的比较结果
由图5可知,4种提取方法所得枸杞果实细胞壁蛋白样品中蛋白质含量排序为:氯化钙提取法(272 μg/g)>苯酚提取法(261 μg/g)>氯化钙加氯化锂结合提取法(217 μg/g)>氯化锂提取法(176 μg/g),其中氯化钙提取法和苯酚提取法所得蛋白质含量显著高于氯化钙加氯化锂结合提取法和氯化锂提取法,且氯化钙提取法试验结果平行性最好。电泳结果(图6)与图5结果相吻合,电泳结果表明相同条件下氯化钙提取的蛋白质较苯酚提取法所得蛋白质的杂质少(背景颜色浅)、质量高(条带更清晰);氯化钙提取法所得蛋白质与氯化钙加氯化锂结合提取法所得蛋白质电泳条带基本吻合,氯化锂提取法所得蛋白质电泳条带可在其电泳条带中找到对应条带,说明氯化钙提取法所得蛋白质基本可覆盖氯化钙加氯化锂结合提取法所提蛋白质。
2. 3 氯化钙提取法提取的宁夏枸杞果实细胞壁蛋白质
将青果、转色果和红果各取3份,用氯化钙提取法提取蛋白质并进行定量和电泳,结果(表1和图7)表明,各组蛋白质样品制备正常,氯化钙提取法对3个时期枸杞果实细胞壁蛋白质提取均有效。由表1可知,不同时期果实组内结果平行性较好,组间定量结果有明显差异。由图7可知,不同时期果实所提蛋白质电泳结果背景颜色浅、电泳条带清晰,组内图谱相似,均能满足蛋白质样品质量要求。
2. 4 2-DE和液相色谱结果验证
为验证氯化钙提取法所提蛋白质能否进行蛋白质组学试验,进一步确定枸杞细胞壁蛋白样品中蛋白质情况,选取A3样品进行双向电泳试验和色谱分析(由各蛋白质样品的定量和电泳结果来看3个时期9个样品平行性均较好,故随机选择A3进行验证)。双向电泳试验结果如图8所示,得到斑点大小、形状、位置与肉眼观察较为接近的图谱;图谱无明显横纹,蛋白质点数较多,大部分蛋白质点无拖尾现象,清晰度和分辨率较高,双向电泳试验结果较好。液相色谱分析后得到Basepeak图谱,Basepeak图是在液相色谱过程中将每个时间点质谱检测信号最强的肽段强度值连续描绘得到的图谱。如图9所示,横坐标为肽段在色谱中的保留时间,纵坐标为质谱信号强度,主要峰上的数字标记分别为信号峰强度最高的肽段的保留时间和质荷比。从色谱图上看到在不同时间洗脱的峰较多(肽段种类多),且相对丰度较高,有部分信号峰强度弱(含有低丰度蛋白质)。经Proteome Discoverer-MASCOT软件分析在Uniprot Solanoideae数据库共查到蛋白质241个,其中独有肽段≥2的有93个。此外,除去未知蛋白,将剩余141个蛋白质初步分成14类(表2),可看出所提蛋白质中有细胞壁定位的蛋白质(8种)。
3 讨论
本研究中,使用裂解液I裂解蛋白质定量后浓度大于裂解液II,且裂解后蛋白质电泳条带清晰,而经裂解液II裂解的蛋白质几乎没有条带,说明裂解液I对蛋白质的溶解度更大。裂解液I相对于裂解液II增添了硫脲,硫脲可增加碱性蛋白质的溶解度,与郑蕊(2012)研究发现加入硫脲的裂解液裂解蛋白质后定量与电泳效果较好的结果一致。加入裂解液I后,胞浆蛋白电泳图W6几乎没有条带,与Watson等(2004)研究得到紫花苜蓿茎细胞壁蛋白质提取中胞浆蛋白质的电泳图基本一致,到第六步几乎没有蛋白质的条带,认为六步洗脱液洗脱去胞浆蛋白,提取后最终所得的沉淀即为细胞壁组分。
根据细胞壁蛋白与细胞壁其他成分的结合程度,可将其分为3类:疏松结合型蛋白质、松散结合离子型蛋白质和紧密结合交联型蛋白质。结合程度的差异也是导致细胞壁蛋白提取困难的原因之一,因此提取剂的选择十分重要(刘艳丽等,2018)。目前,多采用盐溶液萃取法提取细胞壁蛋白,常用的盐溶液有氯化钠、氯化钙和氯化锂等,其中,氯化钙是提取高等植物细胞壁蛋白的最有效试剂(Jamet et al.,2010),氯化锂常用于提取强离子结合型蛋白质(刘艳丽等,2018)。苯酚提取法为常用的传统植物蛋白质提取方法,可有效去除酚类化合物、色素和多糖等(裘劼人等,2020)。而本研究发现使用苯酚提取法所提细胞壁蛋白杂质多于其他3种方法,可能是因为苯酚提取法对疏水性蛋白质和内质网等其他细胞器蛋白质的提取造成(裘劼人等,2020)。氯化钙提取法提取宁夏枸杞果实细胞壁蛋白所得蛋白质含量最多,从电泳效果来看无明显杂质干扰,基本可覆盖氯化锂提取法所提蛋白质,与孟祥南等(2015)在进行黄瓜叶片细胞壁蛋白提取时发现盐提法较酚提法效率更高,污染率更低的研究结果一致。陈颖等(2015)同样发现在提取杨树胞外蛋白时氯化钙提取法优于氯化锂提取法。
虽然蛋白质分离技术不断更新,但双向电泳技术仍是重要的蛋白质分离手段(张丽等,2011)。双向电泳是唯一能同时将上千种蛋白质分离和展示的方法,在蛋白质组学中发挥着重要作用(Li et al.,2017)。蛋白质提取是电泳成败的关键,目前用于电泳的蛋白质提取方法主要为蛋白质沉淀法和样本直接裂解提取法,无论采用哪种方法,最根本的目的是获得高纯度、无干扰杂质和尽可能全部的蛋白质。然而对于富含糖蛋白较多的样品,多糖会阻碍凝胶孔径,导致蛋白质沉淀,延长凝聚时间,或出现水平条纹,对双向电泳影响极大(何文锦等,2007)。对于富含多糖的样品,目前大多采用高速离心法或透析法去除(Ehling-Schulz et al.,2002),然而由于枸杞细胞壁不仅富含多种糖蛋白,还含有大量色素和胶质等物质,因此本研究先用洗脱液采用高速离心法确定是细胞壁组分,再从细胞壁组分中提取枸杞细胞壁蛋白,确保提取的是细胞壁蛋白而非其他組分的杂蛋白,且避免多糖、色素和胶质等物质对电泳的影响。从双向电泳结果来看,蛋白质样品内少有不溶性细胞碎片、盐分、多糖和其他杂质,电泳效果较好,达到后续蛋白质组学试验的样品要求;通过液相色谱分析结果来看,蛋白质样品中的肽段种类较多,复杂程度较高,且含有低丰度蛋白质,所提蛋白质中含有明确细胞壁定位的蛋白质。氯化钙法提取的细胞壁蛋白已达到进行蛋白质组学研究的标准,可继续进行后续枸杞果实细胞壁蛋白质组学试验,开展枸杞果实细胞壁差异化蛋白质组学方面的研究,确定与枸杞多糖积累相关关键蛋白质或酶,进而阐明蛋白质水平上枸杞多糖积累机制。
4 结论
运用六步洗脱法可去除胞浆蛋白获得细胞壁组分,用氯化钙溶液单独提取细胞壁蛋白样品所得样品蛋白质丰度和质量优于苯酚提取法、氯化锂提取法和氯化钙加氯化锂结合提取法,其中选用含有硫脲的裂解液Ⅰ裂解蛋白质定量和电泳效果好。氯化钙提取所得蛋白质样品已达到后续蛋白质组学研究的样品要求,氯化钙提取法为宁夏枸杞果实细胞壁蛋白提取的最优方法。
参考文献:
陈颖,乐利,罗永亚,杨华,汪南阳,林芳芝,王俊霖. 2015. 杨树胞外蛋白的提取分离及2-D电泳体系的建立[J]. 西北植物学报,35(1):199-206. [Chen Y,Yue L,Luo Y Y,Yang H,Wang N Y,Lin F Z,Wang J L. 2015. Extraction and 2-D electrophoresis analysis of extracellular proteins from NL895 poplar leaves and stems[J]. Acta Botanica Boreali-Occidentalia Sinica,35(1):199-206.] doi:10.7606/ j.issn.1000-4025.2015.01.0199.
H. 蒂勒门特,M. 齐维,C. 达默韦尔,V. 米琴. 2013. 植物蛋白质组学实验指南[M]. 沈世华译. 北京:科学出版社. [蒂勒门特 H,齐维 M,达默韦尔 C,米琴 V. 2013. Plant proteomics methods and protocols[M]. Translated by Shen S H. Beijing: Science Press.]
高俊凤. 2006. 植物生理学实验指导[M]. 北京:高等教育出版社. [Gao J F. 2006. Experimental physiology experiment guide[M]. Beijing:Higher Education Press.]
国家药典委员会. 2015. 中华人民共和国药典[M]. 北京:中国医药科技出版社. [Chinese Pharmacopoeia Commission. 2015. Pharmacopoeia of Peoples Republic of China[M]. Beijing: China Medical Science Press.]
何文锦,郭晋隆,陈由强,林思祖,陈如凯. 2007. 灰木相思蛋白质组双向电泳条件的优化[J]. 西北植物学报,27(8):1577-1582. [He W J,Guo J L,Chen Y Q,Lin S Z,Chen R K. 2007. Establishment of a two-dimensional electrophoresis protocol for proteome of Acacia implexa[J]. Acta Botanica Boreali-Occidentalia Sinica,27(8):1577-1582.] doi:10.3321/j.issn:1000-4025.2007.08.012.
刘艳丽,金孝芳,马林龙,曹丹,龚自明,焦春海,韦朝领. 2018. 植物细胞壁蛋白质组学研究进展[J]. 生物化学与生物物理进展,45(8):833-840. [Liu Y L,Jin X F,Ma L L,Cao D,Gong Z M,Jiao C H,Wei C L. 2018. Advance in plant cell wall proteomics[J]. Progress in Biochemistry and Biophysics,45(8):833-840.] doi:10.16476/j.pibb.2017.0454.
马丽娟,霍鹏超,孙梦茹,朱亮,胡情,葛广波,贾守宁. 2020. 黑果枸杞化学成分和药理活性的研究进展[J]. 中草药,51(22):5884-5893. [Ma L J,Huo P C,Sun M R,Zhu L,Hu Q,Ge G B,Jia S N. 2020. Research progress on chemical constituents and pharmacological activities of Lycium ruthenicum[J]. Chinese Traditional and Herbal Drugs,51(22):5884-5893.] doi:10.7501/j.issn.0253-2670. 2020.22.028.
孟祥南,张迪,范海延,于洋,崔娜,宋铁峰. 2015. 黄瓜叶片细胞壁蛋白质提取方法的筛选[J]. 沈阳农业大学学报,46(1):101-104. [Meng X N,Zhang D,Fan H Y,Yu Y,Cui N,Song T F. 2015. Selection for the extraction methods of cucumber leaf cell wall proteins[J]. Journal of Shenyang Agricultural University,46(1):101-104.] doi:10.3969/j.issn.1000-1700.2015.01.018.
裘劼人,柴伟国,童建新,周历萍,王淑珍. 2020. 质谱蛋白质组学研究中草莓雌蕊蛋白提取方法优化[J]. 浙江农业学报,32(12):2186-2191. [Qiu J R,Chai W G,Tong J X,Zhou L P,Wang S Z. 2020. Optimization of strawberry gynoecium protein extraction method for mass spectrum-based proteomic study[J]. Acta Agriculturae Zhe-jiangensis,32(12):2186-2191.] doi:10.3969/j.issn.1004-1524.2020.12.09.
田庚元. 2003. 枸杞子糖缀合物的结构与生物活性研究[J]. 世界科学技术—中医药现代化,5(4):22-30. [Tian G Y. 2003. Study on structure and bioactivity of glycoconjugate compounds of fructus lycii[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,5(4): 22-30.] doi:10.3969/j.issn. 1674-3849.2003.04.005.
张丽,罗海波,姜丽,蒋娟,傅淋然,郁志芳. 2011. 果实成熟衰老过程中蛋白质组学研究进展[J]. 植物生理學报,47(9):861-871. [Zhang L,Luo H B,Jiang L,Jiang J,Fu L R,Yu Z F. 2011. Advances in proteomics related to fruit ripening and senescence[J]. Plant Physiology Journal,47(9):861-871.] doi:10.13592/j.cnki.ppj.2011.09.012.
张鑫,刘洋,程亚茹,王嘉馨,龚燚婷,李彦萍,杨冬平,李彤,董玲. 2020. 枸杞多糖分子量分布测定与抗炎活性关联研究[J]. 北京中医药大学学报,43(11):959-964. [Zhang X,Liu Y,Cheng Y R,Wang J X,Gong Y T,Li Y P,Yang D P,Li T,Dong L. 2020. Molecular weight distribution of Lycium barbarum polysaccharides and its relation with anti-inflammatory activity[J]. Journal of Beijing University of Traditional Chinese Medicine,43(11):959-964.] doi:10.3969/j.issn.1006-2157.2020.11. 011.
鄭蕊. 2012. 枸杞雄性不育花药差异蛋白质组分析及3个相关基因的克隆[D]. 南京:南京农业大学. [Zheng R. 2012. Differential proteome analysis of male sterile wolfberry anther and cloning of three related genes[D]. Nanjing:Nanjing Agricultural University.]
Bao H,Zheng G Q,Qi G L,Su X L,Wang J. 2016. Cellular localization and levels of arabinogalactan proteins in Lycium barbarums fruits[J]. Pakistan Journal of Botany,48(5):1951-1963.
Canut H,Albenne C,Jamet E. 2017. Isolation of the cell wall[J]. Methods in Molecular Biology,1511:171-185. doi:10.1007/978-1-4939-6533-5_14.
Duruflé H,Clemente H S,Balliau T,Zivy M,Dunand C,Jamet E. 2017. Cell wall proteome analysis of Arabidopsis thaliana mature stems[J]. Proteomics,17(8):1600449. doi:10.1002/pmic.201600449.
Ehling-Schulz M,Schulz S,Wait R,G?rg A,Scherer S. 2002. The UV-B stimulon of the terrestrial cyanobacterium nostoc commune comprises early shock proteins and late acclimation proteins[J]. Molecular Microbiology,46(3):827-843. doi:10.1046/j.1365-2958.2002.03209.x.
Jamet E,Albenne C,Boudart G,Irshad M,Canut H,Pont-Lezica R. 2010. Recent advances in plant cell wall proteo-mics[J]. Proteomics,8(4):893-908. doi:10.1002/pmic. 200700938.
Kambiranda D,Basha S M,Singh R K,He H,Calvin K,Mercer R. 2016. In depth proteome analysis of ripening muscadine Grape Berry cv. carlos reveals proteins associated with flavor and aroma compounds[J]. Journal of Proteome Research,15(9):2910-2923. doi:10.1021/acs.jproteome. 5b01064.
Lee S J,Saravanan R S,Damasceno C M B,Damasceno C M B,Yamane H,Kim B D,Rose J K C. 2004. Digging deeper into the plant cell wall proteome[J]. Plant Physio-logy & Biochemistry,42(12):979-988. doi:10.1016/j.plaphy.2004.10.014.
Leszczuk A,Chylińska M,Zdunek A. 2019. Enzymes and vitamin C as factors influencing the presence of arabinogalactan proteins(AGPs) in Solanum lycopersicum fruit[J]. Plant Physiology and Biochemistry,139:681-690. doi:10. 1016/j.plaphy.2019.04.035.
Li Y,Wang Y,Xue H,Pritchard H W,Wang X F. 2017. Changes in the mitochondrial protein profile due to ROS eruption during ageing of elm(Ulmus pumila L.) seeds[J]. Plant Physiology and Biochemistry,114: 72-87. doi:10.1016/j.plaphy.2017.02.023.
Printz B,Morais R D S,Wienkoop S,Sergeant K,Lutts S,Hausman J F,Renaut J. 2015. An improved protocol to study the plant cell wall proteome[J]. Frontiers in Plant Science,6:237. doi:10.3389/fpls.2015.00237.
Redgwell R J,Curti D,Wang J K,Dobruchowska J M,Gerwig G J,Kamerling J P,Bucheli P. 2011. Cell wall polysaccharides of chinese wolfberry(Lycium barbarum):Part 2. Characterisation of arabinogalactan-proteins[J]. Carbohydrate Polymers,84(3):1075-1083. doi:10.1016/j.carbpol.2010.12.071.
Verdonk J C,Hatfield R D,Sullivan M L. 2012. Proteomic analysis of cell walls of two developmental stages of alfalfa stems[J]. Frontiers in Plant Science,3:279. doi:10. 3389/fpls.2012.00279.
Wang X,Komatsu S. 2016. Plant subcellular proteomics:Application for exploring optimal cell function in soybean[J]. Journal of Proteomics,143(4):45-56. doi:10.1016/j.jprot.2016.01.011.
Watson B S,Lei Z T,Dixon R A,Sumner L W. 2004. Proteomics of Medicago sativa cell walls[J]. Phytochemistry,65(12):1709-1720. doi:10.1016/j.phytochem.2004.04. 026.
Wi?niewski J R,Zougman A,Nagaraj N,Mann M. 2009. Universal sample preparation method for proteome analysis[J]. Nature Methods,6:359-362. doi:10.1038/nmeth.1322.
Zheng G Q,Zheng Z Y,Xu X,Hu Z H. 2010. Variation in fruit sugar composition of Lycium barbarum L. and Ly-cium chinense Mill. of different regions and varieties[J]. Biochemical Systematics & Ecology,38(3):275-284. doi: 10.1016/j.bse.2010.01.008.
(責任编辑 罗 丽)
