苦荞二磷酸尿核苷-半乳糖转运载体FtUTR的鉴定与分析
2021-09-12石桃雄汪燕梁成刚韦春玉关志秀黄娟朱丽伟
石桃雄 汪燕 梁成刚 韦春玉 关志秀 黄娟 朱丽伟

摘要:植物二磷酸尿核苷-半乳糖转运蛋白(UDP-galactose transporter,UTR)参与介导UDP-半乳糖的跨膜运输,对于高尔基体内非纤维素多糖和糖蛋白合成至关重要。为了给苦荞糖运输及调控机制研究提供科学参考,本研究基于基因功能注释与同源基因比对,鉴定到9个苦荞FtUTR基因,其序列长度在1 920~5 975 bp间,氨基酸残基在 81~352个间。FtUTR氨基酸序列的一致性为19.14%,说明苦荞不同FtUTR蛋白间序列保守性较低。但多个苦荞FtUTR可分别与同源的拟南芥AtUTR聚在一起,说明不同物种间UTR蛋白的进化关系较为紧密。基于茎的转录组测序鉴定到5个差异表达基因(DEGs),其中FtPinG0001931200.01在出苗后5 d高表达;FtPinG0001901300.01和FtPinG0002689200.01在出苗后10 d高表达;FtPinG0001931400.01和FtPinG0001052700.01在出苗后15 d高表达,推测它们可能在幼苗的特定发育阶段发挥作用。另外,幼苗发育过程中苦荞DEGs的表达量存在多个显著正相关或负相关关系。本研究结果可为下一步深入探索苦荞FtUTR调控UDP-半乳糖运输以及生长发育提供基础。
关键词:苦荞;二磷酸尿核苷-半乳糖转运体;蛋白序列分析;基因表达
中图分类号:S517.01 文献标志码: A
文章编号:1002-1302(2021)15-0053-05
收稿日期:20201-04-14
基金项目:国家自然科学基金 (编号:32060511);贵州省科技支撑计划 (编号:黔科合ZC[2019]2298);贵州省高层次创新型人才“千层次人才”项目;贵州省荞麦种质资源保育及创新重点实验室建设基金(编号:黔教合KY[2017]002);贵州省研究生教育创新计划 (编号:黔教合YJSCXJH[2020]100)。
作者简介:石桃雄(1980—),女,宁夏石嘴山人,博士,副教授,研究方向为荞麦数量遗传学,E-mail:shitaoxiong@126.com;共同第一作者:汪 燕(1985—),女,重庆人,博士,副教授,研究方向为荞麦种质资源创新与遗传育种,E-mail:yanwanguf@163.com。
通信作者:梁成刚,博士,副教授,研究方向为荞麦遗传育种。E-mail:jesselcg@163.com。
二磷酸尿核苷-半乳糖(UDP-galactose)是植物高尔基体内非纤维素多糖和糖蛋白合成的重要前体物质[1-2]。UDP-半乳糖转运蛋白(UDP-galactose transporter,UTR)则是介导UDP-半乳糖进行跨膜运输的重要载体,对于植物的生长发育具有重要作用[3-4]。Khalil等将人类的UDP-半乳糖转运体基因hUGT1导入烟草,结果发现转基因烟草植株表现出类似于外源赤霉素喷施的形态特征[5]。Reyes等研究指出,拟南芥中UDP-半乳糖转运体AtUTr1定位于内质网,体外试验证实AtUTr1能够参与UDP-半乳糖和UDP-葡萄糖运输[6]。此外,Bakker等鉴定获得2个拟南芥UDP-半乳糖转运体基因(UDP-GalT1和UDP-GalT2),互补试验证实它们具有UDP-半乳糖底物特异性[7]。Rollwitz等则在拟南芥中鉴定到一个新的UDP-半乳糖蛋白AtNST-KT1[8]。Handford等研究发现,拟南芥AtUTr7调控了UDP-半乳糖和UDP-葡萄糖的运输,进而影响侧根的发育[9]。Seino等基于拟南芥UDP-galactose transporter序列比对,鉴定到水稻同源基因,并克隆了4个OsUGT基因,分别编码350、337、345和358个氨基酸残基[10];互补试验证实OsUGT1、OsUGT2、OsUGT3可参与介导UDP-半乳糖的运输,而OsUTG4则介导了UDP-葡萄糖的运输。苏莹等基于同源比对鉴定到具有UDP-半乳糖和UDP-鼠李糖转运活性的水稻OsURGT1,氨基酸残基数为331个,可能参与多种激素调控途径和逆境胁迫调控途径[11]。
苦荞是我国的特色杂粮作物,主要种植于西南高寒地区[12]。苦荞生育期短,同时具有耐贫瘠、耐冷凉、耐干旱等特性,加之其营养保健功能突出,深受人们的喜爱[13-14]。不過,作为一种小宗作物,苦荞栽培驯化时间短,基础研究开展较为滞后,开展与苦荞糖运输及调控机制的相关研究工作,可为探索苦荞生长发育与产量形成提供科学参考。本研究首次对苦荞UDP-半乳糖转运基因家族FtUTR基因进行筛选、鉴定与生物信息学分析,明确FtUTR基因信息及编码蛋白理化特性、系统发育关系,并结合转录组测序分析苦荞FtUTR的表达模式等,为苦荞糖类运输的分子调控机制等相关研究提供依据。
1 材料与方法
1.1 试验材料
基于拟南芥TAIR基因库(https://www.arabidopsis.org/about/datasources.jsp)中查询获得的AtUTR基因序列和苦荞转录组测序数据库的基因功能注释,进行序列同源比对,筛选并鉴定苦荞FtUTR基因。
1.2 苦荞FtUTR基因及编码蛋白的序列分析
登陆NCBI网站(https://www.ncbi.nlm.nih.gov/orffinder/)进行苦荞FtUTR基因的最长开放阅读框编码蛋白(MaxORF)及编码蛋白的氨基酸序列预测。登陆Expasy网站(https://web.expasy.org/protparam/)进行苦荞FtUTR编码蛋白的氨基酸残基数、蛋白分子质量、等电点、疏水性和脂肪族氨基酸指数的预测。登陆蛋白结构预测网站(http://smart.embl-heidelberg.de/)进行苦荞FtUTR蛋白的跨膜结构功能域预测。利用DNAman软件分析FtUTR氨基酸序列的保守位点。利用MEGA 5.0软件Cluster W进行FtUTR氨基酸序列多重序列比对分析,使用Neighbor-joining法进行蛋白聚类分析,重复次数设置为1 000次。
1.3 苦荞FtUTR基因的表达与相关性分析
试验于2018年在贵州省荞麦工程技术研究中心基地进行,在苦荞出苗后5、10、15 d对基部茎进行转录组测序和基因表达分析,并鉴定差异表达基因(DEGs)。利用MeV软件制作FtUTR基因的表达量热图,SPSS 19.0进行FtUTR基因表达量的相关性分析。
2 结果与分析
2.1 苦荞FtUTR基因及蛋白序列分析
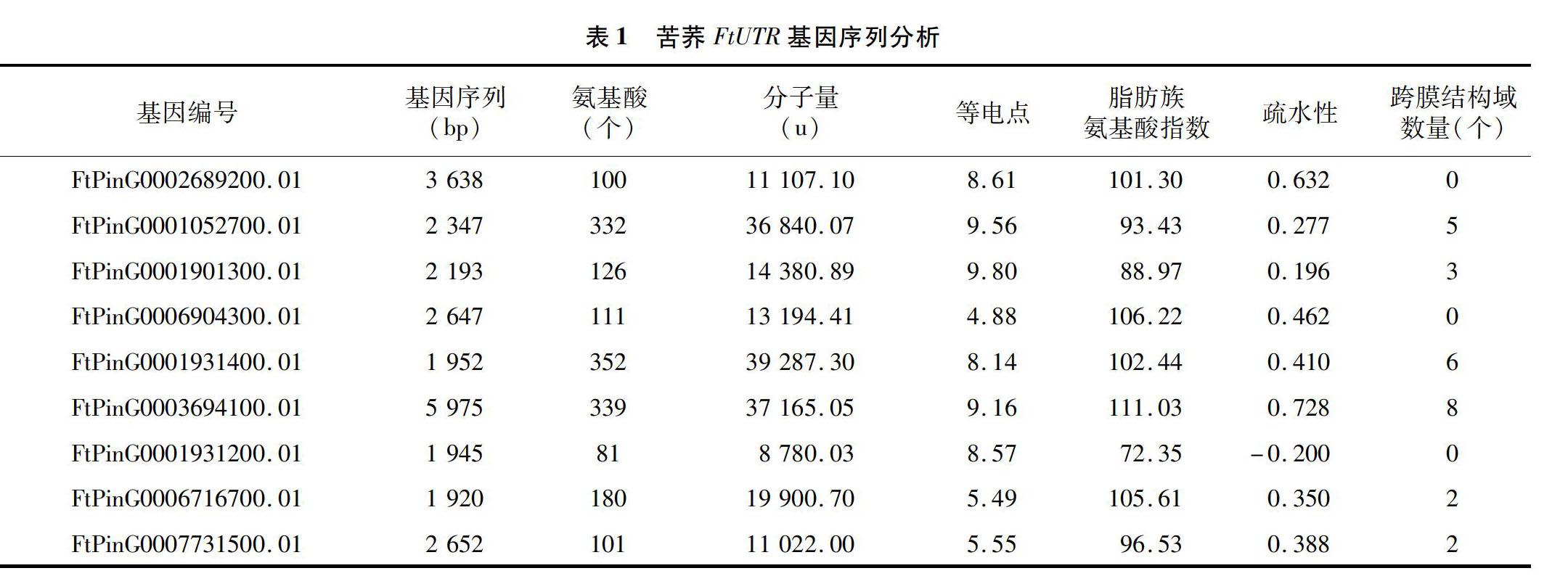
基于转录组测序的基因功能注释与拟南芥AtUTR序列比对筛选到9个同源苦荞FtUTR基因。如表1所示,苦荞FtUTR序列在1 920~5 975 bp间,MaxORF的氨基酸残基在81~352个间,分子量在8 780.03~39 287.30 u间,等电点在4.88~980间,疏水性在-0.200~0.728间,脂肪族氨基酸指数在72.35~111.03间。跨膜结构域预测发现6个FtUTR的MaxORF跨膜结构域在2~8个间,3个FtUTR的MaxORF蛋白不含有跨膜结构域。
对苦荞FtUTR的MaxORF蛋白序列进行比对分析,结果发现9个苦荞FtUTR的MaxORF蛋白序列一致性仅为19.14%。如图1所示,9个蛋白间不存在完全共同保守位点,仅存在19个相对保守位点,说明FtUTR间氨基酸序列差异较大。
2.2 苦荞FtUTR蛋白序列分析
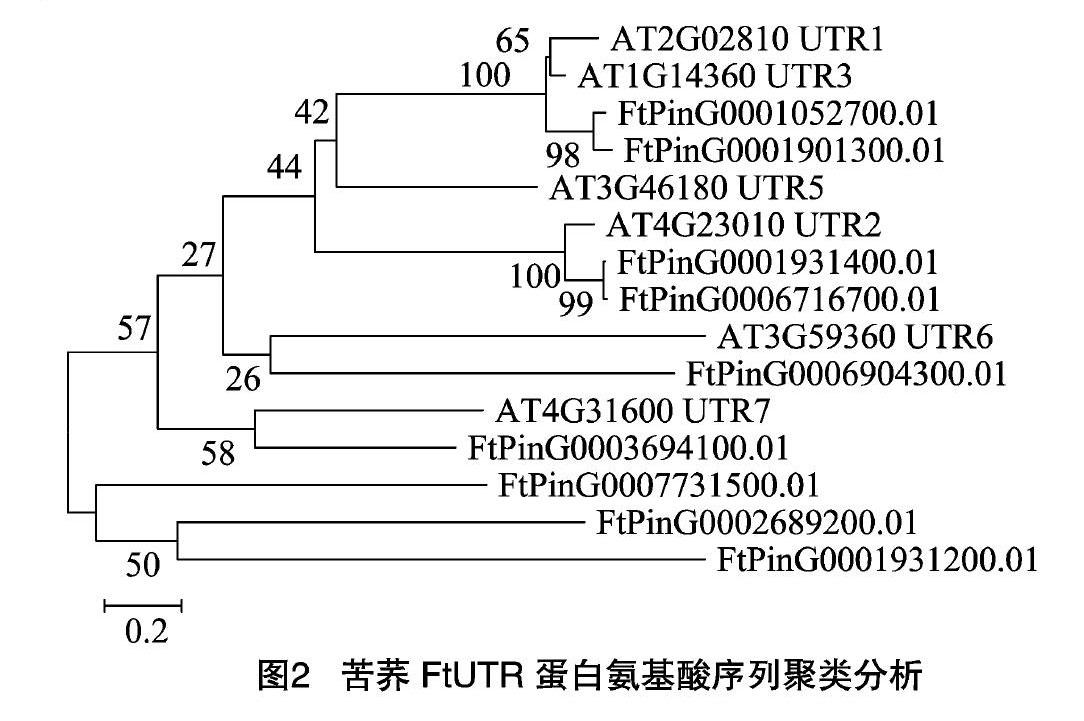
利用拟南芥AtUTR蛋白序列与苦荞FtUTR蛋白序列进行聚类分析,由图2可知,拟南芥UTR1、UTR3与苦荞FtPinG0001052700.01、FtPinG0001901300.01被聚为一小类;拟南芥UTR2与苦荞FtPinG0001931400.01、FtPinG0006716700.01被聚为一小类;拟南芥UTR6与苦荞FtPinG0006904300.01被聚为一小类;拟南芥UTR7与苦荞FtPinG0003694100.01被聚为一小类;另外,苦荞FtPinG0007731500.01、FtPinG0002689200.01和FtPinG0001931200.01被聚为一小类。
2.3 苦荞茎发育过程中FtUTR基因的表达分析
基于转录组测序,检测到9个FtUTR基因在苦荞出苗后5、10、15 d茎中均有表达,DEGs鉴定发现5個FtUTR基因在不同时期茎中差异表达。由图 3-A 可知,不同时期茎FtUTR基因的表达量变化趋势不一致,主要存在表达量逐渐升高、逐渐降低、先升高后降低以及相对变化幅度较小的4种变化类型。由图3-B可知,1个苦荞FtUTR差异表达基因(FtPinG0001931200.01)在出苗后5 d高表达;2个苦荞FtUTR差异表达基因(FtPinG0001901300.01和FtPinG0002689200.01)在出苗后10 d高表达;2个苦荞FtUTR差异表达基因(FtPinG0001931400.01和FtPinG0001052700.01)在出苗后15 d高表达,推测不同FtUTR基因可能在茎的特定发育阶段发挥功能。
2.4 苦荞FtUTR基因的相关性分析
对不同时期苦荞茎FtUTR基因的表达量进行
相关性分析,由表2可知,FtPinG0001931200.01与FtPinG0001052700.01、FtPinG0001931400.01呈显著或极显著负相关关系;FtPinG0002689200.01与FtPinG0001901300.01呈极显著正相关关系,与FtPinG0001052700.01、FtPinG0001931400.01呈显著或极显著负相关关系;FtPinG0001901300.01与FtPinG0001052700.01、FtPinG0001931400.01呈极显著负相关关系;FtPinG0001052700.01与FtPinG0001931400.01呈极显著正相关关系。
3 讨论与结论
植物UTR蛋白介导的UDP-半乳糖跨膜运输对非纤维素多糖和糖蛋白合成具有重要作用[1-3,15]。基于拟南芥UTR序列,在作物中陆续开展了同源基因的相关研究。例如Seino等克隆得到了水稻OsUGT1、OsUGT2、OsUGT3、OsUGT4,分别编码350、337、345、358个氨基酸残基[10]。本研究基于转录组测序的基因功能注释与拟南芥UTR同源基因进行比对,筛选到9个苦荞FtUTR基因。其中,FtPinG0001052700.01、FtPinG0003694100.01、FtPinG0001931400.01FtUTR基因分别编码332、339、352个氨基酸残基,其余6个FtUTR基因的最长开放阅读框编码氨基酸序列较短。跨膜结构预测发现,氨基酸序列较长的FtUTR蛋白含有多个跨膜结构域,虽然3个FtUTR基因的MaxORF不存在跨膜结构域,不过它们的其他ORF编码蛋白含有跨膜结构域,因此,推测9个苦荞FtUTR基因均能介导跨膜运输。
Seino等指出植物中存在多个UDP-半乳糖转运基因,但相互间进化关系并不紧密[10]。本研究发现,苦荞9个FtUTR蛋白间序列一致性仅为1914%,且不存在完全共同保守位点,仅含19个相对保守位点,说明苦荞不同FtUTR蛋白间序列保守性较低。不过,多个拟南芥AtUTR与苦荞FtUTR被聚在一起,例如拟南芥AtUTR2与苦荞FtPinG0001931400.01、FtPinG0006716700.01被聚为一小类,说明不同物种间UTR蛋白的进化关系较为紧密。
本研究发现苦荞茎不同发育时期9个FtUTR基因表达量变化趋势不一致,基于转录组差异基因分析共鉴定到5个DEGs,其中FtPinG0001931200.01在出苗后5 d高表达;FtPinG0001901300.01和FtPinG0002689200.01在出苗后10 d高表达;FtPinG0001931400.01和FtPinG0001052700.01在出苗后15 d高表达。苦荞出苗后5 d,幼苗正处于子叶期,营养物质由地下种子向地上部分运输,10 d时幼苗正逐步完成由子叶期向真叶期的过渡,而 15 d时植株则完全进入真叶期,因此,推测这些FtUTR可能在幼苗的特定发育阶段发挥作用。另外,4个FtUTR基因在茎不同发育时期表达量无明显变化,表明它们可能在幼苗发育过程中持续发挥作用。相关性研究发现,苦荞中FtUTR基因中5个DEGs间存在多个显著正相关或负相关的关系,而其余4个FtUTR基因与其他FtUTR基因间不存在显著性相关,说明这些DEGs间可能协调发挥功能或相互间存在功能互补现象。本研究为下一步深入探索苦荞FtUTR调控UDP-半乳糖运输以及生长发育提供了基础。
参考文献:
[1]Zimowski J. Characterization of UDP-galactose:tomatidine galactosyltransferase from tomato (Lycopersicon esculentum) leaves[J]. Acta Biochimica Polonica,1994,41(2):202-204.
[2] Bergenstrahle A,Tillberg E,Jonsson L. Characterization of UDP-glucose:solanidine glucosyltransferase and UDP-galactose:solanidine galactosyltransferase from potato tuber[J]. Plant Science,1992,84(1):35-44.
[3]Norambuena L. Transport of UDP-galactose in plants[J]. Journal of Biological Chemistry,2002,277(36):32923-32929.
[4]Sprong H,Degroote S,Nilsson T,et al. Association of the Golgi UDP-galactose transporter with UDP-galactose:ceramide galactosyltransferase allows UDP-galactose import in the endoplasmic reticulum[J]. Molecular Biology of the Cell,2003,14(8):3482-3493.
[5]Khalil M F,Kajiura H,Fujiyama K,et al. The impact of the overexpression of human UDP-galactose transporter gene hUGT1 in tobacco plants[J]. Journal of Bioscience and Bioengineering,2010,109(2):159-169.
[6]Reyes F,Marchant L,Norambuena L,et al. AtUTr1,a UDP-glucose/UDP-galactose transporter from Arabidopsis thaliana,is located in the endoplasmic reticulum and up-regulated by the unfolded protein response[J]. The Journal of Biological Chemistry,2006,281(14):9145-9151.
[7]Bakker H,Routier F,Oelmann S,et al. Molecular cloning of two Arabidopsis UDP-galactose transporters by complementation of a deficient Chinese hamster ovary cell line[J]. Glycobiology,2005,15(2):193-201.
[8]Rollwitz I,Santaella M,Hille D,et al. Characterization of AtNST-KT1,a novel UDP-galactose transporter from Arabidopsis thaliana[J]. FEBS Letters,2006,580(17):4246-4251.
[9]Handford M,Rodríguez-Furlán C,Marchant L,et al. Arabidopsis thaliana AtUTr7 encodes a golgi-localized UDP-glucose/UDP-galactose transporter that affects lateral root emergence[J]. Molecular Plant,2012,5(6):1263-1280.
[10]Seino J,Ishii K,Nakano T,et al. Characterization of rice nucleotide sugar transporters capable of transporting UDP-galactose and UDP-glucose[J]. Journal of Biochemistry,2010,148(1):35-46.
[11]蘇 莹,杜 强,郭崇炎,等. 水稻OsURGT1基因的生物信息学及表达谱分析[J]. 华北农学报,2020,35(5):1-10.
[12]梁诗涵,李 境,周 达,等. 中国苦荞主产区苦荞种质形态性状的遗传多样性分析[J]. 分子植物育种,2020,18(21):7254-7266.
[13]国旭丹,王超楠,张 婧,等. 苦荞抗氧化性与生长条件的相关性[J]. 中国粮油学报,2019,34(3):19-23,37.
[14]李 俊,卢 扬,赵 刚,等. 苦荞芽苗茶饮料发酵前后营养、风味及抗氧化活性的变化[J]. 食品与机械,2019,35(7):187-192.
[15]Reyes F,León G,Donoso M,et al. The nucleotide sugar transporters AtUTr1 and AtUTr3 are required for the incorporation of UDP-glucose into the endoplasmic reticulum,are essential for pollen development and are needed for embryo sac progress in Arabidopsis thaliana[J]. The Plant Journal,2010,61(3):423-435.
