鼠李糖乳杆菌通过调节肠道微生物群缓解造血干细胞移植后肝脏移植物抗宿主病
2021-09-11房婷,李响,刘洁,王皓
房 婷,李 响,刘 洁,王 皓
(中国人民解放军第960医院 1.血液病科; 4.普外科,山东 济南 250031; 2.中国人民解放军93381部队医院,黑龙江 五常 150223; 3.常州市第二人民医院 血液内科,江苏 常州 213000)
移植物抗宿主病(graft-versus-host disease,GVHD)是造血干细胞移植(hematopoietic stem cell transplantation,HSCT)后的主要并发症,严重影响患者的生活质量,也是导致非复发死亡的重要原因[1]。它主要累及皮肤、肝脏、肾脏和消化道等,其中肝脏是除皮肤之外最常受累的靶器官[2]。肠道微生物群在HSCT后GVHD的发生发展中起重要作用。研究表明,GVHD小鼠中微生物群落多样性降低,且与GVHD严重程度显著相关[3]。GVHD发生时肠道微生物多样化水平降低,口服乳酸杆菌能够减轻GVHD症状及相关死亡率[4]。鼠李糖乳杆菌GG菌株(LactobacillusrhamnosusGG strain,LGG)从属于乳杆菌属,是从人肠道中分离而得的重要益生菌。近年来,研究证明LGG能够耐受消化道环境,并且能够在肠道内定植,起到调节肠道微生物群的作用[5-6]。然而LGG对HSCT后GVHD肝脏损伤影响的研究还较少。本研究以GVHD小鼠为研究对象,研究了LGG对GVHD肝脏损伤的影响,为GVHD的临床干预提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级雄性C57BL/6小鼠,8周龄,体质量22~25 g为供鼠,相同特征的BALB/C小鼠为受鼠(上海斯莱克实验动物责任有限公司)。
1.1.2 主要试剂:鼠李糖乳杆菌(LactobacillusrhamnosusCICC No.6001,冻干粉,中国食品发酵工业研究院);ELISA试剂盒(武汉华美生物工程有限公司);苏木精和伊红(HE)溶液(珠海贝索生物技术有限公司);粪便DNA提取试剂盒(北京天根生化科技有限公司)。
1.2 方法
1.2.1 小鼠的分组及处理:GVHD组和LGG组小鼠在移植前1周饮用含抗生素的饮用水(32万U/L庆大霉素及0.25 g/L头孢曲松钠)。在移植前4 h,接受60Co(cobalt-60) γ射线全身照射7.5 Gy,剂量率为0.67 Gy/min。将供体C57BL/6小鼠处死后在超净工作台上取胫、股骨骨髓及脾脏,制备骨髓细胞(5×106个)和脾细胞(1×106个)的单细胞悬液。通过尾静脉回输BALB/C受体小鼠诱导GVHD。骨髓移植后,LGG组小鼠行LGG溶液灌胃,200 μL/次,2次/周,连续灌胃5周。对照组和GVHD组给予同等剂量0.9%氯化钠溶液。
1.2.2 临床特征观察:移植后每天观察小鼠的精神状态、毛色、饮食情况和排便情况等。每周称量体质量1次,记录死亡情况。动态观察至术后8周。
1.2.3 肝脏功能和炎性因子的检测:在术后第36天(即5周灌胃结束后),每组各取4只小鼠,先麻醉,之后摘取眼球采血,用ELISA试剂盒检测血浆中谷丙转氨酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransaminase,AST)、IL-6、IL-18和TNF-α的含量。
1.2.4 肝脏病理的检测:将肝脏组织常规石蜡包埋切片,行HE染色,于光镜下观察各组受鼠肝脏组织病理变化及炎性反应细胞浸润情况。肝脏病理评分参照以往标准[7]。
1.2.5 PCR检测小鼠肠道微生物群:先麻醉小鼠,处死后,解剖出小鼠大肠,挤出新鲜粪便,置于无菌离心管中冻存。按照粪便DNA提取试剂盒说明抽提各组小鼠的粪便总DNA,储存于-20 ℃。以提取到的DNA为模板,对16S rDNA的V3及V4区进行PCR扩增。引物为:338正向:5′-ACTCCTACGGGA GGCAGCAG-3′; 806反向:5′-GGACTACHVGGGTW TCTAAT-3′。扩增结束后,用琼脂糖凝胶回收PCR产物,电泳后对条带亮区切胶回收,用Quanti FluorTM-ST检测定量,然后利用Illumina MiSeq测序仪测序。上机测定完成之后,进行数据提取和合并。数据处理后比对Greengenes数据库,随后进行α多样性分析和肠道微生物群门属水平种类与丰度的多样性分析。
1.3 统计学分析

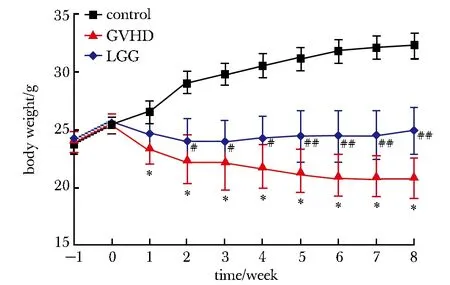
*P<0.01 compared with the control group; #P<0.05, ##P<0.01 compared with the GVHD group图1 各组小鼠体质量变化曲线Fig 1 Curves of body weight change in mice of
2 结果
2.1 小鼠一般状况及生存率
移植1周后,GVHD组小鼠呈现精神萎靡及进食减少的表征;2周后呈现弓背及毛发干枯呈倒钩状,还有部分小鼠尾部皮肤脱落;3周后上述表现逐渐加重。LGG组小鼠在移植后3周前的状态与GVHD组类似,而3周后上述症状明显减轻。此外,移植后,GVHD组和LGG组小鼠体质量均出现明显下降,其中GVHD组小鼠体质量下降更为明显(图1)。LGG组小鼠体质量在移植2周后下降趋势趋于停止,且高于GVHD组(P<0.05)。GVHD组小鼠在移植后第14天开始出现死亡,死亡高峰期为移植后14~22 d;而LGG组小鼠仅在移植后第15天出现1例死亡,其生存时间长于GVHD组(P<0.05)(图2)。

图2 各组小鼠移植后生存率比较Fig 2 Comparison of survival rates in mice of each group after transplantation
2.2 肝功能的检测
移植后,GVHD组小鼠血浆ALT及AST/ALT值显著高于对照组(P<0.01)。相比GVHD组,LGG组血浆ALT(P<0.01)及AST/ALT值(P<0.05)显著降低(图3)。
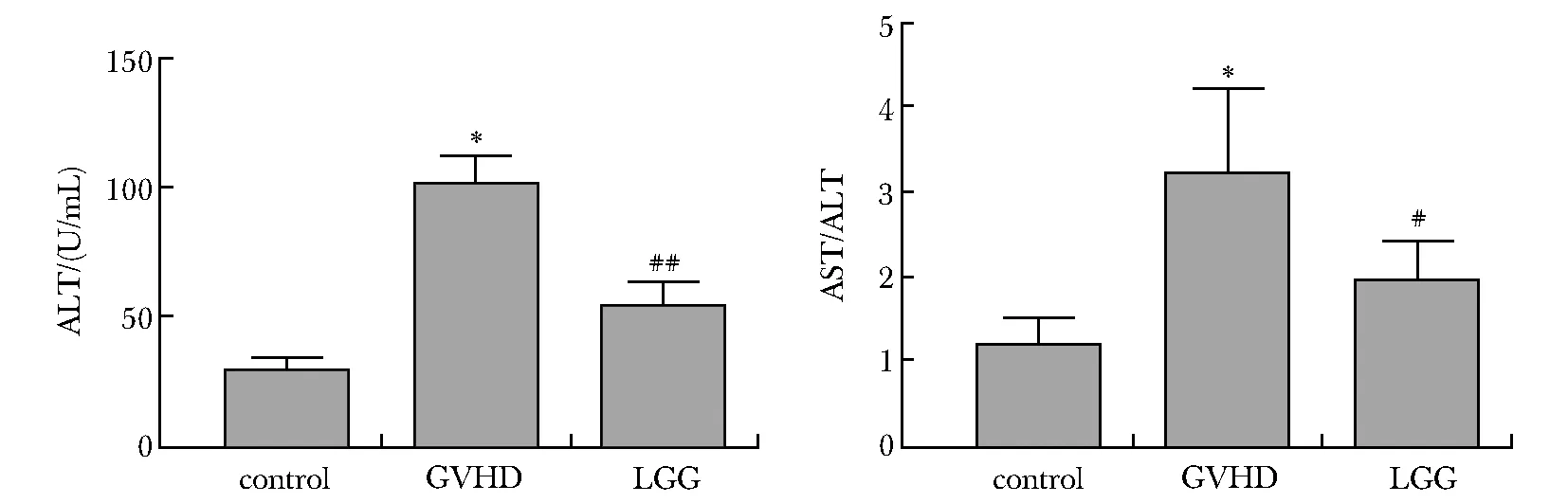
*P<0.01 compared with the control group; #P<0.05, ##P<0.01 compared with the GVHD group图3 各组小鼠血浆ALT水平及AST/ALT值的比较Fig 3 Comparison of plasma ALT levels and AST/ALT values in mice of each n=4)
2.3 肝组织的病理
对照组小鼠肝组织形态正常(图4A)。GVHD组小鼠肝组织出现大量肝细胞水肿、增生和坏死,以及大量炎性细胞如淋巴细胞及中性粒细胞浸润(图4C)。LGG组小鼠肝脏表现出一定程度的肝细胞水肿和坏死,然而其血窦纤维化明显减轻,且浸润的炎性细胞明显减少(图4B)。此外,GVHD组的肝病理学评分显著高于对照组(P<0.01),而LGG组肝病理评分显著低于GVHD组(P<0.01)(表1)。
表1 各组小鼠肝组织病理学评分
2.4 细胞因子
GVHD组血浆中IL-1β、IL-18及TNF-α的相对含量显著高于对照组(P<0.01);与GVHD组相比,LGG组血浆中IL-1β、IL-18及TNF-α的相对含量显著降低(P<0.01)(图5)。
2.5 肠道微生物群相关检测
2.5.1 α多样性指数:GVHD组shannon指数明显低于对照组(P<0.05);LGG组shannon指数明显高于GVHD组(P<0.05)(表2)。
表2 各组小鼠肠道微生物群α多样性指数Table 2 Alpha diversity index of intestinal microbiota in each group of n=4)
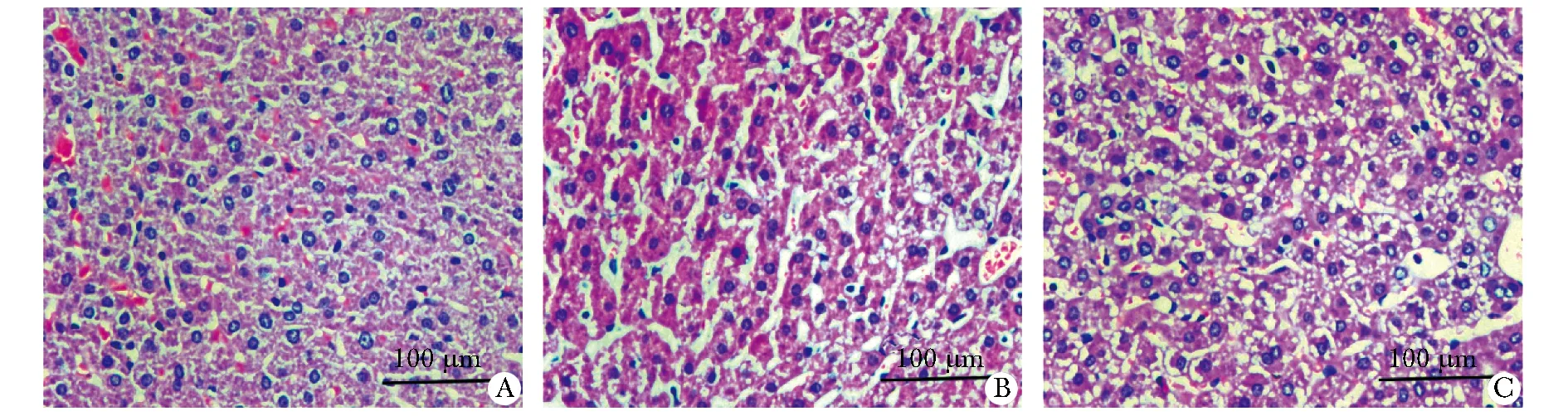
A.control; B.GVHD; C.LGG图4 移植36 d后小鼠肝组织病理变化Fig 4 Pathological changes of liver tissue in mice 36 days after transplantation(×200)
2.5.2 肠道微生物群在门水平上的结构组成:小鼠肠道微生物群在门水平上主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和变形菌门(Proteobacteria)组成。其中丰度相对较高的是拟杆菌门、厚壁菌门和放线菌门。移植后,小鼠肠道微生物群中拟杆菌门水平降低,放线菌门水平升高;经LGG灌服后,拟杆菌门水平升高,放线菌门水平降低(表3)。
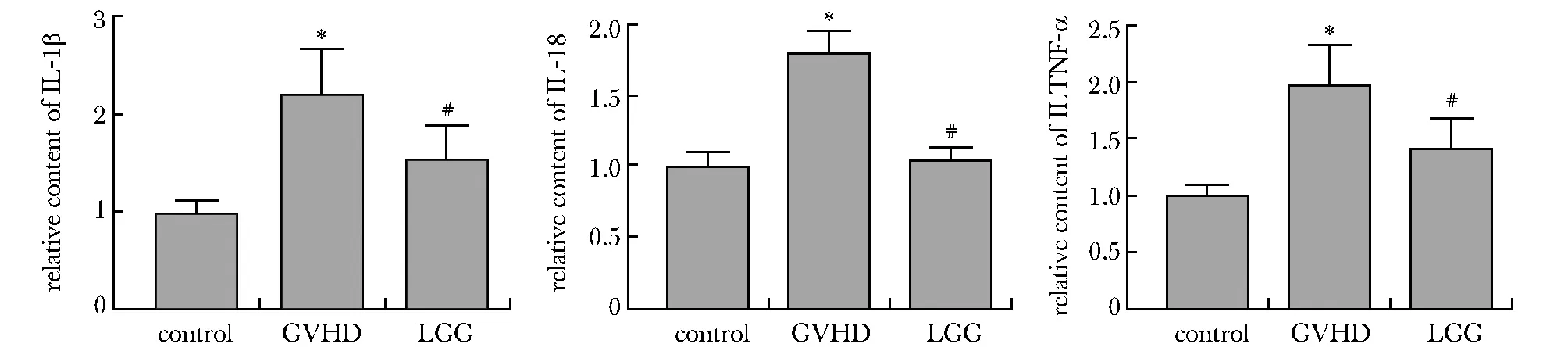
*P<0.01 compared with the control group; #P<0.01 compared with the GVHD group图5 各组小鼠血浆IL-1β、IL-18和TNF-α水平Fig 5 Plasma levels of IL-1β, IL-18, and TNF-α in each group of n=4)
表3 各组小鼠肠道微生物群在门水平上的组成Table 3 Composition of intestinal microbiota at the phylum level in each group of n=4)
3 讨论
GVHD是制约HSCT术后临床疗效的重要因素之一,其中累及肝脏的发生率为26.4%[8]。肠道微生物群是肠道微生物在肠道中形成的复杂群落。研究证实肠道微生物群会影响GVHD的发生与发展。一项动物实验发现:HSCT后GVHD小鼠肠道中微生物群落多样性降低,炎性细胞因子增多;且肠道微生物多样化水平越低,GVHD越严重[9]。一项多中心临床试验显示,HSCT后GVHD患者十二指肠的帕内特细胞减少,且帕内特细胞越少,治疗效果越差[10]。在本研究中,GVHD组小鼠肝功能受损,肝组织呈现明显炎性浸润,炎性因子水平升高,且肠道微生物群的多样性下降,说明GVHD诱发的损伤减少了肝脏中肠道微生物群的多样性。
益生菌是一类可以改善宿主微生态平衡的细菌,而益生元则是肠道中为益生菌提供养料的物质。益生菌和益生元在维持胃肠道稳态方面起重要的调节作用[11]。研究表明,益生菌改善微生态平衡的作用机制包括抑制病原体、促进免疫应答、上调抗炎因子、重构微生物群和保护肠道屏障等[12]。LGG是第三代益生菌,其黏着率高、定植力强。在干细胞移植前后口服LGG可提高生存率并降低急性GVHD的发生[13]。在本研究中发现,经LGG灌服的小鼠生存时间延长,肠道微生物群的多样性升高,小鼠肝功能受损程度和炎性浸润程度减轻,说明LGG可能是通过改善肠道微生物群,介导抗炎作用进而改善肝脏GVHD。
综上,本实验发现鼠李糖乳杆菌可通过调节肠道微生物群,减轻肝脏炎性因子水平进而缓解肝脏GVHD。相关调控机制还需进一步地探讨和验证。
