益生菌改善高脂高糖饲养诱导的肥胖小鼠脂代谢紊乱
2021-09-11李真真刘惠双
黄 婷,李真真,白 杨,刘惠双
(郑州市第七人民医院 1.内分泌科; 2.营养科,河南 郑州 450016)
随着社会经济的发展,人们生活习惯和饮食结构的改变,全世界范围内,尤其是儿童青少年人群中肥胖发生率逐年上升[1]。肥胖(obesity)是由多种因素相互作用导致能量和代谢紊乱,为引起糖尿病、冠心病等多种疾病的重要危险因素,已成为威胁人类健康的公共卫生问题[2]。肠道微生物群是人体最大的微生态系统,与肥胖、遗传、胰岛功能障碍等密切相关,其中嗜酸乳杆菌、鼠李糖乳杆菌、嗜热链球菌、双歧杆菌是常见的肠道益生菌(probiotics),可通过调节肠道微生物群缓解高脂高糖饮食引起的肥胖,是近年来治疗因肥胖引起的脂代谢紊乱的潜在方案[3]。而AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)介导的自噬途径参与肥胖引起的脂代谢紊乱,激活该通路可通过促进自噬,减轻肝脏脂肪积累[4],Ⅲ型纤连蛋白结构域5可通过上调AMPK/mTOR介导的小鼠肝细胞自噬和脂肪酸氧化,减少脂肪生成,减轻肝高脂血症[5]。但益生菌是否通过调控AMPK/mTOR通路介导的自噬改善肥胖小鼠脂代谢紊乱,目前尚未有研究。本研究通过构建高脂高糖诱导的肥胖小鼠模型,并使用益生菌和AMPK抑制剂Dorsomorphin进行干预,旨在从AMPK/mTOR通路揭示益生菌对肥胖小鼠脂代谢紊乱的改善作用,为益生菌对肥胖引起脂代谢紊乱的治疗提供理论参考。
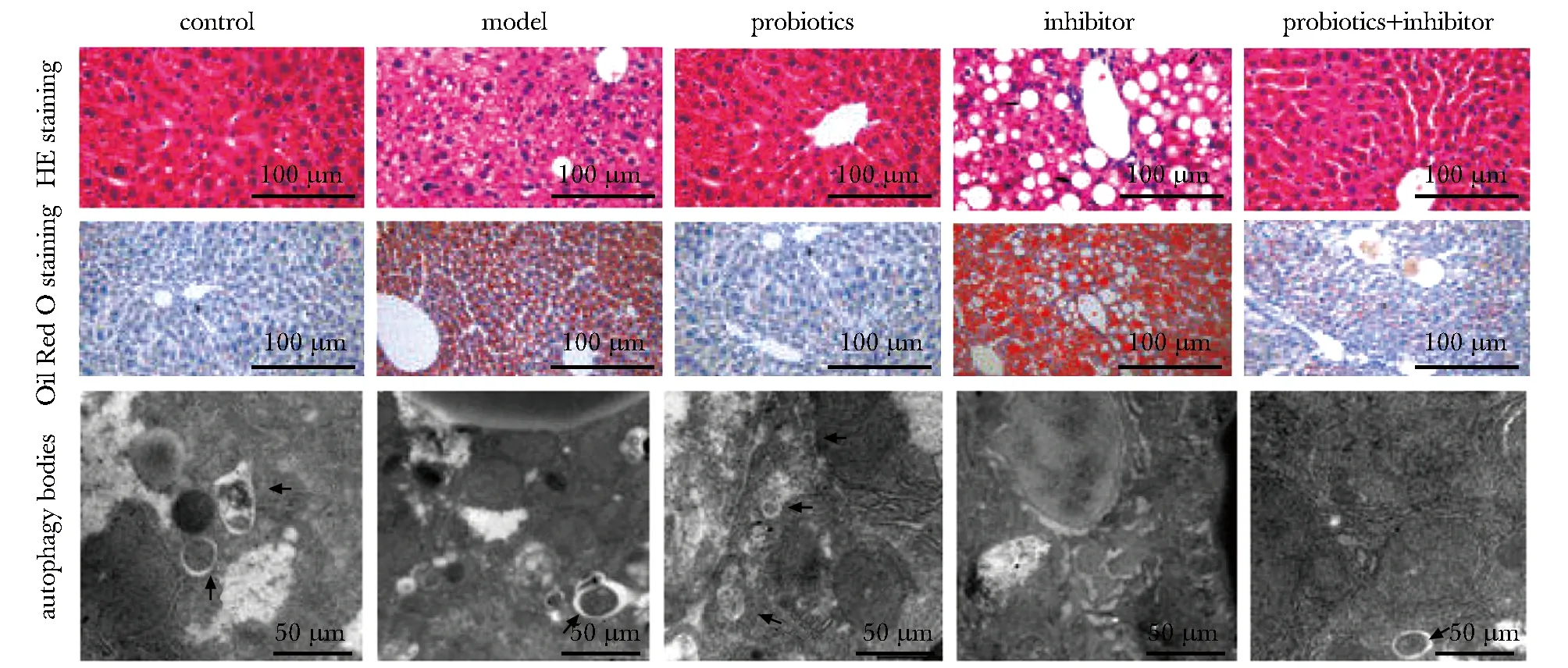
the black arrow indicated autophagosome图1 各组小鼠肝脏组织病理学、脂肪蓄积及自噬小体比较Fig 1 Liver histopathology, fat accumulation and autophagy bodies of mice in each group
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级C57BL/6J小鼠(50只,3~4周龄,雄性,体质量13~15 g)[大连医科大学,许可证号:SCXK(辽)2018-0003]。按照3R原则给予实验动物人道的关怀照顾。
1.1.2 益生菌及药物:本研究所用益生菌种(嗜酸乳杆菌、鼠李糖乳杆菌、嗜热链球菌、双歧杆菌)(大连医科大学微生物教研室);Dorsomorphin(又名compound C,是一种选择性,ATP竞争性AMPK抑制剂)(MedChemExpres公司)。
1.1.3 主要试剂:普通饲料和高脂高糖饲料(北京博泰宏达生物技术有限公司);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和β-actin鼠抗(Sigma-Aldrich公司);蛋白提取试剂盒、ECL显色试剂盒和BCA蛋白定量试剂盒(北京中杉金桥生物科技有限公司);4%多聚甲醛和2.5%戊二醛溶液(武汉塞维尔生物科技有限公司);油红O染液(北京索莱宝生物科技有限公司);醋酸铀、枸橼酸铅、苏木精、伊红染液(上海生工生物科技有限公司);SREBP-1c、LC3、Beclin1、AMPK、mTOR、p-AMPK、p-mTOR鼠抗、辣根过氧化物酶标记羊抗鼠IgG二抗(Abcam公司)。
1.2 方法
1.2.1 小鼠的分组及处理:小鼠适应性饲养1周后,将小鼠随机分为对照组,模型组、益生菌组(益生菌培养至对数期后,进行菌落计数,每种菌各以2×109CFU的菌液进行灌胃)、抑制剂组(AMPK抑制剂Dorsomorphin[6],静脉注射1次,剂量为10 mg/kg)、益生菌+抑制剂组(每种菌各以2×109CFU的菌液进行灌胃前30 min,静脉注射Dorsomorphin 1次,剂量为10 mg/kg),每组10只,对照组和模型组分别注射和灌胃等量溶剂。其中对照组小鼠以普通饲料饲喂,其余各组小鼠以高脂高糖饲料饲喂。所有小鼠均自由摄食饮水,饲养环境相对湿度50%~60%,明暗周期12 h,温度23 ℃~25 ℃,连续饲养6周,每隔1周记录小鼠体质量。
1.2.2 全自动生化分析仪检测血清血脂:取尾静脉血,2 000 r/min,离心10 min后取血清,采用全自动生化分析仪检测各组小鼠血清中总胆固醇(total cholesterol,TC)、三酰甘油(triacylglyceride,TAG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)的含量。并分离肝脏组织,等分成4份,分别置于4%多聚甲醛、OCT包埋剂、2.5%戊二醛及-80 ℃冰箱中待用。
1.2.3 HE染色观察各组小鼠肝脏组织病理学变化:取上述1.2.2中使用4%的多聚甲醛固定24 h的肝组织,行常规苏木精-伊红染色后,置于光学显微镜下观察并拍照。
1.2.4 油红O染色观察各组小鼠肝脏组织中脂肪蓄积情况:取上述1.2.2中使用OCT包埋剂包埋的肝组织进行切片,行常规油红O染色后,将切片置于光学显微镜下,观察脂滴并拍照,脂滴呈橘红色至鲜红色。
1.2.5 透射电子显微镜观察各组小鼠肝脏组织中自噬小体:取上述置于2.5%戊二醛中固定2~4 h后的肝组织,使用0.1 mol/L磷酸缓冲液冲洗3次,制作常规超薄切片(60~80 mm),用2%醋酸铀和枸橼酸铅各染色15 min,室温干燥过夜,透视电子显微镜观察肝脏组织自噬小体。
1.2.6 Western blot检测各组小鼠肝脏组织中LC3、Beclin、SREBP-1c、AMPK、mTOR蛋白表达:使用蛋白提取试剂盒提取-80 ℃冰箱中的各组肝脏组织总蛋白。使用BCA蛋白定量试剂盒进行定量,然后进行SDS-聚丙烯酰胺凝胶电泳(PAGE)、转PVDF膜、5%脱脂奶粉封闭、1∶2 000浓度稀释后的LC3、Beclin、SREBP-1c、AMPK、mTOR、p-AMPK、p-mTOR、β-actin鼠抗4 ℃过夜孵育、含辣根过氧化物酶缀合的二抗(1∶5 000)中室温孵育2 h,用ECL显色试剂盒显色,β-actin为内参,全能型凝胶成像分析系统分析蛋白表达水平。
1.3 统计学分析

2 结果
2.1 各组小鼠体质量变化比较
与对照组相比,模型组小鼠体质量均升高(P<0.05);与模型组相比,益生菌组小鼠体质量均降低(P<0.05),抑制剂组小鼠体质量均升高(P<0.05);与益生菌组相比,益生菌+抑制剂组小鼠体质量均升高(P<0.05);与抑制剂组相比,益生菌+抑制剂组小鼠体质量均降低(P<0.05)(表1)。
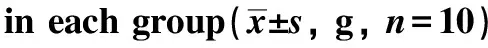
表1 各组小鼠体质量变化比较
2.2 各组小鼠血脂水平比较
与对照组相比,模型组小鼠TC、TAG和LDL升高,HDL降低(P<0.05)。与模型组相比,益生菌组小鼠TC、TAG和LDL降低,HDL升高(P<0.05);抑制剂组小鼠TC、TAG和LDL升高,HDL降低(P<0.05)。与益生菌组相比,益生菌+抑制剂组小鼠TC、TAG和LDL升高,HDL降低(P<0.05);与抑制剂组相比,益生菌+抑制剂组小鼠TC、TAG和LDL降低,HDL升高(P<0.05)(表2)。
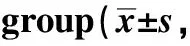
表2 各组小鼠血脂水平比较Table 2 Comparison of blood lipid levels of mice in each mmol/L, n=10)
2.3 各组小鼠肝脏组织病理变化、脂肪蓄积及自噬小体比较
对照组小鼠肝脏组织着色均匀,无明显脂肪空泡,无脂肪蓄积。与对照组相比,模型组小鼠肝脏组织出现明显的空泡,细胞核染色加深,出现大量脂肪蓄积,自噬小体数目减少。与模型组相比,益生菌组小鼠肝脏组织着色趋于均匀,脂肪空泡减少,脂肪蓄积不明显,自噬小体数目增多;抑制剂组小鼠肝脏组织脂肪空泡增多且变大,出现严重脂肪蓄积,自噬小体数目减少。益生菌+抑制剂组较益生菌组脂肪空泡增多和蓄积现象加重,较抑制剂组减轻,自噬小体数目较益生菌组减少,较抑制剂组增多(图1)。
2.4 各组小鼠肝脏组织中脂代谢相关蛋白SREBP-1c、自噬相关蛋白LC3、Beclin1蛋白表达水平及AMPK和mTOR蛋白磷酸化水平比较
与对照组相比,模型组小鼠SREBP-1蛋白表达及mTOR磷酸化水平升高,LC3和Beclin1蛋白表达及AMPK磷酸化水平降低(P<0.05)。与模型组相比,益生菌组小鼠SREBP-1c蛋白表达及mTOR磷酸化水平降低,LC3和Beclin1蛋白表达及AMPK磷酸化水平升高(P<0.05); 抑制剂组小鼠SREBP-1c蛋白表达及mTOR磷酸化水平升高,LC3和Beclin1蛋白表达及AMPK磷酸化水平降低(P<0.05)。与益生菌组相比,益生菌+抑制剂组小鼠SREBP-1c蛋白表达及mTOR磷酸化水平升高,LC3和Beclin1蛋白表达及AMPK磷酸化水平降低(P<0.05);与抑制剂组相比,益生菌+抑制剂组小鼠SREBP-1c蛋白表达及mTOR磷酸化水平降低,LC3和Beclin1蛋白表达及AMPK磷酸化水平升高(P<0.05)(图2)。
3 讨论
肥胖是当今人类最普遍的健康问题之一。本研究通过构建小鼠肥胖模型,发现模型组肥胖小鼠发生脂代谢紊乱且肝脏组织自噬减弱。肠道微生物群与肥胖两者可通过遗传、代谢等机制相互作用。其中乳酸菌和双歧杆菌能够诱导骨髓充质干细胞的自噬激活,参与益生菌保护作用[7]。有实验证明益生菌对高脂肪饮食引起的小鼠代谢紊乱的保护作用[8],但脂代谢相关蛋白SREBP-1c表达的升高可加重肝脂质积累[9]。本研究通过使用益生菌干预肥胖小鼠,发现益生菌可改善肥胖小鼠脂代谢紊乱,提高肝脏细胞自噬,但其中的机制并未完全阐明。
噬在脂质代谢中发挥重要作用,山茶酚可能通过AMPK/mTOR介导的自噬,使肝组织脂质存储减少、自噬小体增加[10]。酰基转移酶可通过AMPK/mTOR途径诱导自噬,从而减轻脂肪毒性[11]。醋氨酚可通过抑制AMPK通路,激活mTOR途径, 从而抑制自噬,加重非酒精性脂肪性肝病中脂肪堆积[12];红莲孢菌素龙胆二糖苷可通过激活AMPK信号通路,降低肥胖小鼠体质量,抑制脂质积累[13]。激活AMPK可通过负调控mTOR通路促进自噬,减轻脂肪毒性。成纤维细胞生长因子21(FGF21)通过抑制AMPK/mTOR信号通路刺激胰岛细胞自噬[14],这与上述研究并不一致。但是,关于自噬与细胞及疾病关系一直是争论的焦点,细胞既可通过提高自噬减少细胞坏死,减轻有毒物质的积累,又可通过主动降低自身自噬活性,减少因自噬引起的细胞死亡[15]。本研究发现益生菌可能通过激活AMPK通路,负调控mTOR,促进肝细脏自噬,改善肥胖小鼠脂代谢紊乱。进一步探讨发现益生菌对肥胖小鼠肝细脏自噬的促进作用及对脂代谢的改善作用可被AMPK抑制剂Dorsomorphin逆转,进一步揭示益生菌可能通过AMPK/mTOR通路提高自噬,改善肥胖小鼠脂代谢紊乱。

1.control group; 2.model group; 3.probiotics group; 4.inhibitor group; 5.probiotics+inhibitor group;*P<0.05 compared with the control group; #P<0.05 compared with the model group; △P<0.05 compared with the probiotics group; ▲P<0.05 compared with the inhibitor group
综上所述,益生菌可能通过激活肥胖小鼠肝脏组织中AMPK,进而负调控mTOR通路,促进自噬,减轻肝脏脂质积累,改善脂代谢紊乱。但是益生菌对肥胖小鼠脂代谢紊乱的作用机制较复杂,尚需后续深入研究。
