miR-141-3p通过靶向PDCD1抑制人胃癌细胞系AGS的迁移与侵袭
2021-09-11侯楠,刘源,高俊,王晶
侯 楠,刘 源,高 俊,王 晶
(南阳市第二人民医院 胃肠肿瘤科,河南 南阳 473000)
胃癌(gastric cancer,GC)是全球第五常见的癌,且由胃癌造成的死亡成为仅次于肺癌,为第二常见的癌相关死因[1]。目前,尽管在GC的治疗策略方面取得了明显进展,但GC的预后仍不太理想[2]。GC的预后不良与GC的转移密切相关,因此,研究影响GC转移的关键分子靶点具有重要意义。
微RNA(microRNAs,miRNAs)是一类短的非编码RNA,在众多肿瘤的发生和进展中发挥重要作用。miR-141-3p是miR-200家族的成员之一,在前列腺癌、结直肠癌和膀胱癌等肿瘤组织中呈下调趋势,且其发挥抑癌作用[3-5]。已有报道[6]表明,miR-141-3p能抑制GC细胞增殖,但其对胃癌细胞侵袭性的影响并不清楚。因此,本研究关注miR-141-3p对GC细胞迁移与侵袭的影响,并分析其中的机制。
1 材料与方法
1.1 材料
1.1.1 细胞系与主要试剂:人胃黏膜细胞系(GES-1)和人胃癌细胞系(AGS)(中科院昆明细胞库);胎牛血清(FBS)(Life Technologies公司);Dulbecco改良Eagle培养基(DMEM)(Gibco公司);miR-141-3p的模拟物(miR-141-3p mimic)和miRNA的阴性对照(miR-NC)(苏州吉玛基因股份有限公司);程序性细胞死亡蛋白1(programmed cell death protein 1,PDCD1)过表达的慢病毒载体(LV-PDCD1)和空载体(LV-vector)(上海汉恒生物技术有限公司);Lipofectamine 2000试剂(Invitrogen公司);miRcute miRNA分离试剂盒、miRcute miRNA cDNA第一链合成试剂盒和miRcute miRNA RT-qPCR检测试剂盒(北京天根生化科技有限公司);BCA蛋白定量试剂盒(江苏凯基生物技术股份有限公司);荧光素酶报告基因载体、报告质粒和双荧光素酶试剂盒(Promega公司);PDCD1抗体(Abcam公司);RIPA裂解液、HRP耦合的二抗和超敏ECL发光试剂盒(上海碧云天生物科技有限公司)。
1.1.2 组织样本:收集南阳市第二人民医院2018年7月至2019年12月收治并接受胃癌根治术的患者的肿瘤组织和对应的癌旁非肿瘤组织(距侵润边缘约2 cm组织,病理形态学正常的非肿瘤组织),共计19例。本研究经南阳市第二人民医院医学伦理委员会批准(批准号:20180412013),所有患者均签署知情同意书。
1.2 方法
1.2.1 细胞培养和转染:将GES-1和AGS细胞分别培养在含有10% FBS的DMEM中,并置于保持恒温37 ℃和含5% CO2的细胞培养箱中。在细胞处于对数期时,收集细胞。
按照说明书步骤,用Lipofectamine 2000试剂分别将miR-141-3p mimic和miR-NC转入AGS细胞。用RT-qPCR鉴定转染效率后,收集细胞用于后续实验。
1.2.2 RT-qPCR检测miR-141-3p表达:用miRcute miRNA分离试剂盒分别提取样本组织、GES-1和AGS细胞的miRNAs。然后用miRcute miRNA cDNA第一链合成试剂盒对miRNA进行反转录。最后取反转录产物和各目的引物,用miRcute miRNA RT-qPCR检测试剂盒在ABI 7500型RT-qPCR系统上进行RT-qPCR反应。反应条件为94 ℃预变性5 min,然后进行30个循环(94 ℃ 30 s,54 ℃ 1 min和72 ℃ 1 min)。本实验所用的引物序列为:miR-141-3p正向序列: 5′-GTCGTATCCAGTGCAGGGTCCGAGGTATT CGCACTGGATACGACTCCAAC-3′,miR-141-3p反向序列: 5′-GGCGCATCTTCCAGTACAGT-3′;U6正向序列:5′-CTCGCTTCGGCAGCACA-3′,U6反向序列:5′-AACGCTTCACGAATTTGCGT-3′。反应结束后,用U6作为内部对照,用2-ΔΔCt方法分析miR-141-3p的相对表达量。
1.2.3 Transwell小室法实验检测细胞的迁移与侵袭:分别将已转染miR-141-3p mimic和miR-NC的AGS细胞的悬浮液(5×104个/mL,100 μL)添加到铺有基质胶的滤膜(检测细胞侵袭)或未铺基质胶的滤膜(检测细胞迁移)的Transwell板的上腔室中,然后将600 μL含10% FBS的DMEM添加到每个孔的下腔室中。孵育24 h后,将这些细胞用0.5%结晶紫溶液中染色30 min,并用湿棉签除去上腔室中的细胞,随后在显微镜下观察并随机取6个视野拍照。用Image J软件对每个视野下的细胞进行计数。
1.2.4 荧光素酶报告基因验证miR-141-3p与PDCD1是否具有靶向关系:Targetscan(http://www.targetscan. org/)显示,miR-141-3p与PDCD1 mRNA的3′-UTR区存在潜在的结合位点。将包含PDCD1的3′UTR的DNA片段以及点突变DNA片段分别克隆到荧光素酶报道载体质粒中,然后分别将报告质粒和miR-141-3p minic或miR-NC共转入AGS细胞。转染48 h后,使用双荧光素酶试剂盒测定萤光素酶含量。
1.2.5 Western blot检测PDCD1的蛋白表达:用RIPA缓冲液裂解细胞并提取蛋白质。蛋白质经BCA试剂盒定量后,用等量蛋白质进行电泳。然后通过电转法将电泳分离的蛋白转移至PVDF膜上。封闭PVDF后,室温孵育一抗(PDCD1,1∶2 000;GAPDH,1∶8 000)1.5 h,然后洗膜后,室温孵育HRP耦合的二抗1 h。再次洗膜后,通过增强ECL发光试剂将目的印迹可视化并显影至于胶片。用Image J软件分析条带的吸光度值,并以GAPDH为内部对照,计算目的蛋白的相对表达量。
1.2.6 LV-PDCD1和LV-vector感染:取已转染miR-141-3p mimic的AGS细胞,根据说明书步骤,将LV-PDCD1和LV-vector分别感染该细胞。简言之,感染前1 d,将贴壁细胞以1×105个/孔铺到24孔板中,次日,用含6 μg/mL聚凝胺的2 mL新鲜培养基替换原培养基,加入适量病毒悬液继续培养48 h。并分别取转染miR-141-3p mimic+LV-PDCD1、LV-PDCD1+LV-vector或miR-141-3p mimic的细胞,用Transwell小室法检测细胞的转移与侵袭。
1.3 统计学分析
2 结果
2.1 miR-141-3p在GC组织和GC细胞中低表达
miR-141-3p在GC组织中的表达显著低于癌旁非肿瘤组织(P<0.001),其在AGS细胞中的表达也显著低于GES-1细胞(P<0.001)(图1)。
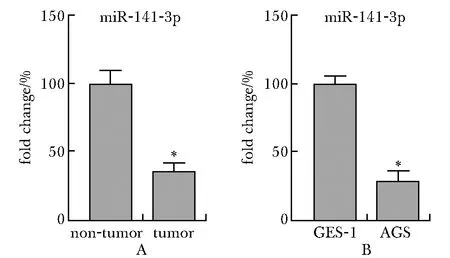
A.expression level of miR-141-3p in the non-tumor and tumor tissues (n=19); B.expression level of miR-141-3p in GES-1 cells and AGS cells (n=4); *P<0.001 compared with non-tumor tissues or GES-1 cells图1 miR-141-3p在GC组织和细胞中低表达Fig 1 Lower expression of miR-141-3p in GC tissues and GC
2.2 过表达miR-141-3p抑制AGS细胞的迁移和侵袭
与miR-NC组比较,miR-141-3p mimic组细胞中miR-141-3p表达明显升高(P<0.001),迁移和侵袭明显降低(P<0.001)(图2)。
2.3 PDCD1是miR-141-3p的直接靶基因
PDCD1-3′UTR与miR-141-3p具有高度保守的结合位点;miR-141-3p mimic显著降低了AGS细胞中野生型PDCD1的荧光素酶活性(P<0.01),但突变体PDCD1未观察到该结果。与miR-NC组比较,miR-141-3p mimic组细胞中PDCD1的蛋白表达水平明显降低(P<0.01)(图3)。
2.4 miR-141-3p通过靶向PDCD1来抑制AGS细胞的迁移和侵袭
与miR-141-3p mimic+LV-vector组比较,miR-141-3p mimic+LV-PDCD1组AGS细胞的迁移和侵袭能力明显增强(P<0.01)(图4)。
3 讨论
GC细胞的迁移与侵袭能力不仅能直接影响GC患者的转移还能影响GC的预后。近来研究发现,有众多miRNAs能参与调控GC细胞的迁移与侵袭[7-8]。然而,miRNAs的数量众多,依然有许多参与调控GC细胞的迁移与侵袭的miRNAs未能发现或充分鉴定,且已发现的参与调控GC细胞的迁移与侵袭的miRNAs可能在维持机体正常生理活动中发挥重大作用[7-8]; 因此, 仍需进一步对能影响GC细胞的迁移与侵袭的miRNAs进行筛选和鉴定。本研究发现,miR-141-3p在GC组织和GC细胞中低表达,而过表达miR-141-3p能抑制AGS细胞迁移与侵袭,提示,过表达miR-141-3p可能是潜在的抗GC转移的策略。
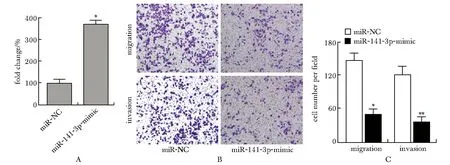
A.after transfected of miR-141-3p mimic or miR-NC into AGS cells, the expression level of miR-141-3p were detected; B.representative images of cell migration and invasion(×200); C.cell migration and invasion count; *P<0.01,**P<0.001 compared with the miR-NC group

A.binding site of miR-141-3p and PDCD1 predicted by bioinformatics software; B.results of dual luciferase reporter gene analysis of miR-141-3p and PDCD1; C.after over-expression of miR-141-3p, the protein expression level of PDCD1 in AGS cells; *P<0.01 compared with the miR-NC group
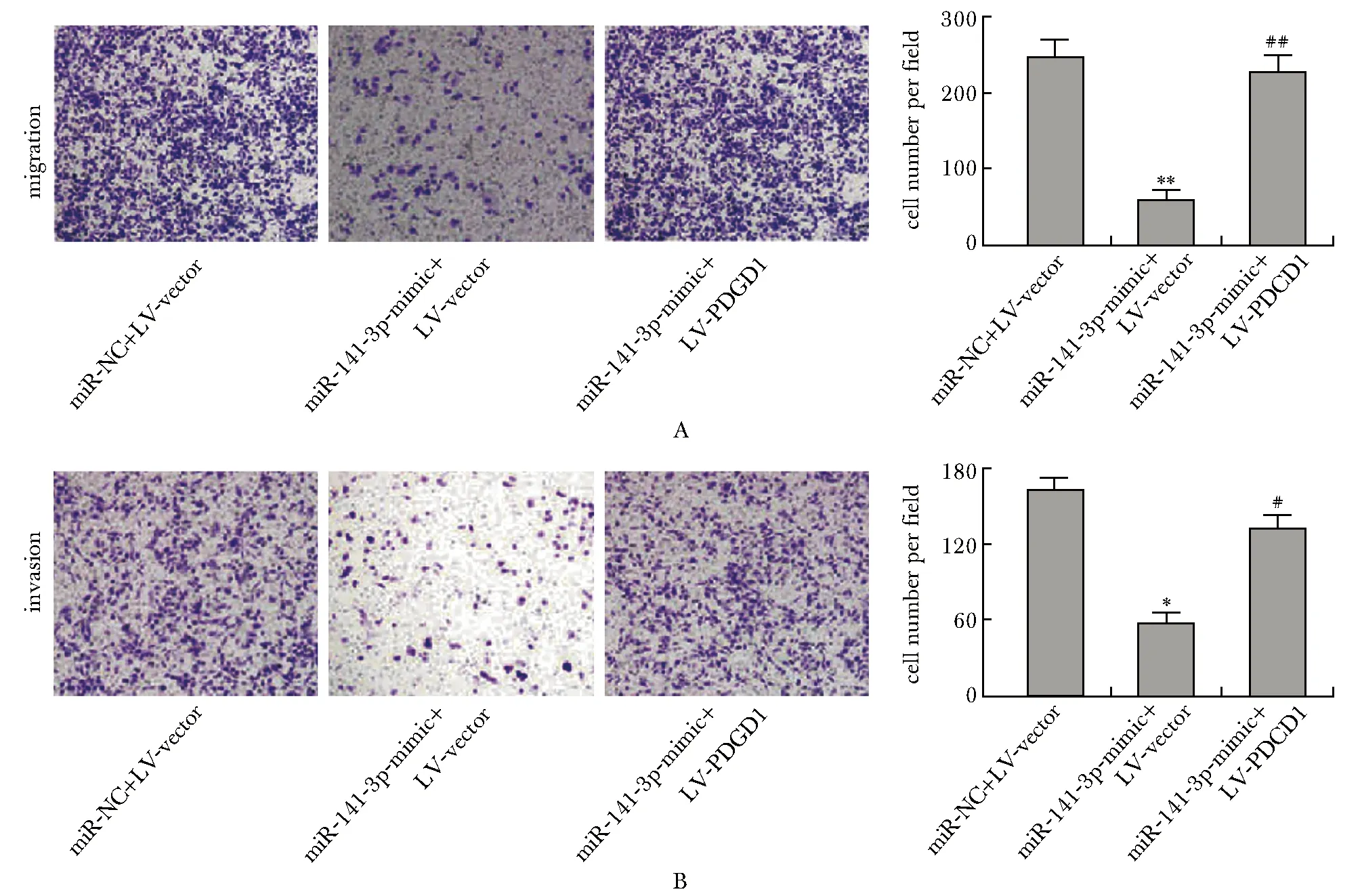
A.representative images of cell migration and migratory cell count; B.representative images of cell invasion and invasive cell count; *P<0.01, **P<0.001 compared with the miR-NC+LV-vector group; #P<0.01 compared with the miR-141-3p mimic+LV-vector group
miRNA一般是通过与靶基因的3′-UTR区通过碱基配对模式结合,并在转录后水平发挥生物学效应。本研究采用靶基因预测软件发现,miR-141-3p与PDCD1 mRNA的3′-UTR区存在潜在的结合位点。PDCD1是一种免疫球蛋白,主要在活化的CD4+/CD8+T细胞、B淋巴细胞、自然杀伤(natural killer,NK)细胞和髓样细胞的表面上表达[9]。迄今越来越多的证据[10-11]表明,PDCD1在肿瘤细胞也广泛表达,且其可有助于肿瘤细胞逃避免疫监视,从而提高了肿瘤细胞的迁移与侵袭能力。miR-141-3p是miR-200家族成员,而miR-200家族是PDCD1潜在调节剂。许多研究[12-13]表明了miR-200家族成员和PDCD1在肿瘤和免疫细胞上的表达水平之间的相关性。因此,需进一步研究miR-141-3p与PDCD1之间的潜在关系,本研究通过荧光素酶法表明PDCD1是miR-141-3p的靶基因,且过表达miR-141-3p能抑制PDCD1表达。已有研究[14]表明,抑制PDCD1能抑制GC细胞的增殖和转移能力。这些结果提示,过表达miR-141-3p对AGS细胞的迁移与侵袭的抑制作用可能是通过抑制靶基因PDCD1的表达来实现的。为证明这一推测,本研究进一步通过转染LV-PDCD1观察其对已过表达miR-141-3p的AGS细胞迁移与侵袭的影响,发现LV-PDCD1能几乎逆转过表达miR-141-3p对AGS细胞迁移与侵袭的抑制作用,这一结果充分说明了,miR-141-3p是通过下调靶基因PDCD1来抑制AGS细胞的迁移与侵袭。
综上所述,本研究表明上调miR-141-3p可通过抑制PDCD1表达来抑制GC细胞迁移和侵袭,这些发现可能为GC的治疗提供新的思路。
