介孔二氧化硅包载香叶木素对IL-1β诱导的大鼠体外骨关节炎的作用研究
2021-09-10何明为韦庆军
何明为 韦庆军

摘要:目的:对比MSNs@DM和单纯DM对IL-1β诱导的大鼠软骨细胞炎症损伤的作用。方法:提取5天龄的SD乳鼠的软骨细胞进行培养,分为空白对照组(Control),骨关节炎组(OA),香叶木素组(DM),载药组(MSNs@DM),分别处理24小时后,行HE染色观察各组大鼠的细胞形态及数量,并提取各组大鼠的总RNA,行qRT-PCR检测相关炎症的表达。结果:与OA组相比,DM组和MSNs@DM组细胞形态较接近于Control组;在细胞数量上,MSNs@DM组和DM组均比OA组多,而且MSNs@DM组相较于DM组多。MSNs@DM组相关炎症指标基因的表达均低于OA组(P<0.05)和DM组(P<0.05)。结论:MSNs@DM相比于单纯DM更能有效维持IL-1β诱导的大鼠体软骨细胞炎症损伤的形态,并抑制相关炎症基因的表达,对骨关节炎有积极的治疗作用。
关键词:介孔二氧化硅;香叶木素;软骨细胞;骨关节炎
【中图分类号】R-03 【文献标识码】A 【文章编号】2107-2306(2020)01-026-02
骨关节炎(osteoarthritis, OA)是一种以关节软骨退行性改变为特征的疾病,会引起关节疼痛、僵硬、压痛和活动范围缩小等,是常见的肌肉骨骼疾病之一[1]。目前治疗OA的方式有止痛药物(如扑热息痛和非甾体抗炎药)、手术等[2]。然而这些治疗仅能缓解症状,很难延缓OA的发展。有研究表明,香叶木素(diosmetin, DM)具有较强的抗炎、抗氧化作用[3],是治疗OA的潜力药物;但是由于DM水溶性差、不利于吸收的特点,药物的实际利用率较低。介孔结构的二氧化硅纳米颗粒(mesoporous silica nanoparticles, MSNs),由于具有极高的比表面积和孔径体积,已被作为药物缓释载体应用于生物医学研究中[4]。因此,本研究以MSNs为载体负载DM(MSNs@DM),研究其对IL-1β诱导的大鼠体外骨关节炎的影响,为今后进一步研究新型的OA治疗方式提供实验依据。
1.材料与统计学方法
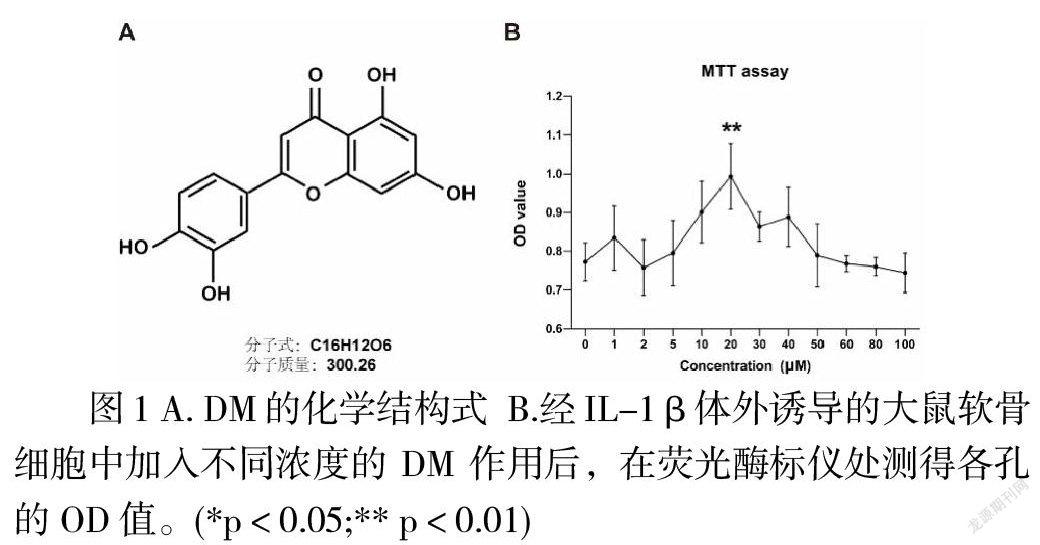
1.1 材料 动物为5天龄SD乳鼠,由广西医科大学动物实验中心提供。主要试剂:MSNs、DM(化学结构式如图1A)购于麦克林公司(http://www.macklin.cn/);高糖培养基、胰蛋白酶、双抗、MTT和HE染色试剂盒购买于北京索来宝公司(http://www.solarbio.com/);PCR引物合成于武汉金开瑞生物公司;胎牛血清购买于Gibco公司。主要仪器:全波长荧光酶标仪(Thermo,美国);正置荧光显微镜(Olympus,日本),PCR仪(light-cycler,美国)。
1.2 统计学方法 以SPSS 22.0统计软件处理数据,并以(均数±标准差)呈示。组间比较采用One-way ANOVA,两两比较采用LSD检验,P<0.05被认为差异具有统计学意义。
2.方法与结果
2.1 DM对IL-1β体外诱导的大鼠软骨细胞炎症损伤的作用
提取SD乳鼠原代软骨细胞进行培养至第3代。将软骨细胞接种于96孔板,每孔5×103个细胞,放置于37℃培养箱中培养。待细胞完全贴壁后,先加入含有不同浓度DM的高糖培養基(含10%胎牛血清和1%双抗)作用2小时,随后更换含有相同浓度DM的高糖培养基(含IL-1β 10ng/mL,10%胎牛血清和1%双抗)。作用24小时后,分别向每孔培养基中加入20μL的MTT,继续置于培养箱中4小时后弃掉多余培养基,加入200μL DMSO并避光孵育15-20分钟。最后用全波长荧光酶标仪在570nm处测定光密度值(OD value)。结果如图1B所示,DM在20μM 时,对经IL-1β体外诱导的大鼠软骨细胞保护效果最佳。
2.2 MSNs@DM对IL-1β体外诱导的大鼠软骨细胞炎症损伤的作用
为对比MSNs@DM和DM对IL-1β (10ng/mL)体外诱导的大鼠软骨细胞的作用,我们以MSNs作为药物载体,按照等效浓度为20μM的量将DM载入MSNs中得到含20μM 的MSNs@DM。之后,我们将第3代软骨细胞分别接种在6孔板(50×103个/孔)及24孔板(10×103个/孔)爬片中,分别为Control组,OA组,DM组,MSNs@DM组。按如前所述分组分别加入含不同药物成分的培养基作用2小时后,更换含有相应药物成分的且含有IL-1β (10ng/mL)的高糖培养基。在干预24小时后,我们分别取出各组细胞爬片,用PBS缓冲液冲洗3遍后以多聚甲醛在室温下固定20分钟,之后进行HE染色。染色结果如图2,苏木素将细胞核染成蓝色,伊红将细胞质染成红色。同OA组对比,我们发现DM组和MSNs@DM组细胞形态和数量更接近于Control组;并且OA组的细胞形态狭长且数量减少,说明IL-1β能诱导软骨细胞的炎症损伤。此外,我们还从6孔板中提取了各组细胞的总RNA并进行qRT-PCR检测了炎症因子的表达(MMP3、MMP13和IL6)。本研究所用引物:MMP3(上游:GGCTGTGTGCTCATCCTACC;下游:TGGAAAGGTACTGA AGCCACC);MMP13(上游:GGACAAAGACTATCCCCGCC;下游:GGCATGACTCTCACAATGCG); IL6(上游: ACAAGTCCGGAGA GGAGACT;下游: ACAGTGCATCATCGCTGTTC);GAPDH(上游:TCCAGTATGACTCTACCCACG;下游:CACGACATACTCA GCACCAG)。PCR结果如图3所示:与Control组对比,炎症指标MMP3、MMP13和IL6均明显升高(p<0.05)。而对比DM组,MSNs@DM组的炎症指标表达更低(p<0.05)。以上结果提示MSNs@DM组比DM组更能有效抑制IL-1β诱导的软骨细胞损伤。
3.讨论
OA是全球老年人最常见的关节疾病,也是慢性肌肉骨骼疼痛和行动不便的主要原因[5]。目前对于OA尚无最佳的治疗方式,OA进展到晚期需要进行关节置换术才能减轻疼痛和改善身体功能。因此,寻找能延缓OA进展的方式将能为临床治疗提供指导性意义。
研究表明,IL-1β可引起软骨细胞中的基质金属蛋白酶类MMPs、IL6、TNF-α等炎症因子合成、分泌及活性增加[6],导致软骨细胞基质降解进而导致关节软骨的退变,最终发展为骨关节炎。DM是天然黄酮类化合物的一种,广泛存在于甘菊蓝、紫草和薄荷等天然植物中,具有抗炎、抗氧化、抗休克等功效[7]。有研究报道,DM可通过抑制破骨细胞的分化,降低软骨下骨的丢失,进而对小鼠的骨关节炎有一定的治疗作用[8]。然而,由于裸露在细胞外环境中的DM水溶性差,易被细胞外环境所代谢,以致细胞的药物吸收率降低。因此,本研究使用具有缓释作用的药物载体MSNs包载DM,可以实现药物载细胞外环境中的缓慢释放,是之持续有效地对细胞起到保护作用。本实验研究发现,IL-1β (10ng/mL)诱导后的软骨细胞其炎症指标如MMP3、MMP13和IL6等表达量明显增加。而在DM作用后,其炎症指标有所降低,我们的研究结果除了进一步验证了DM对软骨细胞验证损伤的保护作用之外,我们还发现了经MSNs包载的DM,对软骨细胞的验证损伤效果比单纯药物DM的治疗更佳,提示了MSNs可作为药物载体包载药物并运用在体外骨关节炎的治疗中。
综上所述,MSNs@DM比单纯DM对IL-1β诱导的体外软骨细胞的损伤的保护作用更佳,能为OA的治疗提供新的思路。
参考文献:
[1]Xiao, L., D. Williams, and M.M. Hurley, Inhibition of FGFR Signaling Partially Rescues Osteoarthritis in Mice Overexpressing High Molecular Weight FGF2 Isoforms. Endocrinology, 2020. 161(1).
[2]王晶璐, 黄芩素对IL-1β诱导的骨关节炎软骨细胞NF-κB信号通路的影响. 东北农业大学.
[3]Patel, K., et al., A Review on Pharmacological and Analytical Aspects of Diosmetin:A Concise Report. Chinese Journal of Integrative Medicine, 2013. 2(10): p. 46-52.
[4]Wahba, S.M.R., et al., Sugarcane bagasse lignin, and silica gel and magneto-silica as drug vehicles for development of innocuous methotrexate drug against rheumatoid arthritis disease in albino rats. Materials Science & Engineering C. 48: p. 599-610.
[5]Chen, Y., et al., Association between bisphosphonate use and risk of undergoing knee replacement in patients with osteoarthritis. Annals of the Rheumatic Diseases, 2018. 78(2): p. annrheumdis-2018-212998.
[6]He, Y., et al., Costunolide inhibits matrix metalloproteinases expression and osteoarthritis via the NFkappaB and Wnt/betacatenin signaling pathways. Mol Med Rep, 2019. 20(1): p. 312-322.
[7]Cameron, M. and S. Chrubasik, Oral herbal therapies for treating osteoarthritis. 2013.
[8]丁洪志, et al., 香葉木素通过抑制破骨细胞分化治疗早期骨关节炎的可行性研究. 实用药物与临床, 2019. 22(10): p. 1023-1029.
基金项目:广西研究生教育创新计划项目(YCSW2019109)
(1.广西生物医药协同创新中心 广西南宁 530021;2 广西医科大学第一附属医院 创伤骨科手外科 广西南宁 530021)
