不同粒径悬移质泥沙对邻苯二甲酸二正丁酯的吸附特性
2021-09-10冉艳何强袁若愚代国义李宏
冉艳 何强 袁若愚 代国义 李宏


摘 要:为了解不同粒径悬移质泥沙(SPM)对邻苯二甲酸二正丁酯(DBP)的吸附行为,比较不同粒径SPM对DBP的吸附性能差异并确定导致其差异的潜在原因,选取三峡库区库尾一级支流御临河的原位SPM,并利用湿筛自然沉降的物理方法将原位SPM分成黏土极细粉砂(<8 μm)、细粉砂(8~20 μm)、中粉砂(20~32 μm)、粗粉砂(32~63 μm)和砂(>63 μm)5个粒级,采用批量平衡法研究DBP在不同粒级SPM上的吸附行为。结果表明:分配作用是各粒级SPM吸附DBP的主要机制,各粒级SPM对DBP吸附能力由强到弱依次为:黏土极细粉砂>细粉砂>中粉砂>粗粉砂>砂。总有机碳(TOC)是影响各粒级SPM对DBP吸附的主要因素。此外,黏土极细粉砂粒级SPM中有机质的物质组成差异可能是导致其对DBP高吸附量的原因;就砂质SPM而言,其比表面积、孔容和有机质腐殖化程度也会影响SPM对DBP的吸附能力。
关键词:邻苯二甲酸二正丁酯;悬移质泥沙;粒径;吸附;总有机碳
Abstract: In order to understand the adsorption behavior and evaluate the adsorption performance of dibutyl phthalate (DBP) by different grain-sized suspended particulate matter (SPM), and identify the potential mechanism, the adsorption of DBP by different grain-sized SPM was studied by batch equilibrium method.The in-situ SPM that collected from the Yulin River of the tributary of the Three Gorges Reservoir area, was sorted into five grain-sized fractions (clay-very fine silt (<8 μm), fine silt (8~20 μm), medium silt (20~32 μm), coarse silt (32~63 μm) and sand (>63 μm)) via physical method of wet screening and natural settling in this study. The results showed that partition was the main mechanism of removal of DBP by SPM from the solution, and the adsorption capacity of different grain-sized SPM for DBP follows: clay-fine sand > fine sand > medium sand > coarse sand > sand. Total organic carbon (TOC) was the main factor affecting the partition of DBP by different grain-sized SPM. In addition, the difference of organic matter composition in clay-very fine silt SPM may be the reason for its high adsorption capacity for DBP. The specific surface area, pore volume and humification degree of organic matter affect its adsorption of DBP by silt-sand SPM.
Keywords: dibutyl phthalate; suspended particulate matter; grain size; adsorption; total organic carbon
鄰苯二甲酸酯(Phthalates esters, PAEs)是一类由邻苯二甲酸酐与相应醇类在酸催化剂作用下通过酯化反应生成的有机化合物[1],其主要功能是提高各类塑料制品的延展度和柔韧度。由于PAEs仅通过氢键和范德华力结合在塑料分子上,呈游离态,不可避免地从塑料制品迁移到环境中[2]。PAEs作为一类典型的环境激素类污染物,可通过食物链在不同营养级传递并呈现出生物富集的效应[3],且大量研究[3-6]表明,PAEs对水生生物、陆生生物及人类具有肝肾毒性、生殖毒性和“三致”毒性。随着PAEs的广泛应用,中国诸多地区的土壤、水体、沉积物、大气及大气悬浮颗粒等都受到不同程度的污染[7-10],其中Wang等[11]在长江干流武汉段监测发现5种主要PAEs污染物的总浓度为0.034~91.22 μg/L,主要污染物邻苯二甲酸二异辛酯(Di(2-ethylhexyl) phthalate, DEHP)和邻苯二甲酸二正丁酯(Dibutyl phthalate, DBP)的浓度分别高达54.73、35.65 μg/L,远高于中国《地表水环境质量标准》(GB 3838—2002)对地表水中DEHP(≤8.00 μg/L)和DBP(≤3.00 μg/L)浓度的限制要求。
与此同时,在三峡库区水体、沉积物和消落带土壤等介质中都检出了不同水平的PAEs。有研究[12-14]表明,三峡库区的PAEs污染物主要为DEHP和DBP为主。杨婷等[14]通过结合PAEs的日均摄入量,指出在三峡库区消落带区域应重点预防DBP带来的潜在健康风险。PAEs的理化性质会影响其在环境中的迁移转化,随着支链长度的增加,其疏水性、固水分配系数会随之增加,使其水溶性更低,更易吸附在固体介质上[3],从而对水生生物产生不同程度的影响。Chen等[15]通过72 h斑马鱼胚胎毒性试验,发现DBP的LC50为0.63 mg/L,然而DEHP在最高可溶性浓度下,暴露胚胎的死亡率也不会超过50%。
悬移质泥沙(Suspended particulate matter,SPM)颗粒小、相对比表面积大、孔隙度高,能吸附较多的污染物。Chen等[16]监测发现,江苏镇江的三大城市河流(运粮河、古运河和京杭大运河)的SPM中PAEs含量有明显的季节变化规律,且SPM中PAEs含量都普遍高于沉积物中PAEs含量;此外,由于SPM的理化性质使得其易受水动力条件的影响,从而对水质安全产生“三个维度”的影响[17-19]:首先,随着水体的流动,吸附了大量污染物的SPM会被运输到河流下游,从而对下游的水质安全产生潜在的威胁;其次,在水动力较小时SPM会沉降到河床表面,一旦水动力条件改变或受到底栖动物扰动,吸附了大量污染物的SPM会再次悬浮于河流水体中,产生“二次污染”;最后,SPM不仅能吸附大量污染物,而且在外界环境变化时,也会向环境中释放出一定量的污染物,实现从污染物的“汇”到“源”的转变,且总是处于动态变化中。
目前的研究主要集中在土壤、沉积物、生物炭和腐殖质及其各类单体等对PAEs的吸附作用上,关于SPM对PAEs吸附特性研究较少,且河流水体中的SPM具有较大的异质性,不同粒级SPM间的有机质组成、颗粒物矿物组成和其他理化性质差别均很大[20]。因此,笔者选取三峡库区库尾一级支流御临河的SPM,采用物理方法进行粒径分级后,研究了不同粒级SPM对DBP的吸附行为;比较了5种不同粒级SPM对DBP的吸附性能差异并探究了其潜在原因,为揭示DBP污染物的迁移转化及其对人类健康的潜在风险提供理论依据。
1 材料与方法
1.1 供试试剂和悬移质泥沙
邻苯二甲酸二正丁酯标准品(DBP),纯度>98%,购于上海麦克林生化科技有限公司;甲醇(色谱纯);氯化钙(优级纯);叠氮化钠(分析纯);丙酮(分析纯);正己烷(分析纯);水(Milli-Q超纯水)。主要仪器包括马尔文激光粒度分析仪(S3500,美国Microtrac公司);恒温振荡器(THZ-98AB,上海一恒科学仪器有限公司);高效液相色谱(HPLC,Agilent 1260系列,美国);总有机碳分析仪(TOC-L,日本岛津制作所株式会社);元素分析仪(Unicube,德国Elementar);全自动比表面积和孔径分析仪(Quadrasorb 2MP,美国Quantachrome);傅立叶红外光谱仪(Nicolet IS 10,美国Thermofinnigan);X射线衍射仪(Empyrean,荷兰PANalytical B.V.)。
原位SPM采集于三峡库区上游支流御临河河口太洪岗附近(29°39′34″N, 106°52′54″E),样品中PAEs背景浓度可忽略不计。原位SPM均经风干、研磨、过2 mm筛后储存在棕色试剂瓶中,直至后续试验与分析。原位SPM基本理化性状如表1所示。
1.2 粒径分级
采用湿筛自然沉降方法对原位SPM进行粒径分级,分为5个粒径级别[21]:黏土极细粉砂(<8 μm)、细粉砂(8~20 μm)、中粉砂(20~32 μm)、粗粉砂(32~63 μm)和砂(>63 μm)。基本步骤为:首先,将100 g SPM加入250 mL去離子水中,充分振荡,保证其均匀分散。采用湿筛法分离出砂(>63 μm)和粗粉砂(32~63 μm),并根据Livens等[22]的分级方法将剩余泥水混合物(<32 μm)转移到1 000 mL的量筒中,通过搅拌重新悬浮,待沉淀一定时间后收集量筒顶部10 cm的泥水混合物,补充去离子水至刻度线再一次搅拌、悬浮、沉淀和收集,直至上清液较澄清。其中经自然沉降待收集黏土极细粉砂(<8 μm)和细粉砂(8~20 μm)SPM的时间间隔分别为45、10 min,剩余底部泥沙为中粉砂(20~32 μm)。取适量分级样品对其进行激光粒径分析,确保其分级效果。最后将以上分级收集的泥水混合物过0.45 μm滤膜,并用陶瓷小刀刮取收集滤膜上的泥沙,并对其进行冷冻干燥,后存于棕色玻璃瓶中备用。
1.3 吸附试验
吸附实验采用批量吸附平衡法。称取各粒级SPM(黏土极细粉砂0.1 g、细粉砂0.1 g、中粉砂0.1 g、粗粉砂0.3 g、砂0.3 g)置于25 mL玻璃离心管中,加入20 mL用0.01 mol/L CaCl2溶液配制的不同浓度梯度的DBP溶液,并加入NaN3使其浓度为200 mg/L,其中CaCl2用于支持离子背景强度,NaN3用于抑制微生物生长。各粒级SPM悬浊液中DBP的初始浓度梯度为0、1、2、3、4、5、6 mg/L。通过0.5 M NaOH溶液和0.5 M HCl溶液调节体系初始pH为7.0±0.1。拧紧盖子,放置于恒温振荡器中,在25 ℃下避光以160 r/min振荡72 h(该试验条件下DBP的表观平衡时间通过预实验确定)。振荡结束后,以6 000 r/min离心20 min,取上清液待测。该过程中同时选定两种空白试验:SPM空白和DBP空白,以扣除试验过程中挥发和容器吸附损耗造成的误差。
测试条件:检测柱为ODS-C18色谱柱(250 mm×4.6 mm,Agilent);检测波长226 nm;流动相为甲醇和超纯水,比例为80%∶20%;流速为1 mL/min;柱温为30 ℃;进样体积为20 μL。
试验所用玻璃器皿均在丙酮中浸泡至少30 min,后用正己烷冲洗,并在120 ℃下干燥至少4 h后使用,以避免玻璃器皿上的潜在PAEs污染物影响试验结果。
1.4 分析数据
2 结果与讨论
2.1 悬移质泥沙的粒径分级及其理化性质
2.1.1 试样悬移质泥沙粒径分布及其粒径分选
天然河流中的SPM往往是由大小不等的非均匀砂组成的。通过马尔文激光粒度仪分析,得出原位SPM以及湿筛自然沉降法分选后各粒级SPM在对数概率坐标上的级配曲线,如图1所示。在对数概率坐标纸上,横坐标为对数坐标,而纵坐标则是按照正态分布的规律刻制的,使符合正态分布的累积分布曲线在对数概率坐标纸上均呈直线。由图1可知,原位SPM粒径分布在对数概率坐标上趋近于一条直线,近似符合正态分布,其中中值粒径d0.5为14.81 μm(d0.1=3.67 μm、d0.9=65.76 μm)。试验中经湿筛自然沉降法对原位SPM进行粒径分级,黏土极细粉砂、细粉砂、中粉砂和粗粉砂粒级的分布曲线无明显凹凸,较符合正态分布;且曲线的坡度较陡,说明分选砂样粒径较为集中,粒级分级效果较好。其中黏土极细粉砂粒级SPM中值粒径为d0.5=3.28 μm(d0.1=0.89 μm、d0.9=9.26 μm)、细粉砂粒级SPM中值粒径为d0.5=7.78 μm(d0.1=2.75 μm、d0.9=18.51 μm)、中粉砂粒级SPM中值粒径为d0.5=15.57 μm(d0.1=6.54 μm、d0.9=31.12 μm)、粗粉砂粒级SPM中值粒径为d0.5=41.01 μm(d0.1=22.00 μm、d0.9=62.23 μm)、砂粒级SPM中值粒径为d0.5=62.33 μm(d0.1=13.06 μm、d0.9=148.54 μm)。
部分粒级SPM分级不完全,存在粒径重叠,可能是因为原位SPM粒级分选过程中未投加任何化学分散剂,只采用了物理的分散方法而存在分散不完全的现象;而且某些粒级之间级差较小,难免存在粒径部分重合的现象。
2.1.2 各粒级SPM的理化性质
由马尔文激光粒度分析结果可知,试验中采用的湿筛自然沉降法对SPM进行粒径分选,效果较好,所得的各粒级SPM适用于后续试验。为了结合吸附等温线试验来分析影响各粒级SPM吸附DBP能力的潜在因素,首先对各粒级SPM进行基本理化性质表征,其中主要包括有机元素定性分析、比表面积及孔径分析、傅立叶红外光谱分析和X射线衍射分析。
由表2可知,各粒级SPM中TOC含量由高到低依次为砂>极细粉砂黏土>细粉砂≈中粉砂>粗粉砂,其中砂的TOC含量为28.57 g/kg,高于其他粒级SPM的TOC含量。这可能是由于砂粒级SPM的总碳含量较高,约为其他粒级SPM总碳含量的2倍,这与该粒级SPM的C含量相对最多的结果吻合。(O+N)/C比通常用于表征物质极性,H/C代表其芳香性[23],随着粒级的增加,SPM的极性和芳香性呈现降低趋势;且各粒级SPM的极性都明显强于芳香性。
傅立叶红外光谱图提供了更多的SPM结构信息。如图2所示,各粒级SPM的光谱图之间并没有明显的吸收峰数和吸收区域范围的差异。各粒级SPM在400~900 cm-1范围有不同程度的吸收峰,这可能是由不同粒级SPM中硅酸盐和溶解性腐殖质含量差异所导致的[24]。1 030 cm-1处对应于酚类和醇类或羧基C—O基团的拉伸振动峰或Si—O不对称拉伸振动峰。在1 434、1 636 cm-1的吸收峰分别对应芳香C=C和R—C=C[25],其中,黏土极细粉砂粒级SPM在1 636 cm-1处的吸收峰明显高于其他粒级SPM的吸收峰,表明黏土极细粉砂粒级中可能含有较多的芳香R—C=C。
各粒级SPM的比表面积、孔容、质地及矿物组成如表3所示,各粒级SPM的比表面积由高到低依次为:极细粉砂黏土>细粉砂>中粉砂>砂>粗粉砂,而孔容由高到低依次为:极细粉砂黏土>细粉砂>砂>中粉砂>粗粉砂。在中粉砂、粗粉砂和砂粒级SPM中,砂粒级SPM含有相对较多的黏粒组分(表3),由于黏粒组分的比表面积和孔容都相对较大,导致砂粒级SPM存在略大于或接近其余两粒级SPM的比表面积和孔容。通过X射线衍射仪得到各粒级SPM的衍射图谱(图3),并结合MDI Jade (6.0) 软件进行物相分析,从而得到各粒级SPM的矿物组成。各粒级SPM矿物组成如表3所示,其中SPM主要矿物有石英、白云母、绿泥石、方解石和伊利石等。在黏土极细粉砂粒级SPM中,在黏土极细粉砂的矿物组成中,石英含量相对减少,绿泥石和白云母成为主要矿物组分,此外还存在一定含量的伊利石,其物理化学风化和生物作用程度更高、颗粒更加细小,这与该粒级下的比表面积(28.57 m2/g)和孔容(0.096 cm3/g)远高于其余粒级的比表面积和孔容的结果一致。
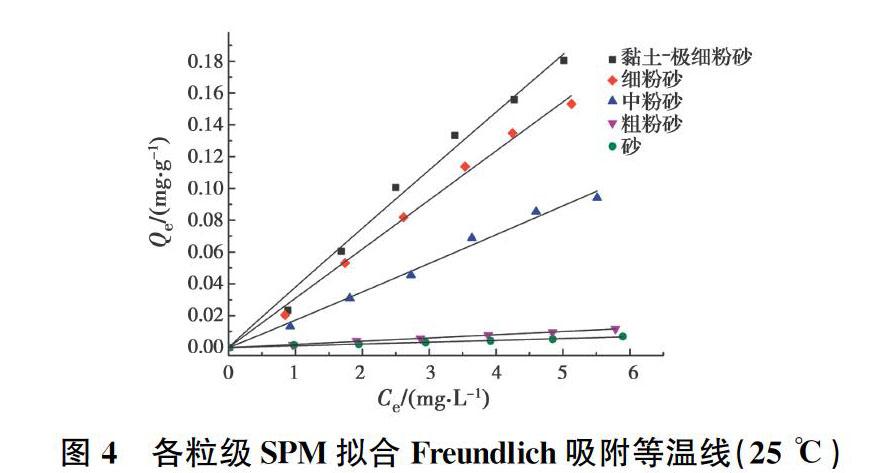
当n值等于1时,Freundlich方程可以简化成一个线性关系式,从而表现出线性吸附的特征。由表4可知,虽然黏土极细粉砂和细粉砂粒级SPM表现出一定程度的非线性吸附特征(n略大于l),但由于程度较小,说明分配作用仍是SPM吸附DBP的主要机理[26]。其中黏土极细粉砂和细粉砂粒级SPM关于DBP的吸附指数n分别为1.019 5±0.075 7、1.002 4±0.054 3,表现出一定程度的非线性特征,这是由黏土极细粉砂和细粉砂粒级SPM的理化性质导致的。一方面,这两粒级SPM中含有相对多的黏土矿物(表3),而黏土矿物的表面吸附作用也会导致非线性吸附[27-28];另一方面,研究发现天然有机质中的腐殖质可分为玻璃态腐殖质和橡胶态腐殖质,其中玻璃态腐殖质包括油母岩质、黑炭以及呈现玻璃态的胡敏素、富里酸等,而玻璃态腐殖质的存在会增加其非线性[29-31]。此外,随着各粒级SPM的(O+N)/C比的增加,n值出现增加的趋势,表明SPM的极性基团促进了DBP线性吸附,这与Rutherford等[32]的研究结果一致。
疏水性有机污染物吸附能力的强弱与土壤的有机碳含量存在明显正相关[33-34]。通常用吸附常数Kf表示吸附程度大小。由表2和表4可知,各粒级SPM与DBP的吸附等温线试验可得出相似的结论。随着TOC的增加,各粒级SPM对DBP吸附常数Kf呈现出增加的趋势,且各粒级之间的吸附程度有明显差别,各粒级SPM对DBP吸附能力由强到弱依次为:黏土极细粉砂>细粉砂>中粉砂>粗粉砂>砂。
如图2所示,在400~900 cm-1范围内,黏土极细粉砂粒级SPM中存在明显大于其他粒级的吸收峰,这可能是与该粒级中含有较高含量的硅酸盐和溶解性腐殖质有关,且其芳香性R—C=C的含量也较其他粒级高。有研究[35-36]表明,溶解性腐殖酸是以芳香碳为疏水内核、以脂肪链及分布在脂肪链上的极性官能团为亲水外壳的类胶束结构,其中随着芳香碳含量的增加,类胶束结构的疏水内腔更紧致、更大,為有机污染物提供更多的空间和吸附位点,从而提高腐殖质对有机污染物的结合能力。因此推断,在黏土极细粉砂粒级中也含有较多的类胶束结构的溶解性腐殖质,其相对较高含量的芳香性R—C=C的存在使得疏水内腔更紧致、更大,进而提高了黏土极细粉砂粒级SPM对DBP的吸附能力。
如表2和表4所示,随着TOC含量的增加,各粒级SPM对DBP吸附能力有增大的趋势。在细粉砂和中粉砂粒级SPM中,细粉砂的TOC含量略低于中粉砂,细粉砂粒级SPM吸附常数Kf却略高于中粉砂粒级SPM吸附常数Kf的1.8倍左右。其中细粉砂粒级和中粉砂粒级的粒级级差较小可能导致两粒级SPM的有机碳含量相近现象。Zhang等[37]研究了3种表层沉积物及其各有机组分对疏水性有机污染物吸附作用机理,发现芳香族基团和孔隙率主导了沉积物有机质对疏水性有机污染物的吸附过程。进一步研究发现,在砂质沉积物的运输过程中,PAEs主要被截留在泥沙孔隙中,而不是吸附在颗粒表面[38]。比较细粉砂和中粉砂两粒级的比表面积和孔容,发现前者的比表面积和孔容都高于后者。因此,当砂质SPM的有机质含量相近时,比表面积和孔容可能是造成其吸附DBP程度有差别的主要原因。
如表3所示,中粉砂粒級和砂粒级的比表面积和孔容相近,且砂粒级SPM中TOC含量远高于中粉砂粒级SPM的TOC含量,但是中粉砂粒级SPM的吸附常数Kf却与砂粒级相差接近17倍(表2和表4)。相关研究表明,土壤/沉积物天然有机质主要由动植物残体及其降解产物、微生物群落和腐殖质组成[39]。动植物残体通过物理化学风化和生物作用转化为更稳定的腐殖质,在此过程中,其芳香碳和脂肪碳的含量会增加,而O-烷基碳的含量降低[40-41]。如表2所示,比较中粉砂粒和砂粒级SPM的芳香性和极性后,发现前者的芳香性和极性明显高于后者。Ding等[42]对三峡库区干支流中表层沉积物的有机质的来源和组成进行分析,发现其天然有机质主要来自维管植物的陆源输入。此外,Guo等[43]比较研究了泥炭土、腐殖酸、胡敏素以及作为腐殖质前体的纤维素和木质素等5种不同吸附材料对疏水性有机污染物萘的吸附行为,发现纤维素作为在地球上植物合成的最丰富有机化合物之一[44],萘关于纤维素的有机碳分配系数(Koc)极低,主要是由于纤维素中含有大量的极性O-烷基碳,并通过氢键为水分子提供了众多的位点,从而降低了疏水性有机物的吸附性能。因此,推断砂粒级SPM中大部分有机质可能是腐殖化程度较低的植物残体,致使在比表面积和孔容相近的情况下,虽然砂粒级SPM高于中粉砂粒级SPM的TOC,但前者的吸附指数Kf显著低于后者的吸附指数Kf。
3 结论
1)采用湿筛自然沉降法对SPM进行粒径分级,分为5个粒径级别:黏土极细粉砂(<8 μm)、细粉砂(8~20 μm)、中粉砂(20~32 μm)、粗粉砂(32~63 μm)和砂(>63 μm),其分选效果较好。
2)分配作用是各粒级SPM吸附DBP的主要机理。此外,由于黏土极细粉砂粒级中含有大量黏土组分,而黏土的表面吸附和有机质中的玻璃态腐殖质都会导致该粒级表现出一定程度的非线性特征,但非线性程度较低,分配作用仍是该粒级吸附DBP的主要机制。且随着(O+N)/C比的增加,各粒级SPM的Freundlich吸附指数n值增加,即SPM的极性基团增加会促进了DBP的线性吸附。
3)各粒级SPM对DBP的吸附等温线试验表明,随着TOC含量的增加,各粒级SPM对DBP吸附能力呈现出增加的趋势。各粒级SPM对DBP吸附能力由强到弱依次为:黏土极细粉砂>细粉砂>中粉砂>粗粉砂>砂。
4)在遵循3)中的规律下,各粒级SPM对DBP吸附能力的强弱还受其他因素的影响。黏土极细粉砂粒级所含有类胶束结构的溶解性腐殖质,其芳香性R—C=C使得结构中的疏水内腔更紧致、更大,会提高其对DBP吸附能力;就砂质SPM而言,较大的比表面积、孔容和较高程度的有机质腐殖化也会促进其对DBP的吸附作用。
参考文献:
[1] 胡瑞文. 邻苯二甲酸二丁酯(DBP)水解酶基因的克隆与功能分析[D]. 广州: 暨南大学, 2018.
HU R W. Cloning and functional analysis of a dibutyl phthalate hydrolase gene from Rhodococcus sp. 2G [D]. Guangzhou: Jinan University, 2018. (in Chinese)
[2] BENJAMIN S, MASAI E J, KAMIMURA N, et al.Phthalates impact human health: Epidemiological evidences and plausible mechanism of action [J]. Journal of Hazardous Materials, 2017, 340: 360-383.
[3] NET S, SEMPR R, DELMONT A, et al. Occurrence, fate, behavior and ecotoxicological state of phthalates in different environmental matrices [J]. Environmental Science & Technology, 2015, 49(7): 4019-4035.
[4] STAPLES C A, ADAMS W J, PARKERTON T F, et al. Aquatic toxicity of eighteen phthalate esters [J]. Environmental Toxicology and Chemistry, 1997, 16(5): 875-891.
[5] YE T, KANG M, HUANG Q S, et al. Exposure to DEHP and MEHP from hatching to adulthood causes reproductive dysfunction and endocrine disruption in marine medaka (Oryzias melastigma) [J]. Aquatic Toxicology, 2014, 146: 115-126.
[6] HOWDESHELL K L, RIDER C V, WILSON V S, et al. Mechanisms of action of phthalate esters, individually and in combination, to induce abnormal reproductive development in male laboratory rats [J]. Environmental Research, 2008, 108(2): 168-176.
[7] LV H, MO C H, ZHAO H M, et al. Soil contamination and sources of phthalates and its health risk in China: A review [J]. Environmental Research, 2018, 164: 417-429.
[8] LI Y Y, HE W, LIU W X, et al. Impacts of anthropogenic activities on spatial variations of phthalate esters in water and suspended particulate matter from Chinas lakes [J]. Science of the Total Environment, 2020, 724: 138281.
[9] ZHANG Z M, ZHANG J, ZHANG H H, et al. Pollution characteristics, spatial variation, and potential risks of phthalate esters in the water-sediment system of the Yangtze River estuary and its adjacent East China Sea [J]. Environmental Pollution, 2020, 265: 114913.
[10] HE Y, WANG Q M, HE W, et al. Phthalate esters (PAEs) in atmospheric particles around a large shallow natural lake (Lake Chaohu, China) [J]. Science of the Total Environment, 2019, 687: 297-308.
[11] WANG F, XIA X H, SHA Y J. Distribution of phthalic acid esters in Wuhan section of the Yangtze River, China [J]. Journal of Hazardous Materials, 2008, 154(1/2/3): 317-324.
[12] 林莉, 董磊, 李青云, 等. 三峽库区水体和底泥中多环芳烃和邻苯二甲酸酯类分布和来源[J]. 湖泊科学, 2018, 30(3): 660-667.
LIN L, DONG L, LI Q Y, et al. Distribution and sources of polycyclic aromatic hydrocarbons and phthalic acid esters in water and surface sediment from the Three Gorges Reservoir [J]. Journal of Lake Sciences, 2018, 30(3): 660-667. (in Chinese)
[13] HE M J, YANG T, YANG Z H, et al. Current state, distribution, and sources of phthalate esters and organophosphate esters in soils of the Three Gorges Reservoir region, China [J]. Archives of Environmental Contamination and Toxicology, 2018, 74(3): 502-513.
[14] 杨婷, 何明靖, 杨志豪, 等. 邻苯二甲酸酯在三峡库区消落带非淹水期土壤中污染特征及健康风险[J]. 环境科学, 2017, 38(10): 4187-4193.
YANG T, HE M J, YANG Z H, et al. Occurrence, distribution and health risk of the phthalate esters in riparian soil in the fluctuating zone of the Three Gorges Reservoir [J]. Environmental Science, 2017, 38(10): 4187-4193. (in Chinese)
[15] CHEN X, XU S, TAN T, et al. Toxicity and estrogenic endocrine disrupting activity of phthalates and their mixtures [J]. International Journal of Environmental Research and Public Health, 2014, 11(3): 3156-3168.
[16] CHEN H, MAO W, SHEN Y Q, et al. Distribution, source, and environmental risk assessment of phthalate esters (PAEs) in water, suspended particulate matter, and sediment of a typical Yangtze River Delta City, China [J]. Environmental Science and Pollution Research, 2019, 26(24): 24609-24619.
[17] TURNER A, MILLWARD G E. Suspended particles: their role in estuarine biogeochemical cycles [J]. Estuarine, Coastal and Shelf Science, 2002, 55(6): 857-883.
[18] DAGG M, BENNER R, LOHRENZ S, et al.Transformation of dissolved and particulate materials on continental shelves influenced by large rivers: Plume processes [J]. Continental Shelf Research, 2004, 24(7/8): 833-858.
[19] PUIG P, PALANQUES A, MARTN J. Contemporary sediment-transport processes in submarine canyons [J]. Annual Review of Marine Science, 2014, 6(1): 53-77.
[20] YU M, EGLINTON T I, HAGHIPOUR N, et al. Molecular isotopic insights into hydrodynamic controls on fluvial suspended particulate organic matter transport [J]. Geochimica et Cosmochimica Acta, 2019, 262: 78-91.
[21] ZHANG L J, ZHANG J, GONG M N. Size distributions of hydrocarbons in suspended particles from the Yellow River [J]. Applied Geochemistry, 2009, 24(7): 1168-1174.
[22] LIVENS F R, BAXTER M S. Particle size and radionuclide levels in some west Cumbrian soils [J]. Science of the Total Environment, 1988, 70: 1-17.
[23] SPOKAS K A. Review of the stability of biochar in soils: predictability of O: C molar ratios [J]. Carbon Management, 2010, 1(2): 289-303.
[24] XUE C, PENG L, TANG J P, et al. Screening the main factors affecting phthalate esters adsorption on soils, humic acid, and clay organo-mineral complexes [J]. Ecotoxicology and Environmental Safety, 2020, 190: 109143.
[25] HU Y, YANG Q W, SUN J X, et al. Adsorption and desorption behaviors of four endocrine disrupting chemicals in soils from the water-level fluctuation zone of the Three Gorges Reservoir, China [J]. Sustainability, 2018, 10(7): 2531.
[26] YANG F, WANG M, WANG Z Y. Sorption behavior of 17 phthalic acid esters on three soils: Effects of pH and dissolved organic matter, sorption coefficient measurement and QSPR study [J]. Chemosphere, 2013, 93(1): 82-89.
[27] CHIOU C T, KILE D E. Deviations from sorption linearity on soils of polar and nonpolar organic compounds at low relative concentrations [J]. Environmental Science & Technology, 1998, 32(3): 338-343.
[28] STAPLES C A, PETERSON D R, PARKERTON T F, et al. The environmental fate of phthalate esters: A literature review [J]. Chemosphere, 1997, 35(4): 667-749.
[29] LEBOEUF E J, WEBER W J. A distributed reactivity model for sorption by soils and sediments. 8. sorbent organic domains: Discovery of a humic acid glass transition and an argument for a polymer-based model [J]. Environmental Science & Technology, 1997, 31(6): 1697-1702.
[30] CHIOU C T, KILE D E, RUTHERFORD D W, et al. Sorption of selected organic compounds from water to a peatsoil and its humic-acid and humin fractions: Potential sources of the sorption nonlinearity [J]. Environmental Science & Technology, 2000, 34(7): 1254-1258.
[31] WANG X, GUO X, YANG Y, et al. Sorption mechanisms of phenanthrene, lindane, and atrazine with various humic acid fractions from a single soil sample [J]. Environmental Science & Technology, 2011, 45(6): 2124-2130.
[32] RUTHERFORD D W, CHIOU C T, KILE D E. Influence of soil organic matter composition on the partition of organic compounds [J]. Environmental Science & Technology, 1992, 26(2): 336-340.
[33] SPARK K M, SWIFT R S. Effect of soil composition and dissolved organic matter on pesticide sorption [J]. Science of the Total Environment, 2002, 298(1/2/3): 147-161.
[34] TRIKOVIJ, IVANEV-TUMBAS I, DALMACIJA B, et al. Pentachlorobenzene sorption onto sediment organic matter [J]. Organic Geochemistry, 2007, 38(10): 1757-1769.
[35] PAN B, GHOSH S, XING B S. Dissolved organic matter conformation and its interaction with pyrene as affected by water chemistry and concentration [J]. Environmental Science & Technology, 2008, 42(5): 1594-1599.
[36] 丁海濤, 赵青, 宋薇, 等. 溶解性腐殖酸与多环芳烃相互作用机理[J]. 生态学杂志, 2020, 39(7): 2292-2301.
DING H T, ZHAO Q, SONG W, et al. Mechanism underlying the interaction between dissolved humic acid and polycyclic aromatic hydrocarbons [J]. Chinese Journal of Ecology, 2020, 39(7): 2292-2301. (in Chinese)
[37] ZHANG D N, DUAN D D, HUANG Y D, et al. Role of structure, accessibility and microporosity on sorption of phenanthrene and nonylphenol by sediments and their fractions [J]. Environmental Pollution, 2016, 219: 456-465.
[38] LIU H, LI Y X, HE X, et al. Compound-specific carbon isotopic fractionation during transport of phthalate esters in sandy aquifer [J]. Chemosphere, 2016, 144: 1831-1836.
[39] ZECH W, SENESI N, GUGGENBERGER G, et al. Factors controlling humification and mineralization of soil organic matter in the tropics [J]. Geoderma, 1997, 79(1-4): 117-161.
[40] KELLEHER B P, SIMPSON M J, SIMPSON A J. Assessing the fate and transformation of plant residues in the terrestrial environment using HR-MAS NMR spectroscopy [J]. Geochimica et Cosmochimica Acta, 2006, 70(16): 4080-4094.
[41] CHEFETZ B, XING B S. Relative role of aliphatic and aromatic moieties as sorption domains for organic compounds: A review [J]. Environmental Science & Technology, 2009, 43(6): 1680-1688.
[42] DING H, ZHU C F, ZHANG K, et al. Source and composition of sedimentary organic matter in the head of Three Gorges Reservoir: A multiproxy approach using δ13C, lignin phenols, and lipid biomarker analyses [J]. Acta Geochimica, 2017, 36(3): 452-455.
[43] GUO X, WANG X, ZHOU X, et al. Impact of the simulated diagenesis on sorption of Naphthalene and 1-Naphthol by soil organic matter and its precursors [J]. Environmental Science & Technology, 2013, 47(21): 12148-12155.
[44] KURITA K. Controlled functionalization of the polysaccharide chitin [J]. Progress in Polymer Science, 2001, 26(9): 1921-1971.
(编辑 章润红)
