马尾松胚乳愈伤组织发生的初步研究
2021-09-10田雨风
田雨风,徐 刚
(贵州省森林资源与环境研究中心/贵州大学林学院,贵州 贵阳 550025)
马尾松(Pinus massoniana)是松科松属的常绿高大乔木,俗名青松、山松,是我国东部地区分布最广泛的针叶树种,分布于江苏、浙江、福建、广东、台湾等地区[1]。马尾松的经济价值高,是重要的用材、造纸、工业原料树种[2]。然而,马尾松的良种供应不足一直是影响马尾松人工林产业经济效益的瓶颈问题[3]。扦插繁殖是一种较好的良种基因型扩繁方法,但马尾松优质插穗大量获取较难,同时插穗生根能力具有年龄效应[4],且受季节限制,增殖系数较低。通过组织培养,建立马尾松良种快繁体系,能对少量的外植体进行大量繁殖,批量提供马尾松优质种苗。
关于马尾松组织培养已有报道,以茎段[5—6]、幼胚[7—8]、下胚轴[9]、顶芽[10]等材料作为外植体,成功获得了马尾松愈伤组织、体胚[11]和组培苗[11—14],目前只有以胚为外植体能建立完整体系。齐力旺等[15]与顾淑荣等[16]对部分裸子植物进行过胚乳组织培养研究,均未能建立完整体系。马尾松胚乳组织培养尚未见报道。马尾松的胚乳是由大孢子直接发育而成的单倍体,因此以胚乳为材料进行组织培养有望获得单倍体材料,通过单倍体育种具有快速纯合基因、缩短育种年限、提高育种效率等优势,可与多种育种技术相结合,加快育种研究。因此,本研究以马尾松成熟胚乳为材料,通过筛选合适的基本培养基与生长调节剂配比,以及热激处理探索马尾松胚乳愈伤组织诱导以及增殖方法,为马尾松胚乳组织培养以及马尾松单倍体育种奠定基础。
1 材料与方法
1.1 材料
采自贵州省都匀马寨马尾松良种基地的成熟马尾松种子。
1.2 外植体处理消毒方式
马尾松种子保存于4 ℃冰箱,接种前一天取出剥去种壳,并浸泡在无菌水中,存放于4 ℃冰箱冷藏12 h。将剥去外壳的种子在超净工作台中进行表面杀菌处理(表1),每种消毒剂处理后均使用无菌水冲洗3~4次。将消毒的种子置于滤纸吸干水分,切除胚芽再纵切去除胚,余下的胚乳接种于 WPM+6-BA 1.0 mg·L-1+2,4-D 2.0 mg·L-1+蔗糖 30 g·L-1+琼脂7 g·L-1培养基中,pH为5.8,每处理重复3次,每重复30个外植体,每天观察记录外植体污染与生长状况并拍照,30 d后统计污染率、死亡率等。
1.3 6-BA浸泡对愈伤诱导的影响
以 WPM+NAA 2.0 mg·L-1+2,4-D 1.0 mg·L-1+蔗糖30 g·L-1+琼脂 7 g·L-1为培养基,pH为 5.8。种子去壳后浸泡于无菌水中,存放在4 ℃冰箱12 h,接种前去壳种子在6-BA溶液中浸泡30 min,6-BA溶液浓度设计为四个水平,0、0.2、0.5和1.0 mg·mL-1(表2),每处理3个重复,每重复30个胚乳材料,每7 d观察并记录愈伤生长状况,持续观察30 d。
1.4 基本培养基与生长调节剂浓度筛选
愈伤诱导以基本培养基、NAA和 6-BA以及2,4-D设计四因素三水平的正交试验(表3),选用正交表 L9(34),均添加蔗糖 30 g·L-1,琼脂 7 g·L-1,pH调至5.8,每处理4个重复,每重复20个胚乳材料,每7 d观察愈伤生长状况,持续观察30 d。
1.5 热激处理
以 DCR+NAA 2.0 mg·L-1+6-BA 1.0 mg·L-1为接种培养基,添加蔗糖30 g·L-1,琼脂7 g·L-1,pH为5.8。在接种后,放置于培养箱中热激处理,设计温度梯度 35 ℃、40 ℃、45 ℃,时间梯度 5 min、10 min、15 min的两因素三水平随机区组,并将相对湿度调至85%。每处理3个重复,每重复30个胚乳材料,每7 d观察愈伤生长状况,持续观察30 d。
1.6 愈伤组织继代培养
用基本培养基(DCR、GD、WPM)与NAA (0.1~0.3 mg·L-1)以及 6-BA (0.5~1 mg·L-1)组合设计马尾松胚乳愈伤组织继代培养基,再添加蔗糖30 g·L-1、琼脂7 g·L-1。光照强度 1500 lx,光照时间12 h·d-1,培养3周后,统计愈伤组织变绿数量以及生长状况。
以WPM为基本培养基,设计三种生长调节剂配比用于增殖培养:Z1(NAA 0.1 mg·L-1+6-BA 2.0 mg·L-1)、Z2 (NAA 0.1 mg·L-1+KT 2.0 mg·L-1)、Z3 (NAA 0.1 mg·L-1+2,4-D 0.1 mg·L-1+6-BA 2.0 mg·L-1)。培养基均添加蔗糖 30 g·L-1,琼脂7 g·L-1。转化后的愈伤再转接入增殖培养基培养3周,统计增殖情况。
2 结果与分析
2.1 消毒方式筛选
从表1可以看出,六个处理的外植体污染率没有极显著差异,消毒效果均较好。使用 HgCl2消毒的三个处理愈伤诱导率较低甚至为 0,而死亡率较高;用 NaClO消毒的三个处理愈伤诱导率高达66.67%,最低的也为 46.67%,死亡率最高的仅为20.00%。可见用NaClO消毒更适用于马尾松成熟胚乳。HgCl2可能对胚乳材料造成一定杀灭作用。在使用NaClO消毒的三个处理中,随着NaClO处理时间的增长,愈伤组织诱导率逐渐下降,且三个处理间差异显著。从死亡率看,HgCl2处理和NaClO处理具有显著差异,NaClO处理的愈伤死亡率显著低于HgCl2处理,使用NaClO的三个处理中,死亡率呈现随消毒时间增长而升高的趋势。综合来看,75%酒精 30 s+2% NaClO 15 min消毒处理污染率为0.00%,且愈伤诱导率较高,胚乳材料死亡率较低,为最适宜的消毒处理方式。

表1 不同消毒方式对马尾松胚乳的消毒效果Table 1 Sterilization results of Pinus massoniana endosperm by different disinfection methods
2.2 6-BA浸泡对愈伤诱导的影响
使用 6-BA浸泡处理对胚乳愈伤诱导的影响如表2。即使培养基中不含细胞分裂素,使用6-BA浸泡后,对于愈伤组织的诱导仍具有一定的促进作用。在4个浓度6-BA浸泡处理下,随着6-BA浓度的不断增加,其愈伤诱导率也不断升高。未使用 6-BA浸泡的诱导率最低(55.00%);浸泡浓度为1.0 mg·L-1时诱导率最高(87.78%)。从该表中还能看出,随着6-BA浓度增加,愈伤诱导率的增幅也逐渐变小,在浸泡浓度为 0~0.2 mg·L-1之间时,浓度每增加0.1 mg·L-1,诱导率提高 7.50%;在浓度为0.2~0.5 mg·L-1之间时,浓度每增加 0.1 mg·L-1诱导率提高3.70%;在浓度为0.5~1.0 mg·L-1时,浓度每增加0.1 mg·L-1诱导率只提高1.33%。

表2 6-BA浸泡对愈伤诱导的影响Table 2 The effect of 6-BA soaking on callus induction
2.3 基本培养基与生长调节剂配比筛选
在不同基本培养基和生长调节剂配比处理下,胚乳愈伤组织诱导30 d后结果见表3。9号处理(A3B3C2D1)的愈伤诱导率最高,达68.75%;其次为4号处理(A2B1C2D3),诱导率为67.5%;1号处理(A1B1C1D1)诱导率最低,仅为2.50%。极差分析表明,各因素对诱导率的影响效应依次为A>B>D>C,理论最佳组合为A2B3C2D3或A3B3C2D3。为了进一步比较A2B3C2D3与A3B3C2D3两个理论最佳组合的优劣,以这两最佳组合培养基进行试验,重复4次,每个重复20个胚乳材料。方差分析表明,影响胚乳愈伤诱导率的四个因素(基本培养基、NAA、6-BA、2,4-D)都具有显著性影响,主次关系为A>B>C>D,此次序与极差分析次序有异,由于极差分析不能反映结果是误差引起还是因素引起,因此以方差分析为准(表4);A3B3C2D3组合愈伤诱导率与A2B3C2D3的结果表明(表5),基本培养基WPM和DCR对愈伤诱导率的影响不具有显著性差异。因此认为DCR+NAA 2.0 mg·L-1+6-BA 1.0 mg·L-1为愈伤启动诱导的适宜培养基。

表3 愈伤诱导正交试验结果Table 3 Orthogonal test results of callus induction

表4 愈伤诱导正交试验的方差分析Table 4 Analysis of variance in orthogonal test of callus induction

表5 正交试验验证结果Table 5 Orthogonal test verification results
2.4 热激处理对愈伤诱导的影响
不同热激时间和热激温度对愈伤组织诱导影响如表6所示。随着热激时间增加,愈伤诱导率出现先增加再减小的趋势;随着热激温度的升高,愈伤组织的诱导率在热激5 min时呈减小趋势,在热激10 min和15 min时则表现为不断增加;诱导率在45 ℃下热激10 min和15 min时相对较高,分别为66.25%和67.50%。高的热激温度更容易诱导成团的愈伤组织,在45 ℃条件下热激10 min时诱导率最高为 8.75%。综合来看,马尾松胚乳愈伤组织最佳的热激方式为45 ℃下热激10 min。此外,就热激时间和热激温度的影响来看,两者对总愈伤诱导率均具有显著影响(P<0.05),但前者的影响大于后者;而这两者对于成团愈伤组织的诱导则不具有显著影响(P>0.05)。

表6 热激对愈伤组织诱导的影响Table 6 The effect of heat shock on callus induction
培养30 d后热激处理过后的愈伤组织与未热激的愈伤组织有明显的差异。未经过热激处理的胚乳诱导出的愈伤组织只是切割面有突起,愈伤组织不成团且不明显,而且难以增殖,需继代3周后才成团状(图1:a~b)。热激处理过的愈伤组织生长状态分为两类:1)多数胚乳仅在切割面有凸起,但突起程度大于未热激处理,且愈伤组织更加晶莹透亮(图1:c~d),说明愈伤诱导的情况更加良好;2)少数胚乳从切割面或者切割缝隙中突起成团,愈伤组织晶莹透亮且量大,诱导情况良好,易增殖发育(图1:e~f)。
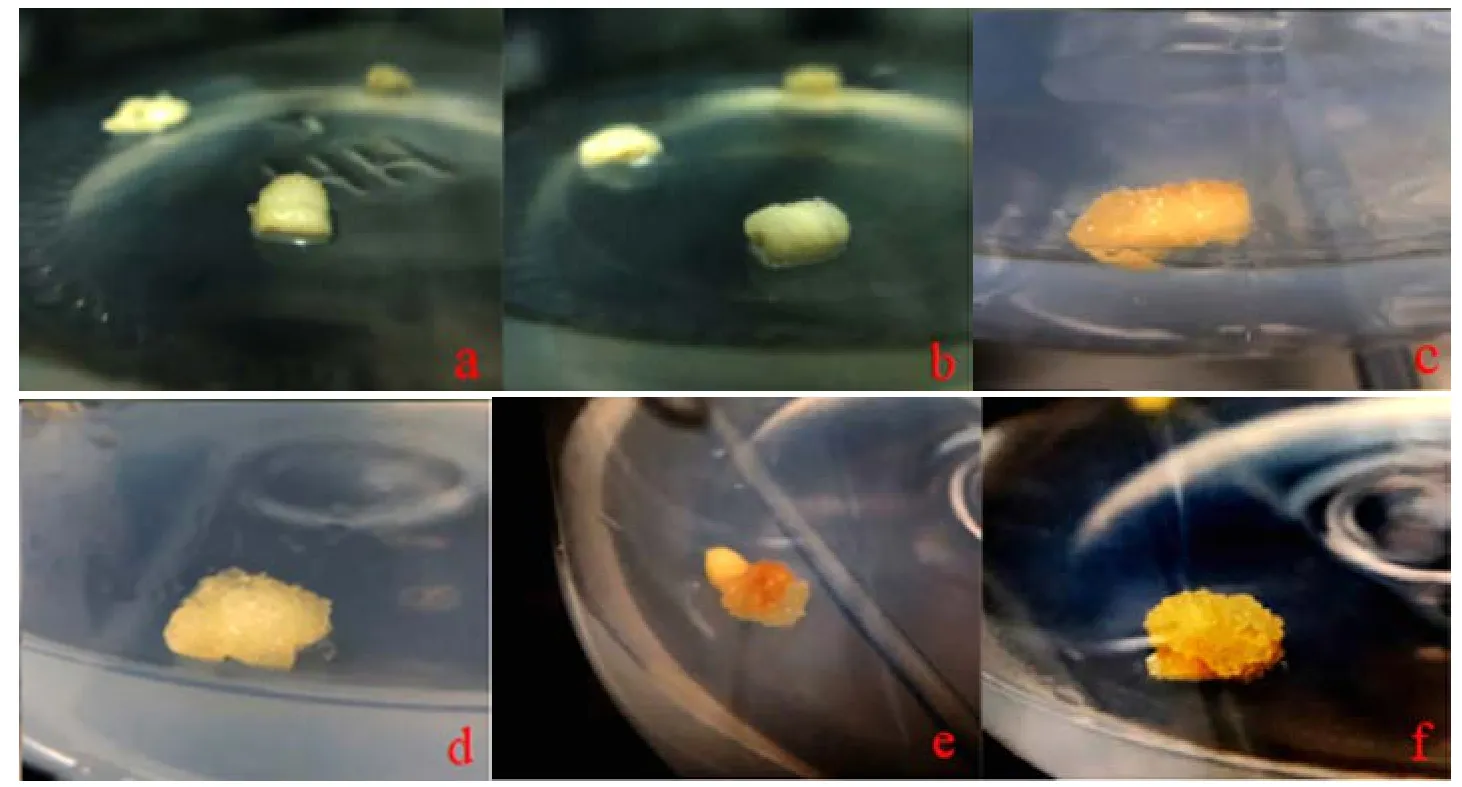
图1 马尾松胚乳热激诱导愈伤比较Fig.1 Heat shock comparison on callus induction of Pinus massoniana endosperm
2.5 基本培养基对增殖的影响
从暗培养转至光培养,部分愈伤发生褐化与死亡现象,其余愈伤转为绿色。GD培养基中绿色愈伤率均为30%左右,褐化率高且褐化程度高,不利于愈伤组织的继代;DCR与WPM培养基对继代培养没有明显差异(表7)。处理1相较于处理2以及处理5相较于处理6,较低浓度的NAA与6-BA使其绿色愈伤率均提高约20%,更低浓度的NAA与6-BA更适于继代培养,但愈伤组织无增殖。

表7 马尾松胚乳愈伤组织的转化Table 7 Succession of endosperm callus of Pinus massoniana
将绿色的愈伤组织进一步增殖(表8)。培养基Z1~Z3的增殖率没有显著差异,Z1和Z2诱导率稍高。在增殖速度上,Z1、Z2高于Z3,Z1与Z2的愈伤组织绿色更深,愈伤组织质密,表面有些许突起,出现即将分化的征兆(图2:a);而Z3的愈伤组织绿色较浅且质地疏松(图2:b)。因此马尾松胚乳愈伤组织的增殖培养基以添加NAA 0.1 mg·L-1、6-BA(或KT)2.0 mg·L-1较佳,增殖率可达80%以上。

图2 马尾松胚乳绿色愈伤组织Fig.2 Green callus of Pinus massoniana endosperm

表8 马尾松胚乳愈伤组织增殖Table 8 Proliferation of callus of Pinus massoniana endosperm
3 结论与讨论
由于外植体通常具有较多的表面污物和内生菌易发生污染[17],因此在植物组织培养中首先应对外植体进行消毒处理。研究发现,马尾松剥壳种子最佳消毒方式为75%酒精30 s+2% NaClO 15 min。NaClO处理不但能彻底消毒,还能较好地保持胚乳活性,而 HgCl2毒性较大,对胚乳材料造成较大的伤害,不宜作为马尾松去壳种子的消毒剂。
本研究表明,基本培养基DCR与WPM比GD更适合马尾松胚乳愈伤诱导和继代培养。基本培养基为外植体提供营养物质并起支撑作用[18],其中营养元素的种类和浓度适合于外植体是组织培养成功的前提。前人研究发现,在针叶树组织培养中培养基氮元素一般需低浓度[19]。GD培养基氮元素浓度较高,而DCR与WPM培养基氮元素浓度较低。此外,本研究还发现,在马尾松胚乳组织培养中生长素比细胞分裂素更重要,且是必需的;细胞分裂素可增加愈伤的诱导频率,但不是必需的。没有生长素的培养基极难诱导出愈伤组织(如正交试验1号处理诱导率只有2.50%);而没有细胞分裂素的培养基,仍能以较高频率诱导出愈伤组织(如正交试验6号处理诱导率达 56.25%,8号处理诱导率达 53.75%)。植物生长调节剂的比例在组织培养中很重要。吴元立等[20]发现,在银杏(Ginkgo biloba)成熟胚乳培养中,细胞分裂素与生长素的比值在0.5~0.9范围内能有效诱导愈伤组织发生,在 0.9时诱导率最高。初立业等[21]认为,在松科植物的组织培养中,通常是高浓度生长素配合低浓度细胞分裂素的愈伤诱导效果较好。本研究中,细胞分裂素与生长素比例为0.5时,愈伤诱导效果最好(如正交试验 9号处理67.5%和4号处理68.75%),继代培养则需要较低浓度的生长素(0.1 mg·L-1NAA)与细胞分裂素,否则引起愈伤褐化。此外,生长素总浓度过高抑制愈伤的发生,两个最佳组合处理的生长素总浓度均达4.0 mg·L-1,在此浓度下马尾松胚乳愈伤组织的诱导受到抑制。本研究中,培养基DCR+NAA 2.0 mg·L-1+ 6-BA 1.0 mg·L-1对马尾松胚乳愈伤诱导效果最佳,诱导率高达68.75%。
愈伤组织的继代与增殖需要低浓度 NAA(0.1 mg·L-1),愈伤组织须在低浓度细胞分裂素(0.5 mg·L-1)下进行转化,适应光照环境,此条件下几乎无增殖,继代20 d后以浓度稍高的6-BA或KT(2.0 mg·L-1)调节增殖,愈伤增殖率高达83.33%,愈伤质密,增殖效果好,说明在马尾松愈伤增殖中适用更高浓度的细胞分裂素。
马尾松愈伤组织诱导和生长缓慢,通常需要60 d才能形成团状愈伤组织,而本研究发现,适宜的热激处理不仅可提高马尾松胚乳愈伤质量并加快愈伤组织成团时间。吕晓波等[22]在愈伤诱导中首先运用热激处理,对于粳稻花药的愈伤诱导率提升12.5%。齐力旺等[23]在几种裸子植物胚乳培养中也运用了热激处理,热激后愈伤较好,并且相较于未热激的处理,愈伤诱导率提高 55%~60%。本研究与之不同的是适宜的热激处理愈伤诱导率无显著性变化,但热激的愈伤状况更好。王敬驹等[24]认为在胚乳培养中存在假愈伤组织化现象,一般这一状态突破时间较长,而热激可打破这一现象,加快胚乳组织成为真正的愈伤组织的进程。本研究发现,45 ℃下处理胚乳10 min,愈伤诱导率最高且质量最好,加快了愈伤组织的形成,仅需30 d即可形成团状愈伤组织,节省了时间成本。但热激时间过长或过短都对愈伤诱导无促进作用,10 min较合适。
本研究确定了适用于马尾松胚乳组织培养外植体的消毒方式,发现热激处理可提高愈伤诱导率和质量;生长素可促进胚乳愈伤诱导,且是必需的;细胞分裂素浸泡种子可代替培养基中的细胞分裂素,且能取得较理想的效果;初步确定WPM和DCR培养基适用于马尾松胚乳组培。培养基(DCR+NAA 2.0 mg·L-1+6-BA 1.0 mg·L-1+蔗糖 30 g·L-1+琼脂7 g·L-1)的愈伤诱导率最高,可作为进一步优化马尾松胚乳愈伤组织诱导培养基的基础。通过继代培养成功得到绿色愈伤组织,在增殖培养基(WPM+NAA 0.1 mg·L-1+6-BA 2.0 mg·L-1+蔗糖 30 g·L-1+琼脂7 g·L-1)中愈伤增殖率达80%以上,愈伤质密,为后续愈伤分化奠定了基础。
