酚氧化酶原在蜜蜂体内的分布及其特性研究
2021-09-10梁利邓炎春杨卅刁青云侯春生
梁利 邓炎春 杨卅 刁青云 侯春生
(1 中国农业科学院蜜蜂研究所,北京 100193;2 农业农村部授粉昆虫生物学重点实验室,北京 100193;3 中国农业科学院研究生院,北京 100081)
蜜蜂(Apis mellifera)与其他社会性昆虫一样,缺少像脊椎动物那样的适应性免疫反应,但它们拥有一个高效的先天免疫系统,由体液和细胞免疫协同抵御外源微生物[1-4]。酚氧化酶原(PPO)是一种参与昆虫先天免疫反应的免疫蛋白,丝氨酸蛋白酶级联反应可以水解PPO保守序列的第51个精氨酸生成酚氧化酶(PO)[5]。实际上,PPO不仅存在于血淋巴中,也存在于角质层中[6,7]。通常PPO通过血细胞释放到血淋巴并被激活产生PO,会在伤口部位诱导产生大量黑色素,以防止血淋巴流失和微生物入侵[8-10]。PO催化酪氨酸生成3,4-二羟基苯丙氨(DOPA),并且酚类物质氧化生成醌类物质也是黑色素形成所必须的。虽然阐明PO在昆虫体内的生理生化和分子机制,有助于对其活性进行深入理解,但是纯化过程中PPO活性的不稳定性和快速失活,进而研究者更多关注PPO[11]。迄今为止,已从鳞翅目、双翅目和膜翅目等昆虫中鉴定并纯化了PPO[8,12,13]。其中,Zufelato等从蜜蜂蛹血淋巴中纯化出分子量为70kDa的PO,得到PO的最适pH为6.5,最适温度为20℃[13]。随后克隆了意大利蜜蜂的AmPPO,发现AmPPO在成虫和蛹中的转录水平高于幼虫和预蛹[14]。但AmPPO在不同组织中的详细分布及影响PO活性的因素有待进一步研究,特别是PO在体外的活性及其影响因素未见报道。
本研究利用半定量PCR 技术检测了AmPPO 在工蜂和蜂王不同组织中的分布,发现AmPPO 在工蜂和蜂王不同组织中均有分布。与蜂王相比,AmPPO 在工蜂各组织中的转录本均高于蜂王的。对PO 活性的测定表明,Cu2+与Mg2+或Ca2+组合的活性明显高于它们单一金属离子的活性。本研究结果将为进一步研究PPO 参与的黑化免疫反应及参与该路径的基因研究奠定基础。
1 材料与方法
1.1 蜜蜂样本
意大利蜜蜂,来自中国农业科学院蜜蜂研究所实验蜂群。采集了3 个不同蜂群的出房工蜂、未受精蜂王、受精蜂王。解剖工蜂和蜂王并收集相应的组织(头、胸、表皮、足、翅、中肠、血淋巴、卵巢(处女王)和气管)。不同日龄蜜蜂采用扣王产卵的方法获得,按照Schmehl 等[15]的方法进行移虫,培养幼虫。1日龄卵,记为第一天,直到蜜蜂第21 天出房。采集5、7、9、11、13、15、17、19、21 天的幼虫或蜜蜂,每个日龄5 个重复。
1.2 主要试剂和仪器
试剂:Prime Script RT reagent Kit With gDNA Eraser、Quick Cut Bam HI、Quick Cut Sac I等购自宝日医生物技术(北京)有限公司;E.coliDH5α、Super Pfx Master Mix、快速琼脂糖凝胶DNA回收试剂盒Pure Plasmid Mini Kit等购自康为世纪生物科技(北京)有限公司;KAPA SYBR® FAST qPCR Kits购自KAPA Biosystems(美国)公司;Cetylpyridinium chloride购自上海阿拉丁生化科技股份有限公司;TRIzol Reagent、GelRed核酸染料、Agarose LE购自Invitrogen(美国)公司;Tryptone、Yeast Extract、Agar为Oxiod(英国)公司;PVDF膜为Bio-Rad(美国)公司;BL21(DE3)Chemically Competent Cell为全式金生物技术(北京)有限公司;SDS-PAGE Gel Kit为庄盟国际生物基因科技(北京)有限公司;T4DNA连接酶为NEB(英国)公司;L-DOPA(粉末)、Millipore Western Blot ECL显色液为Merck(德国)公司;50×TAE缓冲液、10X MOPS电泳缓冲液为生工生物工程(上海)股份有限公司;10×电泳转移缓冲液、10×PBS缓冲液为酷来搏科技(北京)有限公司;pET-28a载体为本实验室制备;其他试剂均为国产分析纯。
主要仪器:Centrifuge 5417R 台式微量高速离心机、Bio Spectrometer 分光光度计,德国Eppendorf 公司;TC-96/G/H(b)cPCR 扩增仪、LineGene9600 plus FQD-96A,杭州博日科技有限公司;FR200A 凝胶成像设备,复日科技有限公司。
1.3 DNA与RNA的提取
使用基因组DNA 纯化试剂盒和TissuePrep 组织破碎机,根据试剂盒说明提取工蜂和蜂王各组织总DNA,提取的DNA 在20μL 无核酸水中洗脱。提取DNA 的质量和浓度由Qubit 2.0 荧光仪测定,并定量至50ng/μL。工蜂、蜂王组织和不同日龄幼虫(个体),按照说明书使用Trizol 试剂提取总RNA。使用Bio Spectrometer 检测RNA 质量。使用去基因组PrimeScript RT Reagent Kit with gDNA Eraser 试剂盒,按照说明书反转录约1000ng RNA 合成cDNA,产物作为qPCR 模板。
1.4 AmPPO的分布和定量分析
采用半定量PCR方法检测AmPPO在蜂王和工蜂不同组织中的分布,并用A.mellifera翻译起始因子eIF-2B亚单位delta(Amtif)对数据进行标准化[16]。采用Super Pfx Master Mix进行半定量PCR鉴定,特异性引物qPPOF:5’-TGGCATTGGCACTTGGTGTA -3’和qPPOR:5’-AGTACCGCTGGGTCGAAATG -3’。在94℃预变性5min;然后94℃变性30s,55℃退火30s,72℃延伸20s,进行28个循环;72℃延伸10min。PCR产物经1%琼脂糖电泳,观察结果。采用绝对定量的方法计算PPO基因的转录本水平。qPCR反应系统包括7.5μL KAPA SYBR® FAST,各0.3μL的上游和下游引物(qPPO-F qPPO-R,10mM)、2μL模板cDNA和4.9μL双蒸水;总量为15μL。95℃预变性3min;循环段95℃、3s,55℃、20s,60℃、35s(检测荧光),进行40个循环。
1.5 AmPPO片段的扩增
AmPPO全长2082bp,编码693个氨基酸。使用Primer Premier 5进行引物设计:Forward Primer为5'-ATGGCGTCTGATAAATCGGG-3',将其命名为PPO-F;Reverse Primer为5'-TCCAGCAGTCTATAT-3',将其命名为PPO-R。PPO-F加入BamHI酶切位点,PPO-R加入SacI酶切位点,送生工生物(上海)有限公司合成。取蜜蜂样品,按照说明书与Trizol提取液中提取总RNA,测定RNA的浓度和纯度。参考Prime Script RT reagent Kit With gDNA Eraser说明书反转录得cDNA,以此为模板并按照Super Pfx Master Mix说明书进行降落PCR扩增,反应条件为:98℃预变性30s;98℃变性7s,56℃退火20s,72℃延伸70s,4个循环;98℃变性7s,54℃退火20s,72℃延伸70s,4个循环;98℃变性7s,52℃退火20s,72℃延伸70s,30个循环,72℃终延伸10min。PCR产物经1%的琼脂糖电泳,鉴定扩增的效果。然后使用胶回收试剂盒,纯化PPO扩增产物。
1.6 AmPPO的表达和纯化
以pET-28a作为目的基因载体,载体和AmPPO经BamHI/SacI酶切后进行连接,并导入大肠杆菌DH5α感受态细胞。以大肠杆菌BL21菌株为宿主,表达PPO(His-PPO)融合蛋白。将正确的重组载体pET28a-PPO转化大肠杆菌BL21中,涂布于含25μg/mL卡那霉素的LB固体培养基中过夜培养。通过菌落PCR筛选单个阳性菌落,将阳性菌落加入到10mL含50μg/mL卡那霉素的LB培养基中孵育过夜。然后将2.5mL培养物接种250ml LB,在37℃下孵育,至OD 600nm达到0.8。然后用0、0.3、0.5、0.7mM 4种浓度的异丙基 β-D-1-硫代半乳糖吡喃糖苷(IPTG)在17℃条件下诱导蛋白表达24h,在最适诱导浓度下找到最适诱导时间。250mL诱导菌液,4℃,12000rpm,离心10分钟,再用25mL 1X PBS(pH7.4)重悬。将含有目标可溶性蛋白的过滤上清液约25mL加入到含1mL His PurTMNi-NTA树脂的重力柱中,然后用5mL不同浓度的咪唑(25、200、400mM)洗脱蛋白。用低浓度咪唑清洗未结合的杂蛋白,用5mL 400mM咪唑洗脱融合蛋白。最后,用含400mM咪唑的融合蛋白进行SDS-PAGE分离和Western blot鉴定。总之,先将80μL的蛋白样品加入20μL 5×SDS-PAGE缓冲液中混合,然后在100℃下煮沸10min。用12%凝胶在80V、25min,120V、90min条件下电泳分离蛋白,并分别进行考马斯亮蓝R250染色和蛋白转膜。蛋白经过凝胶电泳转移到聚偏二氟乙烯膜上。随后,在5%的脱脂牛奶中室温孵育2小时进行封闭,然后加入HRP标记的抗His标签的抗体,再在室温下继续孵化2小时,然后用TBST清洗PVDF膜10分钟,重复3次。最后,使用全自动化学发光图像分析系统和ECL化学发光溶液完成化学发光图像分析。
1.7 PO活性试验
采用BCA Protein Assay Kit测定融合蛋白的浓度。我们参考Jiang 等人的试验方法并进行改进[4]。在总体积为1mL 的体系(预混液)中,加入20L10mM 的L-DOPA,20l 的PPO(约10g)纯化蛋白,40l 0.1mM的Cetylpyridinium chloride(CPC),补充去离子水到1mL,在490nm 下连续检测,观察PO 蛋白活性随时间的变化。为探究金属离子对PO 蛋白活性的影响,在上述预混液中分别加入终体积为25mmol/L的MgCl2,25mmol/L 的CuSO4,25mmol/L 的CaCl2,25mmol/L MgCl2和CuSO4,25mmol/L 的CaCl2和CuSO4,连续监测490nm 下吸光度的增加情况,参考Feng 等人的方法[11],PO 酶活单位(U):每毫克蛋白在反应体系中每分钟消耗一定量的L-DOPA 定义为一个酶活性单位。PO 活性(A490/mg/min)=(A490测定-A490初始)÷质量÷时间。为了确定温度对PO活性的影响,将不含CPC 的预混液在恒温箱中以不同的温度(4℃、16℃、22℃、28℃、36℃、45℃)孵育1 小时。CPC 在4℃会析出,所以我们用双蒸馏水代替CPC。然后在恒温箱中加入20μL PPO(10μg),继续孵育10 分钟。最后,在490nm 下快速测定混合物的吸光度。为了测试pH 值对PO 蛋白活性的影响,首先将混合物在室温下孕育10 分钟,然后添加20μL PPO 蛋白质(10μg)到不同pH(pH 4.5、5.5、6.5、7.5、8.5)的预混液中,之后在490nm 下检测吸光度的变化。
2 结果与分析
2.1 AmPPO的分布和转录水平
AmPPO在蜂王的头部、胸部、中肠和气管的表达量最高;而在相同条件下,在翅膀和血淋巴中检测到微弱信号(图1A)。在工蜂中,AmPPO在头部、表皮和中肠表达量最高,而胸部和腿部分布较弱(图1B)。与蜂王相比,AmPPO在工蜂各组织的转录本更高,其中工蜂血淋巴的转录本水平高于其他组织(图1C)。图1D显示5-、7-、9-、11-、13-、15-、17-、19-和21日龄蜜蜂的形态,AmPPO的表达量从第5天到第11天持续增加,第11天后开始下降。第19天表达量最高,达到3.5×105,第21天下降到6.3×104(图1E)。

图1 AmPPO在工蜂和蜂王不同组织及不同发育阶段中的分布和表达
2.2 PPO的表达和纯化
构建pET28a-PPO 的整个过程如图2所示,阳性菌落经菌落PCR 确认。扩增的AmPPO 的核苷酸序列经测序证实正确。IPTG 浓度为0.7mM 时,可溶性蛋白含量(~81kDa)最高(图3A)。结果显示,PPO 蛋白的量随咪唑浓度的增加而增加,400mM 咪唑可以洗脱全部目的蛋白(图3B)。
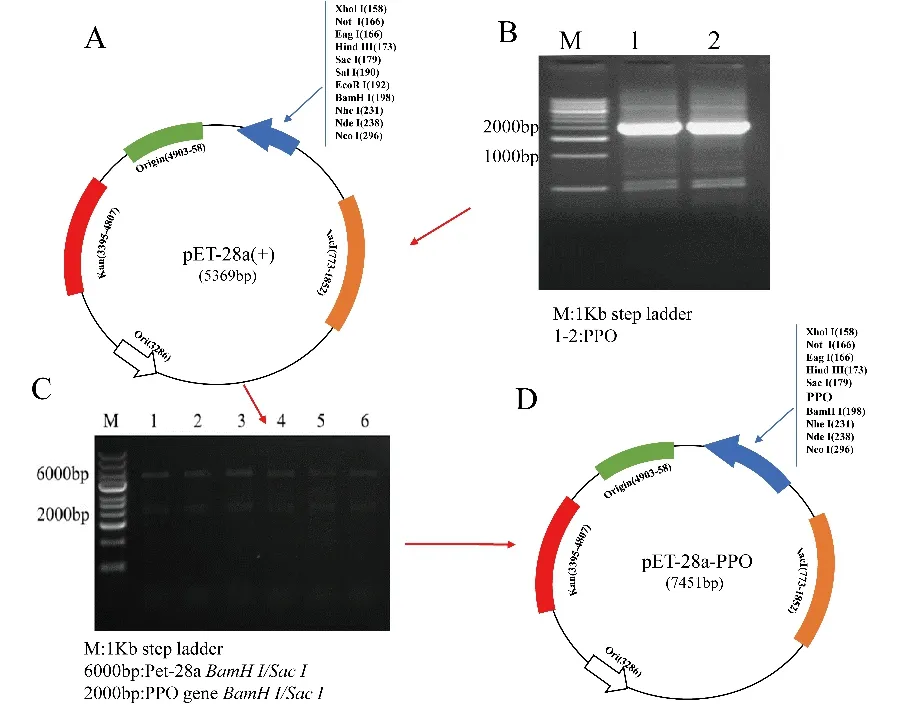
图2 重组质粒pET28a-PPO的构建示意图
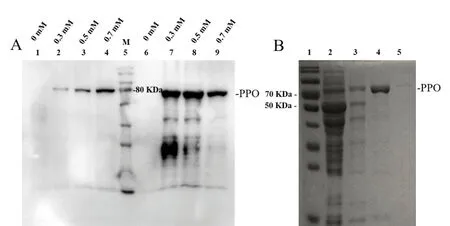
图3 PPO的原核表达及纯化
2.3 金属离子、温度和pH值对PO活性的影响
结果表明,随着反应时间的进行,PO 活性不断增加,并在5min 时达到最大值(图4A),490nm 下的吸光值不断增加(图4B)。PO 在pH 5.5 时活性最高(U=5.93),依次为pH 4.5 (U=3.97)、pH 6.5 (U=2.36)、pH 7.5(U=2.27)和pH 8.5 (U= 2.02)。pH 值为5.5 和4.5 时,PO活性比其他pH 值高2~3 倍。pH 大于5.5 时,PO 活性持续下降(图4C)。从4℃到36℃,PO 活性随着温度的升高而不断增加,达到4.83(U),然后PO 活性开始下降,在45℃时活性最小(U=0.342)(图4D)。单个金属离子(Mg2+、Ca2+)对PO 活性有抑制作用,但铜离子无抑制作用。与单个离子相比,Cu2+和Mg2+、Cu2+和Ca2+的结合将使PO 活性增加2 倍以上(图4E)。

图4 不同条件对PO活性的影响
3 讨论与结论
酚氧化酶的研究已有20 多年,大部分主要集中在酶功能和免疫机制方面[17-20]。本研究分析了AmPPO 在蜂王和工蜂不同组织中的分布以及AmPPO 在工蜂不同发育阶段的转录水平。通过构建大肠杆菌表达系统获得PPO,并利用CPC 激活PPO 来探究PO 活性的影响因素。
在我们的研究中,AmPPO在蜂王和工蜂不同组织中的表达量不同(图1A、B),且工蜂组织的转录本显著高于相应的蜂王组织(图1C,P<0.05)。蜂王血淋巴中PPO的转录水平不是最高的,而且显著低于其他组织(P<0.05)。这与Lourenco等人所描述和提出的工蜂可能需要对抗比蜂王更多的病原体的观点一致[15]。AmPPO的表达量从幼虫期到蛹期(第5~11天)持续升高,蛹期(第11~17天)下降(图1D、1E);19日龄时表达量最高,21日龄时下降(表皮色素沉着期)(图1D和图1E)。这些结果表明,酚氧化酶可能参与了表皮黑色素沉积和表皮硬化[20-22]。
许多研究表明,PPO 是昆虫防御细菌、真菌和病毒感染所必需的[23,24]。因此,报道了大量对PPO的研究。Shi 等人在Clostera anastomosis中鉴定了21 种杀虫剂和化感物质对PPO的抑制作用,发现槲皮素(quercetin)、苯硫脲(phenyl thiourea)和辛硫磷(phoxim)能强烈抑制PPO 活性[25]。Chen 等人发现特定氨基酸可以在体外影响果蝇黑腹多酚氧化酶的活性[26]。在我们对PO 活性的研究中,以CPC 作为激活剂,结果表明,PO 活性的最佳温度和pH 值是36℃和5.5 (图4C、D)。Zufelato等人收集蜜蜂蛹的血淋巴为PO 来源,以胰蛋白酶作为激活剂,结果显示PO 的最适温度和pH 值是20℃和6.5[13]。而Hara 等人和Cherqui 等人从家蝇血淋巴中纯化的PPO 的最适温度也都高于30℃[27,28]。在PO 活性试验中,25mM 金属离子(Ca2+、Mg2+)对PO 活性有抑制作用,而Cu2+没有影响。当加入Cu2+和Ca2+或Cu2+和Mg2+,PO 活性提高2 倍(图4E)。我们认为,其他金属离子和氨基酸残基可能形成金属配体,与金属活性中心形成弱相互作用,抑制蛋白质活性。当加入两种离子时,Cu2+会结合到活性中心位点,让蛋白的空间结构更加稳定,Ca2+或Mg2+则于非金属位点上的氨基酸残基形成金属配体,改变了PO 的空间结构,提高了PO 的活性[29,30]。
