不同注射条件对中华蜜蜂工蜂微量注射后生存的影响
2021-09-10刘佳霖李亚迎罗文华曹兰高丽娇刘怀
刘佳霖 李亚迎 罗文华 曹兰 高丽娇 刘怀
(1 重庆市畜牧科学院,荣昌 402460;2 西南大学植物保护学院,重庆 400715)
蜜蜂成年工蜂的微量注射技术已广泛应用于蜜蜂的生物学研究。在蜜蜂的RNA 干扰试验中,利用微量注射技术将目的基因的dsRNA 注入工蜂体内,可干扰目的基因的表达,进而评价目的基因的功能[1]。例如,中华蜜蜂(Apis cerana cerana)工蜂微量注射0.5μLCYP301A1、CYP303A1和CYP306A1的dsRNA能够显著降低虫体对应目的基因的相对表达量,而下调的这3 个P450(Cytochrome P450 monooxygenases)基因能够显著提高工蜂饲喂敌敌畏、噻虫嗪、百草枯和溴氰菊酯后的死亡率,表明P450 家族基因参与了中华蜜蜂对多种农药的解毒代谢[2]。此外,通过微量注射dsRNA 干扰卵黄原蛋白vitellogenin 基因的表达能够显著增加西方蜜蜂(Apis mellifera)的嗅觉敏感性[3],干扰IRS(Insulin receptor substrate)基因的表达能够改变工蜂的采集行为[4]。这些研究表明,基于成年工蜂微量注射的RNA 干扰技术对研究蜜蜂基因的功能具有十分重要的作用。与此同时,工蜂的微量注射还应用于评价不同物质及病原微生物对蜜蜂的影响,如微量注射章鱼胺和酪胺能够显著影响蜜蜂的运动行为[5]。注射接种蜜蜂残翅病毒能够显著降低工蜂的寿命,下调卵黄原蛋白vitellogenin基因的相对表达量;同时暴露于DWV 和噻虫嗪的工蜂表现出更低的寿命,并导致工蜂提前开始采集行为[6]。注射接种蜜蜂以色列急性麻痹病毒能够改变采集蜂的嗅觉敏感性,降低采集结束后的回巢成功率[7]。
尽管蜜蜂成年工蜂的微量注射技术已广泛地应用于蜜蜂的生物学研究,但不同注射条件是否能够显著影响工蜂注射后的生存仍没有相关报道。因此,本研究基于以前研究中的蜜蜂成年工蜂微量注射方法,通过单因素试验评价了不同注射日龄、麻醉方式、注射部位及注射量对工蜂注射后15d 生存的影响,以优化蜜蜂成年工蜂的微量注射技术,降低微量注射对蜜蜂的影响,为后续开展相关试验奠定基础。
1 材料
1.1 试验材料
本试验于2020年9月在重庆市荣昌区重庆市畜牧科学院进行,试验蜜蜂为重庆本地中华蜜蜂,2 个配置有姐妹蜂王的试验蜂群在自然条件下现代活框饲养,试验蜂群群势为5 足框蜂(2 脾子脾和2 脾蜜粉脾),试验期间周围环境日平均温度21~27℃。试验开始前,将即将出房的封盖子脾带回实验室,并放置在黑暗的人工气候箱(34℃,相对湿度70%)中过夜培养,以获得新出房的工蜂。待工蜂出房后,24h 内将来自不同蜂群的33~35 只新出房工蜂随机移入塑料饲喂盒(17cm×10cm×7cm)中饲养,每个饲喂盒提供3mL 50%(w/w)的蔗糖溶液,并放入另一个人工气候箱(30℃,相对湿度60%)中黑暗饲养。每天更换饲喂盒中的蔗糖溶液。根据后续试验设计,新出房的工蜂连续饲喂3d、7d 和12d 后用于中华蜜蜂成年工蜂的微量注射试验。
1.2 主要仪器
人工气候箱(RXZ智能型),购自宁波江南仪器厂;微量注射器(7632-01),购自美国Hamilton 公司;微量注射器针头(30G),购自美国Hamilton 公司。
2 方法
基于已有研究的蜜蜂成年工蜂微量注射方法[3,8-10]及预实验结果,本研究选择的基础注射条件为:3日龄工蜂,不麻醉,从中华蜜蜂工蜂背部的第4~5 腹节节间膜注入1μL 的DEPC 水。通过单因素试验评价不同注射日龄、麻醉方式、注射部位及注射量对工蜂注射后15d 生存的影响。每个处理注射30 只工蜂,并重复3 次。注射完成后的30 只工蜂被放入一个新的饲喂盒中,提供3mL 50%的蔗糖溶液,置于人工气候箱(30℃,相对湿度60%)中黑暗饲养。试验共计持续15d,每天记录各组工蜂的死亡数,移除死亡的工蜂,并更换蔗糖溶液。
2.1 不同注射日龄对中华蜜蜂工蜂注射后生存的影响
新出房的工蜂饲喂50%的蔗糖溶液3d、7d 和12d 后用于微量注射试验。3日龄、7日龄或12日龄的工蜂,不麻醉,从背部的第4~5 腹节节间膜注入1μL 的DEPC 水。3 个日龄的工蜂于同一天上午完成注射,注射完成后的工蜂被放入新的饲喂盒中,提供蔗糖溶液,每天检查工蜂的生存情况。
2.2 不同麻醉方式对中华蜜蜂工蜂注射后生存的影响
用玻璃试管取2~3 只3日龄的工蜂插入冰内放置2~3min(低温麻醉),待工蜂被麻醉后,将工蜂取出并从背部的第4~5腹节节间膜注入1.0μL的DEPC水,同时设置不麻醉对照组。注射完成后的工蜂被放入新的饲喂盒中,提供蔗糖溶液,每天检查工蜂的生存情况。
2.3 不同注射部位对中华蜜蜂工蜂注射后生存的影响
3日龄的工蜂,不麻醉,分别从背部的第2~3 腹节、第3~4 腹节、第4~5 腹节或第5~6 腹节节间膜注入1.0μL 的DEPC 水。注射完成后的工蜂被放入新的饲喂盒中,提供蔗糖溶液,每天检查工蜂的生存情况。
2.4 不同注射量对中华蜜蜂工蜂注射后生存的影响
3日龄的工蜂,不麻醉,从背部的第4~5 腹节节间膜注入0.5μL、1.0μL 或2.0μL 的DEPC 水。注射完成后的工蜂被放入饲喂盒中,提供蔗糖溶液,每天检查工蜂的生存情况。
2.5 统计学分析
试验数据的统计学分析在SPSS 21.0 中实现。采用生存分析的Kaplan-Meier estimator 获得不同试验组工蜂的生存曲线,利用Log-rank test 分析不同试验组生存曲线的统计学差异。与此同时,使用Cox 比例风险回归模型(Cox proportional hazards model)获得不同注射条件与基础注射条件相比的风险比值,以明确不同注射条件对工蜂注射后生存的影响。当风险比值<1 时,表明该注射条件对工蜂注射后生存的风险小于基础注射条件,当风险比值>1 时,表明该注射条件对工蜂注射后生存的风险大于基础注射条件。当P<0.05 时,差异达到显著水平,当P<0.01 时,差异达到极显著水平。
3 结果与分析
3.1 不同注射日龄对中华蜜蜂工蜂注射后生存的影响
本研究显示,不同注射日龄能够显著影响中华蜜蜂工蜂注射后的生存时间(图1A,χ2=24.82,df=2,P<0.01)。7日龄和12日龄工蜂注射后的平均生存时间分别为9.22d(χ2=11.01,P<0.01)和7.67d(χ2=23.82,P<0.01),极显著低于3日龄工蜂的11.44d;但7日龄工蜂和12日龄工蜂注射后的生存时间差异不显著(χ2=3.16,P>0.05)。Cox 比例风险回归模型分析显示,与3日龄工蜂相比,7日龄工蜂和12日龄工蜂注射后的风险比为1.78(χ2=9.33,P<0.01)和2.38(χ2=21.67,P<0.01),高日龄(7日龄和12日龄)工蜂注射后的生存风险极显著高于3日龄工蜂。
3.2 不同麻醉方式对中华蜜蜂工蜂注射后生存的影响
如图1B 所示,低温麻醉不能显著影响工蜂注射后的生存时间(χ2=1.53,df=1,P>0.05)。与不麻醉相比,中华蜜蜂工蜂低温麻醉后注射的风险比为1.27,虽然低温麻醉能够对工蜂注射后的生存产生更大的风险,但未达到显著水平(χ2=1.44,P>0.05)。
3.3 不同注射部位对中华蜜蜂工蜂注射后生存的影响
不同注射部位能够显著影响工蜂注射后的生存时间(图1C,χ2=134.28,df=3,P<0.01)。工蜂从背部第2~3 腹节节间膜注射后的平均生存时间为4.48d,极显著低于从第3~4 腹节(χ2=61.59,P<0.01)、第4~5腹节(χ2=80.37,P<0.01)和第5~6腹节(χ2=64.66,P<0.01)节间膜注射;工蜂从第3~4 腹节、第4~5 腹节和第5~6 腹节节间膜注射后的生存时间差异不显著(P>0.05)。与第4~5 腹节节间膜相比,从第2~3 腹节、第3~4 腹节和第5~6 腹节节间膜注射的风险比为4.91、1.27 和1.24,工蜂从背部第2~3 腹节节间膜微量注射的风险极显著高于从第4~5 腹节节间膜注射(χ2=72.42,P<0.01)。
3.4 不同注射量对中华蜜蜂工蜂注射后生存的影响
注射量不能显著影响中华蜜蜂工蜂注射后的生存时间(图1D,χ2=3.17,df=2,P>0.05)。与1.0μL相比,微量注射0.5μL 和2.0μL 的风险比为1.04(χ2=0.03,P>0.05)和1.36(χ2=2.39,P>0.05),差异不显著。
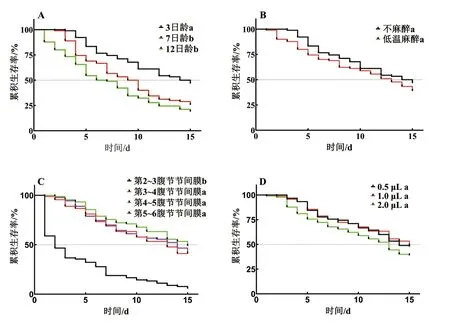
图1 不同注射条件对中华蜜蜂工蜂微量注射后生存的影响
4 讨论
为了优化中华蜜蜂成年工蜂的微量注射技术,明确不同注射条件是否能够显著影响工蜂注射后的生存,本研究利用单因素试验评价了不同注射日龄、麻醉方式、注射部位及注射量对工蜂注射后15d 生存的影响。结果显示,不同注射条件能够对工蜂注射后的生存产生不同的影响。工蜂进行微量注射时的日龄能够显著影响工蜂注射后的生存时间,7日龄和12日龄工蜂微量注射后的生存风险显著高于3日龄工蜂。该结果表明,低日龄的工蜂可能更适宜于开展蜜蜂的微量注射试验。在以前的研究中,绝大部分学者采用低日龄(0~5日龄)的工蜂进行微量注射[2,10-13],间接表明利用低日龄的工蜂开展微量注射试验能够有效降低注射对蜜蜂的影响,提高后续试验的准确性。此外,本研究采用实验室饲养的方式获得不同日龄的工蜂,但长时间的实验室离群饲养可能会对工蜂产生不利的影响,进而提高微量注射对工蜂生存的风险。Li 等人[7]利用从蜂群中获得的采集蜂评价了注射接种IAPV 对蜜蜂嗅觉敏感性的影响,表明利用从蜂群中获得的高日龄工蜂开展微量注射试验可能降低了注射对蜜蜂的影响。因此,若必须选择高日龄的蜜蜂开展微量注射试验,建议直接从蜂群中选择对应日龄的工蜂,并缩短试验时间,以降低微量注射对后续试验结果的影响。
从工蜂腹部进行微量注射是以前研究中常用的注射方法,但不同研究中注射的部位存在很大差异[3,5,10,11,14]。本研究显示,中华蜜蜂工蜂从背部第2~3 腹节节间膜注射后的平均生存时间显著低于从第3~4 腹节、第4~5 腹节和第5~6 腹节节间膜注射,表明不同注射部位能够对工蜂产生不同的影响。腹部是蜜蜂消化和生殖的中心,包含复杂的消化、循环、呼吸、神经、生殖和分泌等系统[15]。从腹部不同的部位进行微量注射可能会对其内部的复杂结构造成不同的伤害,最终对工蜂产生不同的影响。在开展中华蜜蜂工蜂微量注射时,应选择从背部第3~4 腹节、第4~5 腹节或第5~6 腹节节间膜进行注射,以降低微量注射对工蜂的影响。
低温麻醉是蜜蜂生物学研究中常用的麻醉方式[16-18],也广泛应用于工蜂的微量注射[3,7,8]。本研究显示,低温麻醉并不能够显著影响工蜂注射后的生存。因此,低温麻醉仍是提高蜜蜂工蜂微量注射效率的有效方式。此外,本研究选择以前研究中常用的3 个注射量(0.5μL、1.0μL 和2.0μL)[2,5,19],评价了不同注射量对工蜂注射后生存的影响。结果显示,微量注射0.5μL、1.0μL 和2.0μL 的DEPC 水并不能显著影响注射后工蜂的生存,表明这3 个注射量均可在工蜂的微量注射中使用。刘丽等人研究显示[10],与微量注射1μL 和2μL 的DEPC 水相比,注射3μL 和4μL 能够提高工蜂的死亡率,表明注射量的提高能够对蜜蜂产生更大的影响。因此,在实际的微量注射试验中,需要尽可能提高注射溶液的溶度,减少注射量,降低微量注射对工蜂的影响,以保证后续试验的准确性。
综上,本研究认为,低日龄的工蜂更适宜于开展中华蜜蜂的微量注射试验,在注射前可以采用低温麻醉工蜂的方式提高注射效率,推荐的注射方法为:从中华蜜蜂工蜂背部第4~5 腹节节间膜微量注射1.0μL的注射液。
