负载成骨生长肽的静电纺丝PLGA 支架可加速大鼠颅骨缺损再生
2021-09-10桑伟林陈燕敏宋滇文
王 聪,桑伟林,陈燕敏,宋滇文
1南京医科大学附属上海一院临床医学院骨科,上海 201620;2上海市第一人民医院教育处,上海201620
由创伤、肿瘤切除、感染等造成的骨缺损仍然是一个临床挑战[1,2]。骨组织工程学的发展为修复骨缺损开辟了新途径,旨在通过生物材料、细胞和骨生长因子协同组合诱导新的功能性骨再生,其中的关键组件是为新生骨组织提供结构支撑的支架材料。
聚乳酸-羟基乙酸共聚物(PLGA)是一类经FDA批准的具有良好生物相容性、低免疫源性的可生物降解高分子材料,在骨组织修复中有较大的应用研究前景[3]。但PLGA本身缺乏成骨活性,这极大地阻碍了其在骨组织工程中的应用。成骨生长肽(OGP)是一种由14个氨基酸构成的天然短肽[4-6],研究发现OGP可以加速体内骨愈合速率,增加骨小梁的密度和质量[7],在骨组织修复中具有极大的临床应用前景[8,9]。目前,OGP已经被负载于PLGA大孔支架[3],各种聚合物膜[10-12],包括:细菌纤维素、胶原蛋白和脲醛树脂-聚醚,以及3D打印支架[13,14]等材料,用于骨组织修复和再生。利用静电纺丝制备的纤维支架具有孔径小、纤度细、比表面积大等优点,是一种理想的组织工程支架[15]。然而,对于OGP 负载于PLGA静电纺纳米纤维支架的研究未有报道。为了更有效地促进骨组织的再生,有必要寻找合适的OGP浓度来负载PLGA纳米纤维支架。
在PLGA纳米纤维支架中,引入成骨生长肽OGP,可使两者的性能互补。本文通过静电纺丝技术制备了含有不同浓度OGP 的PLGA 纤维支架(OGP @PLGA),为了评估OGP@PLGA支架在骨组织工程中的应用潜力,本文表征了支架的微观结构、OGP释放率、生物相容性及成骨活性,为该支架材料的临床应用提供前期的实验基础。
1 材料和方法
1.1 主要材料及试剂
聚乳酸-羟基乙酸共聚物(PLGA,70:30)(山东岱罡生物工程有限公司);六氟异丙醇(HFIP)(上海达瑞化学有限公司);成骨生长肽(OGP)(上海源叶生物有限公司);碱性磷酸酶试剂盒,茜素红S染液以及PBS缓冲液(北京索莱宝生物科技有限公司);DMEM/F12,胎牛血清(FBS),青霉素和链霉素溶液(Gibco);大鼠骨髓间充质干细胞(rBMSCs)(中国科学院上海细胞库);钙黄绿素-碘化丙啶试剂盒,CCK-8试剂盒(上海碧云天生物科技有限公司);人源成骨生长肽Elisa试剂盒(上海江莱生物科技有限公司);鬼笔环肽(Phalloidin)和4',6-双脒基黄-2-苯基吲哚(DAPI,Thermal Scientific)。
1.2 材料制备
将PLGA溶解在HFIP中,形成质量分数为20%的溶液,在室温下搅拌2 h后,往混匀的溶液中加入质量体积比为0.1%、0.2%、0.4%的OGP,继续搅拌12 h,然后将混合溶液转移至体积为10 mL的医用注射器中,连接上型号为20 G的针头,随后将注射器置入静电纺丝机中的推进泵,电压大小设置为12 kV,推进泵速率设定为1.2 mL/h,并在推进泵下方放置一块大小为30 cm×30 cm的铝箔纸片作为接收板,该接收板与推进泵上针尖的距离为15 cm,整个纺丝过程约为1.5 h。纺丝过程结束后,将接收板上纤维膜揭下来放置于真空干燥箱中48 h,以除去膜上残留的有机溶剂。具有不同重量比的OGP(0.1%、0.2%和0.4%)的OGP @ PLGA 分别命名为0.1%OGP@PLGA,0.2%OGP@PLGA和0.4%OGP@PLGA。
1.3 形貌表征
将制备得到的支架裁剪成合适大小的样品,然后以10 kV的加速电压将金溅射在大孔支架表面,并在SEM(Phenom,XL,Netherland)中观察支架的微观形貌。使用Image J 1.40软件(NIH,美国)对典型SEM图像进行至少50次测量,得到支架的平均纤维直径。
1.4 体外多肽缓释
将膜材料裁剪成大小一致,且质量接近的样品,然后将样品浸入装有PBS(pH 7.4)的离心管中,样品质量与溶液体积比例为1∶10,离心管放置在摇床里,摇床温度为37 ℃,振荡速率为120 r/min。每隔24 h从离心管中吸取50 μL的浸提液,并补充新鲜的PBS 50 μL。将浸提液统一保存在-20 ℃冰箱中,最后根据产品说明书用Elisa试剂盒测定支架上OGP的释放量。
1.5 体外生物相容性
1.5.1 rBMSCs细胞的培养 rBMSCs细胞购买自中科院上海细胞库。细胞培养在体积为37.5 cm2大小的细胞培养瓶中,使用的培养基为DMEM/F12培养基,培养基中含有1%的双抗和10%的胎牛血清。应用常规细胞恒温培养箱培养细胞,内部CO2体积分数为5%,温度为37 ℃,湿度为95%,待细胞融合度达80%以后,去除培养基,加入含EDTA 的胰酶消化细胞传代,比例为1∶3。
1.5.2 细胞活性测试 将支架裁剪成直径为14 mm大小的圆片,置于24孔板细胞培养板中,紫外灯照射灭菌60 min,随后用少量PBS湿润材料,将处于对数生长期的细胞消化下来,借助Countstar细胞计数仪将细胞悬液浓度调整至5×104/mL,接种1 mL细胞悬液到材料上,然后培养细胞。分别在接种后的第1、4和7天取出接种有细胞的支架,用PBS洗涤后,每个支架上滴入200 μL配置好的钙黄绿素-碘化丙啶混合液,避光孵育45 min,随后用PBS 洗涤2 遍,置于荧光倒置显微镜(BX53,Olypmus)下观察拍照。
1.5.3 细胞增殖实验 将密度为5×104/mL(1 mL)的rBMSCs接种到直径为14 mm的材料上,在第1、4和7天时用PBS洗涤3遍,然后向每个材料上滴加300 μL 含有10%CCK-8的未完全培养基,避光孵育90 min,然后从每孔中取100 μL转移到96孔板中,用酶标仪于450 nm的波长处测得各孔的吸光度(A450nm)。
1.5.4 细胞骨架染色 将密度为5×104/mL(1 mL)的rBMSCs接种到直径为14 mm的材料上,在第3天时将样品用PBS洗涤3遍,随后用4%低聚甲醛于4 ℃固定2 h,用0.1%Triton X-100透化,并用1%BSA封闭30 min,然后用Phalloidin和DAPI避光染色10 min。用激光共聚焦扫描显微镜(CLSM)(LSM 700,Zeiss,Germany)拍摄图像。
1.6 体外成骨分化评估
1.6.1 ALP活性测试 研究表明,碱性磷酸酶(ALP)是反映成骨细胞活性或功能状况的重要指标。因此本实验我们将密度为1×106/mL(1 mL)的rBMSCs 接种到14 mm直径的支架上,每隔3 d更换一次新鲜的骨诱导培养基。在第7、14天时分别吸出培养基,用PBS洗涤3次后加入300 μL 0.2%Triton-X裂解细胞,随后在4 ℃下高速离心5 min,然后再根据ALP试剂盒和BCA试剂盒说明书计算每组中ALP的含量。
1.6.2 ARS染色 茜素红染色(ARS染色)能够检测干细胞分化为成熟成骨细胞后在细胞表面沉积的钙盐,即钙结节。因此将密度为1×106/mL(1 mL)的rBMSCs接种到14 mm直径的支架上,每隔3 d更换一次新鲜的骨诱导培养基。在第7、14天时分别吸出培养基,用4%的多聚甲醛在4 ℃下固定样品30 min,随后用去离子水清洗样品3 次,在室温下用2%浓度的茜素红S 染料染色10 min,随后吸除多余的溶液,用倒置显微镜(BX53,Olypmus)观察矿化结节的数量。
1.7 动物实验
1.7.1 模型建立 从上海杰斯杰实验动物有限公司购买了平均体质量为280~300 g 的雄性SD 大鼠(20180004025675),随机分为3组。所有手术均在上海第一人民医院动物中心进行,已获得上海第一人民医院动物保护与使用委员会(批准号:2019AWS0008)的批准。首先持续通入3%异氟醚对SD大鼠进行麻醉,常规消毒,铺单后沿颅骨中线切开表皮,小心分离皮肤、软组织、骨膜后,暴露出大鼠平坦颅骨,用环钻小心切割出直径为5 mm的圆形骨缺损,然后随机植入3组不同的材料,分别是空白对照组,纯PLGA组以及0.4%OGP@PLGA组,随后逐层缝合伤口。术后8周,所有大鼠均腹腔注射过量戊巴比妥钠致死,用于后续实验分析。
1.7.2 Micro-CT检测 为检测颅骨骨质形成情况,我们采用Micro-CT(Skyscan 1176,Belgium)对固定后的样本进行扫描检测,参数设定为电压65 kV,电流100 μA,分辨率120 μm。同时将扫描后得到的二维图像通过内置的SkyScan CTVOX2.1软件重构三维图像。
1.7.3 组织形态学分析 为进一步从组织形态学角度检测颅骨骨质形成情况,我们将所得颅骨样品用10%EDTA脱钙4 周,随后用去离子水不断冲洗掉剩余脱钙液,依次放入梯度浓度的乙醇溶液(70%,80%,90%,95%,100%)脱水2 h,再用常规石蜡包埋样品,进行切片,切片厚度为5 μm,随后切片转移到65 ℃烤片机上烘烤2 h,最后按厂商说明书进行HE和Masson染色,其中HE染色主要从整体水平检测新生骨组织结构,Masson染色则主要检测细胞外I型胶原形成情况。
1.8 统计学分析
利用origin 2019b软件处理数据,实验中的计量数据釆用均值±标准差来表示。单因素方差分析进行组间检验,当P<0.05时,表示差异具有统计学意义,以上每组实验测试至少3个平行样本。
2 结果
2.1 形貌表征
图1A~D 为本实验制备的含不同浓度OGP 的PLGA纤维支架的扫描电镜图,可以得出四组膜支架都是由均匀连续的微纳纤维相互堆叠而成,没有断裂纤维及空泡形成。如图1E所示,依据Image J图像分析软件测得PLGA组的平均纤维直径为2.117±0.408 μm,其他三组的纤维直径为2.283 ± 0.347 μm(0.1%OGP@PLGA)、1.997±0.398 μm(0.2% OGP@PLGA)和2.025±0.509 μm(0.4%OGP@PLGA)。如图1F所示为各组支架的水接触角测试结果,利用Image J 图像分析软件测得,纯PLGA支架的水接触角大于90°,为144.30±7.32°。而负载OGP的支架,其水接触角均有所减小,并显著小于purePLGA组(P<0.01),0.1OGP@PLGA、0.2%OGP@PLGA以及0.4%OGP@PLGA的水接触角分别为74.09±5.21°、78.84±5.97°以及71.57±14.80°。

图1 支架微观形貌观察及水接触角Fig.1 SEM images of pure PLGA (A),0.1% OGP@PLGA (B),0.2% OGP@PLGA (C) and 0.4% OGP@PLGA (D)scaffolds.E:Distribution of fiber diameter.F:Water contact angle of each scaffold.**P<0.01 vs pure PLGA.
2.2 OGP缓释研究
负载不同浓度OGP电纺PLGA支架的OGP释放曲线显示:0.4% OGP@PLGA,0.2% OGP@PLGA,0.1%OGP@PLGA三组样品10 d内OGP的累计释放量分别是(68.5±3.2)%,(55.3±4.7)%和(47.8±2.5)%。同时,负载了高浓度OGP的PLGA膜显示出更快的释放速率(图2)。
2.3 材料生物相容性
细胞染色结果显示:第1天,不同样品上绿色的活细胞密度十分接近,随着培养时间的增加,0.2%OGP@PLGA组和0.4%OGP@PLGA组上的绿色的活细胞密度明显要高于其余的两组,这在第7天尤为明显,相比于纯PLGA组和0.1%OGP@PLGA组上依然较为稀疏的细胞分布,0.2% OGP@PLGA 组和0.4%OGP@PLGA组上的细胞已经密集到有开始汇聚融合的趋势(图2A)。成骨细胞在不同支架上体外增殖的CCK-8检测结果(图3B)。第1天时,各组吸光值没有显著差异,都在0.15左右,经过4 d和7 d培养后,支架上的吸光值有着不同程度的上升,其中,0.2%OGP@PLGA和0.4%OGP@PLGA组的吸光度在第4天和第7天的吸光度都要显著高于对照组PLGA(P<0.01),并且0.4%OGP@PLGA组有着最高的吸光度。
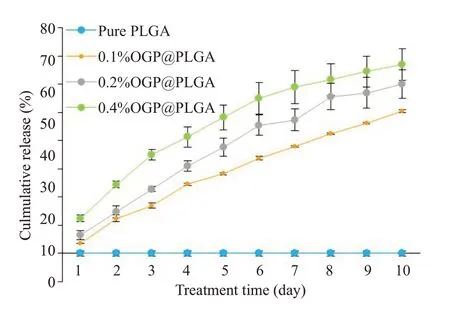
图2 OGP累计释放曲线Fig.2 Cumulative release of OGP from the scaffolds in 10 days.

图3 生物相容性评估Fig.3 Biocompatibility evaluation of the scaffolds.A:Live and dead fluorescence images(Original magnification:×40).B:CCK-8 assay of rBMSCs cultured on pure PLGA,0.1%OGP@PLGA,0.2%OGP@PLGA and 0.4%OGP@PLGA at 1,4,and 7 days after cell seeding.**P<0.01 vs pure PLGA.
第3天时rBMSCs在不同PLGA支架上的黏附情况显示:rBMSCs较为均匀地分布在支架上,细胞骨架均匀舒展开来,能隐约观察到细丝状的肌动蛋白,伪足紧紧黏附在支架表面,染色明显(图4)。
2.4 ALP活性表达和ARS染色
rBMSCs的ALP活性表达随着培养时间的增加而上升,但是无论是在第7天还是第14天,我们可以发现纯PLGA组上的细胞所表达的ALP活性最低,而0.4%OGP@PLGA组上的细胞ALP活性表达量最高,在第14天达到最大值,具有显著性差异(P<0.01,图5B)。
分别在成骨诱导分化后的第7天和第14天对4组样品进行茜素红染色(图5A)。可见纯PLGA组基本上观察不到红色的矿化结节。随着培养时间增加,负载了OGP的PLGA纤维膜上,矿化结节的数目明显增多,并且其含量与PLGA中OGP的含量成正比,第14天时,负载0.4%的PLGA纤维膜上红色结节数目最多,且有连成一片的趋势。
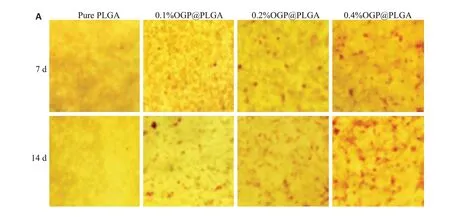
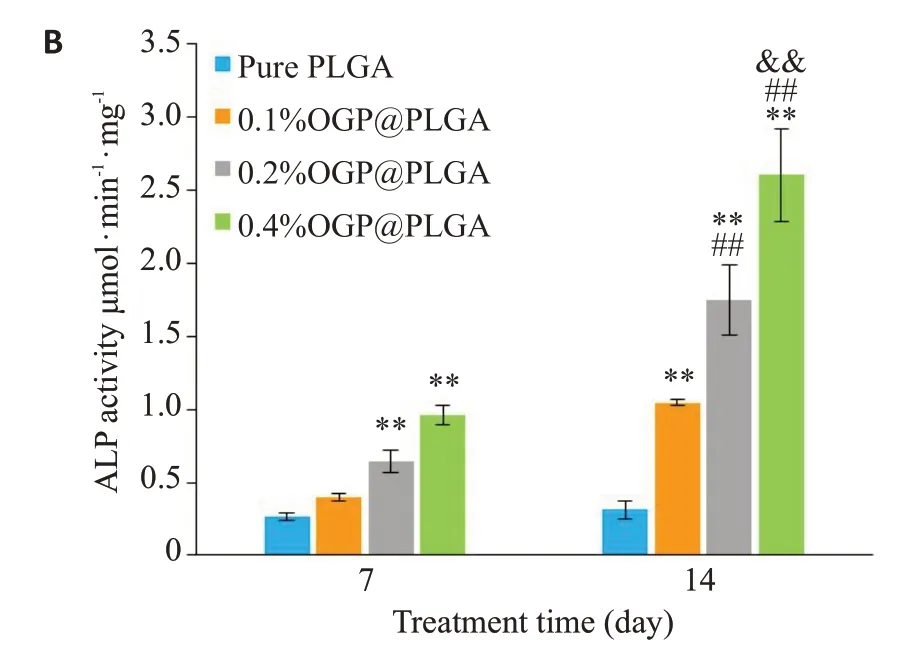
图5 体外支架促成骨分化评估Fig.5 Evaluation of the osteoinduction ability of the scaffolds in vitro. A,B:ARS images and ALP activity at 7 and 14 days after cell seeding during osteogenic induction.**P<0.01 vs pure PLGA;##P<0.01 vs 0.1% OGP@PLGA;&&P<0.01 vs 0.2%OGP@PLGA.
2.5 Micro-CT检测
进一步在体内表征OGP@PLGA支架对大鼠颅骨缺损的修复情况,考虑到动物福利及伦理,只选取0.4%OGP@PLGA组作为实验组。术后8周大鼠颅骨缺损部位的三维重构图显示0.4%OGP@PLGA组的修复效果最好(图6A),Micro-CT 软件分析发现(图6B),经0.4%OGP@PLGA组处理后,大鼠颅骨缺损处的新生骨量要显著多于其他两组(P<0.01)。

图6 体内支架成骨分化评估Fig.6 Micro-CT analysis(A)and new bone volume(B)in the cranial bone defect area after 8 weeks of treatment.**P<0.01vs control;##P<0.01vs pure PLGA.
2.6 组织学结果
组织学染色结果显示:8周以后,细胞已经开始渗入植入的PLGA和0.4%OGP@PLGA材料内部,并且0.4%OGP@PLGA组中可以发现更多的新生组织。根据Masson染色,我们确定了0.4%OGP@PLGA组内有更多的新生骨小梁结构和胶原沉着(图7)。
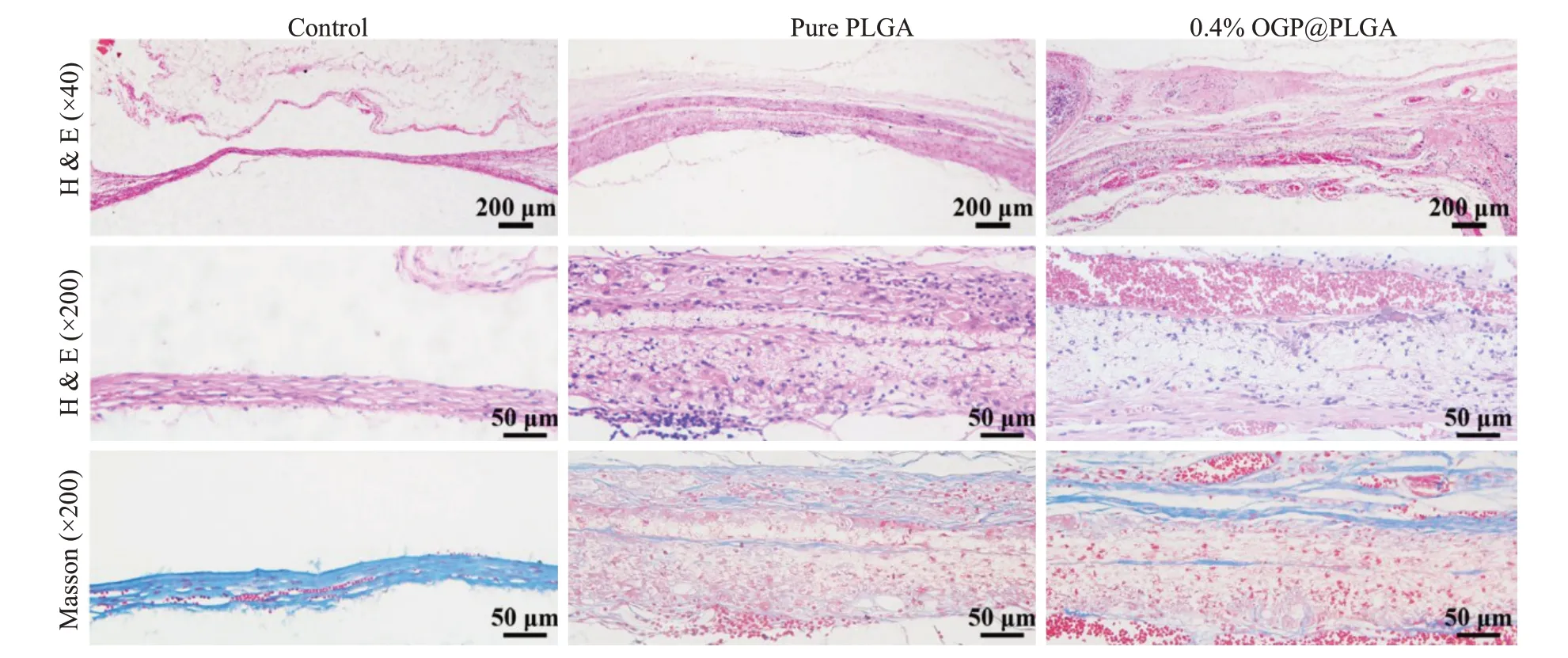
图7 颅骨缺损部位HE和Masson组织切片染色Fig.7 HE staining and Masson staining of the cranial bone defect at 8 weeks in 3 groups.
3 讨论
本研究的主要目的是制备一种能促进骨缺损修复的骨组织工程支架,评估其临床应用前景。已有大量研究表明,细胞外基质(ECM)在细胞的生长,分化,潜移中具有重要作用[16,17],ECM仿生支架能促进组织再生。因此理想的组织工程支架,其理化性质应当尽可能地与细胞外基质(ECM)相类似,从而为缺损部位的骨相关细胞提供一个良好的微环境,来加速骨组织的再生修复。在本研究中,我们设计负载了OGP 的PLGA 纤维支架。作为一种多肽,OGP在骨骼的重构再生中起着关键性的作用,并且不像TGF-β1等生长因子一样容易失活[18]。我们期望该支架一方面能模仿ECM的纤维结构,另一方面将OGP复合可以提高该支架的生物活性,同时OGP作为活性因子调控加速组织修复。
静电纺丝制备的纤维时常会受到纺丝液组分,电压以及纺丝环境湿度等影响[19-21]。OGP是一种小分子多肽,其时常被用于通过物理吸附的方法来改善材料的成骨活性。在本实验中,我们发现通过静电纺丝复合的OGP@PLGA纤维支架的形貌没有明显变化,各组的纤维直径分布较为均匀,无显著性差异。负载了OGP的PLGA静电纺丝支架完整地保留了其纤维结构,这种高比表面积的结构十分有利于组织再生,它能为细胞提供充裕的黏附空间,并且也利于物质代谢交换[15]。同时,由于其OGP结构中存在大量羧基以及羟基,接触角实验结果表明复合OGP的PLGA系列支架的亲水性显著低于纯PLGA组(P<0.01),由疏水性表面转变为更适于细胞黏附增殖的亲水性表面,这与先前文献中报道的相类似,Liu等发现修饰了OGP的PLA支架其亲水性有了显著性提高[22]。同时,我们还发现静电纺OGP@PLGA支架能缓释OGP长达10 d以上,并且在第1天有显著的突释现象,这一现象可能是由于亲水性OGP在疏水性PLGA材料中的快速扩散所导致的[23]。
对于生物材料来说,良好的生物相容性是其具备应用价值的首要条件。本实验中我们选择了rBMSCs来体外验证负载OGP 的PLGA 纤维膜的生物相容性,rBMSCs作为一种干细胞后期能诱导分化为成骨细胞,是骨组织工程实验中最常用的种子细胞之一[24,25]。以纯PLGA支架为对照组,综合活死细胞染色,细胞增殖实验以及细胞形态表征实验的结果,我们发现通过电纺的方式将OGP掺入没有影响PLGA纤维支架的生物相容性,并且在一定程度上能赋予PLGA材料更优异的生物相容性,这在0.2%OGP@PLGA 和0.4%OGP@PLGA两组的实验结果上最为明显,依据活死细胞染色结果,该两组纤维膜支架材料上的rBMSCs不仅没有出现死亡的情况,其活细胞密度还更高,活死细胞染色结果也被CCK-8 细胞增殖实验结果证实,0.4%OGP@PLGA组有着最高的吸光值,说明该支架上的细胞有着最高的增殖率,具有最优异的生物相容性。这可能是由PLGA纤维支架中缓释出的适量OGP所导致的。该结果与之前的报道类似,Hou等[26]发现接枝在材料上的OGP能显著促进MC3T3-E1成骨细胞的增殖。Saska等[11]也观察到了类似的结果,他们将纤维素/胶原/羟基磷灰石复合支架浸泡在含有OGP的溶液一段时间后,发现吸附了OGP的复合支架能显著提高骨细胞的增殖速率。
ALP是一种典型的早期成骨分化标志物,同时,在成骨分化后期,骨细胞本身及周围会沉淀大量钙结节[27]。因此,ALP活性检测以及ARS染色是两种常用的评估干细胞成骨分化水平的方法。前Saska发现[10],生长在含有OGP的胶原-细菌纤维素膜上MC-3T3E1细胞其ALP活性以及钙结节分泌程度要明显高于种植在胶原-纤维素膜上的细胞。本研究中,我们得到了相近的结果,相比于纯PLGA 支架,负载0.4% OGP 的PLGA纤维支架能显著促进rBMSCs的ALP水平表达以及ARS染色深度,表明了0.4%OGP@PLGA支架具有更优异的成骨诱导能力。已有研究表明,OGP作为局部骨髓损伤全身成骨反应机制中的一个关键角色,不仅能刺激成骨细胞的增殖,而且能通过一种自我调节的反馈机制,来促进成骨分化[28,29]。在本研究中,OGP加入PLGA支架后,可以维持局部释放,从而促进rBMSC的增殖和成骨分化。最后,我们在体内实验中验证了0.4%OGP@PLGA纤维膜可以促进颅骨缺损修复,表明负载有OGP的PLGA电纺膜是一种很有前途的骨组织工程支架。
综上所述,在本研究中,我们首先通过了静电纺丝的方法制备得到含有不同含量OGP的PLGA纤维支架,该系列OGP@PLGA支架均具有类似ECM的结构,且能缓释支架中的OGP长达10 d,随后的体外生物相容性实验和成骨诱导分化实验结果表明,0.4%OGP@PLGA具有最优异的生物相容性和促成骨分化能力,同时,进一步的体内颅骨修复实验结果表明0.4%OGP@PLGA支架的修复效果要远远优于纯PLGA组及空白组,是一种潜在的理想骨组织工程支架,有望在临床上得到应用。虽然负载有OGP的材料膜在促进骨缺损修复方面取得了积极的结果,但我们的研究仍然存在一些局限性,例如,本研究中所使用的是颅骨缺损模型,其成骨机制是膜内成骨,与股骨、肋骨等长骨的骨发生机制有所不同,后者是基于软骨的骨化机制[30],因此本研究可能无法完全模拟临床上常见的大段骨缺损的再生效果。除此之外,对于体内实验结果我们也未能进一步的论证,诸如通过免疫组化染色和蛋白免疫印迹来分析0.4%OGP@PLGA支架是通过怎样的分子机制来加速骨修复过程的,这也是我们后续进行深入研究的方向之一。
