3种转化人参皂苷CK菌群的结构与多样性
2021-09-10孙海明王金龙
孙海明,王 晶,王金龙
(1.北华大学药学院,吉林 吉林 132013;2.吉林省中药生物技术科技创新中心,吉林 吉林 132013;3.北华大学理学院,吉林 吉林 132013)
人参素有“百草之王”之称,由于其特有的生理学和药理学特性而被广泛利用[1].人参皂苷是人参质量评价的重要指标,其分布及含量在不同品质的人参中有明显的差异.目前,从三七或人参等中草药中已经分离鉴定出100余种人参皂苷,其中,超过了90%的人参皂苷属于Rb1、Rb2、Rc、Rd、Re、Rf和Rg[2-3].以往的研究[4]表明:经过不同方式转化后的人参皂苷其次级代谢产物具有更强的药用活性,我们将这些次级代谢产物称为稀有人参皂苷,包括Rh1、Rh2、F1、F2、Rh3、Rg3、CM、CY和CK在内的稀有人参皂苷在人参中的含量极少,人体胃肠道对常见主要人参皂苷的吸收率相对较低,而稀有人参皂苷则更容易被人体吸收并发挥作用[5].
天然的二醇型人参皂苷Rb1、Rb2、Rc可在人肠道内转化为稀有人参皂苷CompoundK(CK)[6-7],作为一种潜在的天然药物,稀有人参皂苷CK在体内和体外都有良好的抑制肿瘤细胞增殖和转移的作用[8-9].另外,人参皂苷CK在延缓衰老[10]、调节神经及抗感染等方面都有很好的效果.因此,如何实现人参皂苷CK的规模生产是人参皂苷相关研究的重点课题之一.目前,人参皂苷CK主要通过微生物转化或糖苷酶水解制备,作为一个多靶点、高活性化合物,CK具有广阔的应用前景和开发价值.
微生物转化是目前能够转化人参皂苷CK的主要方法之一,它是利用微生物个体在生长发育过程中产生并释放的生物酶定向水解主要人参皂苷而获得稀有人参皂苷的代谢过程.微生物在转化人参皂苷CK的过程中会产生多种生物酶,主要包括阿拉伯呋喃糖苷酶、半乳糖苷酶和葡萄糖苷酶,这3种酶可在第3个、第6个和第20个C处断开糖基,从而实现对人参皂苷的转化[11].与物理转化和化学转化方法比较,微生物转化具有一定的优势,主要体现在微生物转化安全性高、作用周期短、成本较低、副产物少等方面[5].近年来,国内外在微生物转化稀有人参皂苷的研究方面已有一定进展.目前,利用微生物转化方法开展人参皂苷CK制备可为其产业化生产提供依据.但目前的大部分研究仍处于起步阶段,微生物转化法生产CK仍然存在技术难题.关于微生物转化人参皂苷的研究主要集中在单一菌株的转化,而往往自然界中的微生物具有复杂而密切的协同关系.崔宗均等[12]首次提出了微生物菌群在纤维素降解方面的作用,通过构建分解纤维素菌群,发现其比单一菌株更加高效,进而推动了纤维素资源的开发和利用.但是关于人参皂苷的微生物菌群转化方面的研究很少.因此,研究对人参皂苷转化能力强的高产复合菌群,寻找在人参皂苷转化中具有密切合作关系的微生物群落,能够为生产稀有人参皂苷CK提供一个新的思路,对微生物转化人参皂苷CK大规模生产的实现提供可能.因此,本研究从3种来自长白山人参栽培基地的土壤中筛选出能够高效转化人参皂苷CK的复合菌群,比较不同群落中细菌的群落组成和多样性,以探讨微生物群落组成与人参皂苷CK转化之间的关系,为CK的微生物转化研究提供新的方向,也为稀有人参皂苷微生物转化的大规模生产提供理论依据.
1 研究方法
1.1 土壤样品的采集
土壤样品采自吉林省抚松县人参栽培基地,分别采集15、20、25和30 a人参栽培地共计18个土壤样品,装入已经灭菌的牛皮纸袋中,4 ℃冰箱保存.
1.2 富集培养
取1 g土样溶于9 mL无菌蒸馏水中,稀释100倍,取0.1 mL接种在人参总皂苷浓度为0.1%的R2A、MRS、PDA、LB 4种液体培养基中,30 ℃富集培养7 d.
1.3 发酵培养
取富集培养物0.5%接种量接种至底物浓度为0.1%的R2A、MRS、PDA、LB 4种液体培养基中,37 ℃、120 r/min条件下发酵培养15 d.
1.4 人参皂苷CK转化量测定
在上述实验条件下对人参皂苷进行转化,应用HPLC法测定人参皂苷CK含量.
1.5 DNA抽提和PCR扩增
选择上述实验中转化率最高的3个微生物群落,使用 E.Z.N.A.®土壤 DNA 试剂盒(Omega Bio- tek,Norcross,GA,U.S.)提取土壤样品微生物 DNA.提取 DNA 浓度以及纯化由 NanoDrop 2000紫外可见分光光度计检验,利用 1% 琼脂糖凝胶电泳检测微生物DNA 质量.细菌16S rRNA 基因的 V3~V4 高变区通过热循环仪 PCR 系统(GeneAmp 9700,ABI,美国)用引物 338F(5′-ACT CCT ACG GGA GGC AGC AG-3′)和 806R(5′-GGA CTA CHV GGG TWT CTA AT-3′)进行扩增.PCR反应使用以下程序进行:95 ℃变性3 min,95 ℃ 30 s,55 ℃退火30 s,72 ℃延伸45 s,27个循环,最后延伸在72 ℃下保持10 min.PCR 反应在 20 μL 混合物中进行3次,其中包含 4 μL 5 × FastPfu 缓冲液、2 μL 2.5 mmol dNTP、0.8 μL每种引物 (5 μmol/L)、0.4 μL FastPfu 聚合酶和10 ng模板 DNA.从 2% 琼脂糖凝胶中提取得到的 PCR 产物,使用 AxyPrep DNA 凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)进一步纯化,并根据制试剂盒Quanti FluorTM-ST(Promega,USA)的使用说明进行质量检测.
1.6 Illumina MiSeq 测序
根据宏基因组测序的标准方案,利用纯化后的扩增片段PE 2*300文库构建Illumina MiSeq 平台(Illumina,San Diego,USA).构建文库步骤:首先,先进行“Y”字形接头的连接;其次,利用磁珠筛选去除接头自连片段;再次,利用PCR扩增进行文库模板的富集;最后,利用氢氧化钠变性,产生单链DNA片段.
1.7 测序数据的处理
质控标准:原始fastq文件由Trimmomatic进行质量控制,并由 FLASH 进行拼接,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列;引物精确匹配,允许2个核苷酸错配,并删除不明确碱基;重叠超过10 bp的序列,然后根据它们的重叠序列进行合并.
使用UPARSE(版本 7.1,http:∥drive5.com/uparse/)对操作分类单元 (OTU)进行聚类(相似度97%),并使用UCHIME识别和删除嵌合序列.每个16S rRNA 基因序列的分类通过RDP分类器算法(http:∥rdp.cme.msu.edu/)针对Silva(SSU123)16S rRNA 数据库使用70%的置信阈值进行分析.
2 结 果
2.1 高通量测序结果
采用Miseq测序技术对微生物16srDNA基因进行测序分析,3个微生物菌群共测得原始序列143 232条,质量控制后剩余141 384条,长度分布为250~380 bp,平均序列长度为337.3 bp.样品经过滤、拆分、去冗余后按97%的相似度进行OTU分析和聚类,一共得到2 017个OTUs.所有优质序列经比对鉴定得到3个门、15个纲、32个目、66个科、82个属、95个种的微生物分类学信息.所有土样的稀释曲线随有效序列数目增加而逐渐平缓(见图1),说明本次取样基本能反映真实环境.由图2可以看出,不同土壤微生物OTU 数目中,R48获得的 OTU 数目最多(770),其次是 R43(754),R47 最低(644).3组土壤共有的OTU数目较少(31),每个样本中独有的OTU数较多,在R48、R43和R47中分别为673、652和572.
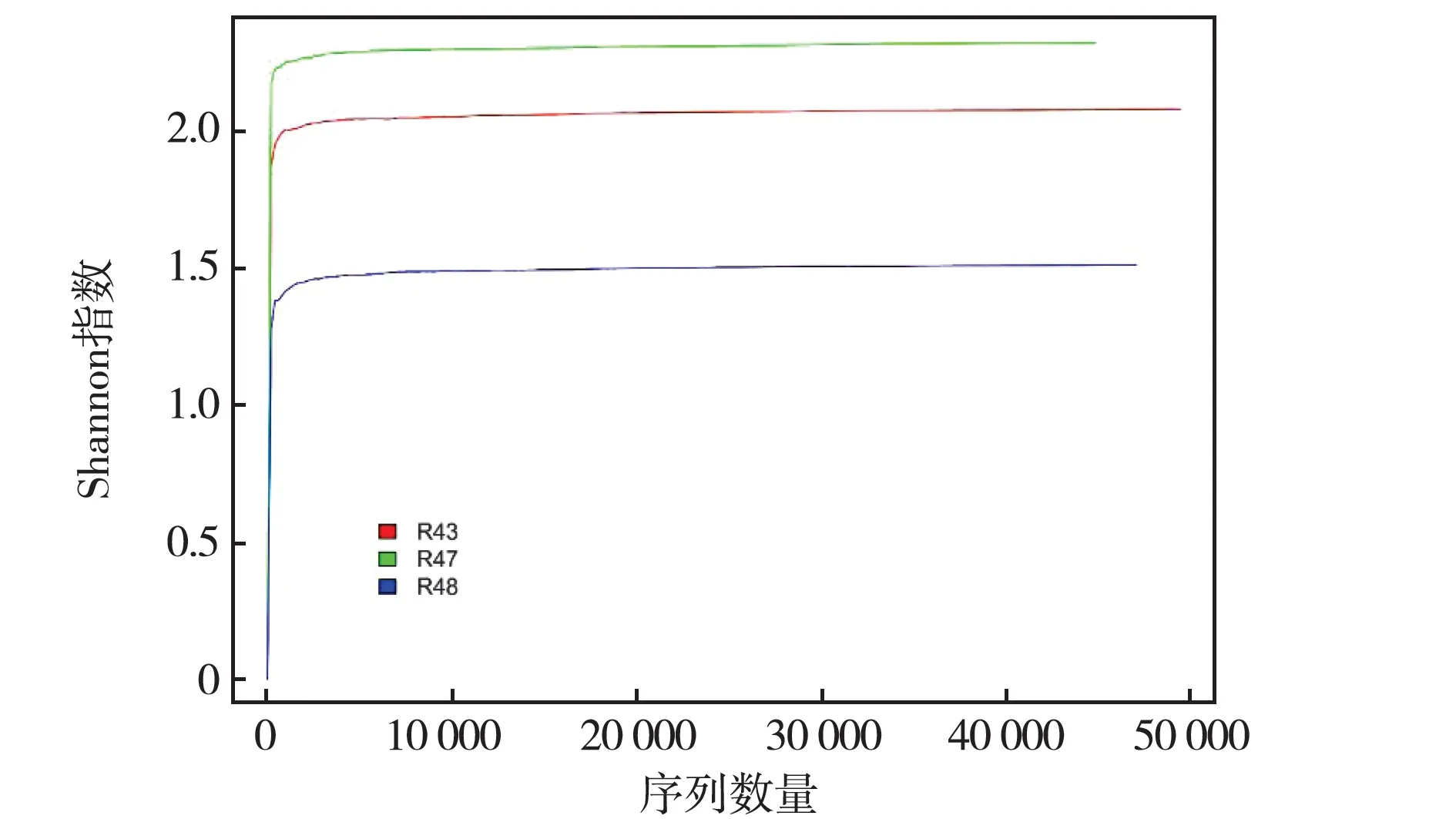
图1 Shannon指数稀疏曲线Fig.1Rarefaction curves of Shannon index

图2 样本间OTUs分布的韦恩图Fig.2Venn diagram of OTUs among samples
2.2 不同转化人参皂苷CK菌群的群落组成
在门分类水平上(见图3),3种能够转化人参皂苷CK的菌群中含有大量未分类的微生物,组成比例为47.5%~77.2%.而在有注释的微生物中,有3 种菌群中以子囊菌门(Ascomycota)为主,其相对丰度分别为14.7%~38.1%,子囊菌门的组成比例在R47菌群中最高(38.1%),但在R48菌群中比例最低(14.7%).同时在 3 种菌群中还含有少量的接合菌门(Zygomycota)、担子菌门(Basidio-mycota).
在微生物的属水平分析中,根据菌群相对丰度,选取前20的种属,将未鉴定的种属去除后制图,观察3种人参皂苷CK转化菌群中的种属分布情况(见图4).结果表明:在3种菌群中,未知菌属所占比例较大;已知菌属中,占比达 2%以上的菌属有Penidiella、纤孔菌属(Inonotus)、赤霉菌属(Gibberella)、马拉色氏霉菌属(Malassezia)、Ophi-osphaerella.其中Penidiella为核心菌属,在R43土壤中最高(14.95%),R48土壤中最低(4.37%).马拉色氏霉菌属在R47中含量最高(7.67%),R43土壤中含量为3.54%,R48土壤中含量最低(1.07%).其他相对丰度大于 0.3%的菌属有曲霉属(Aspe-rgillus)、单孢酿酒酵母(Kazachstania)、线黑粉酵母属(Filobasidium)、核腔菌属(Pyrenophora)等属.

图3 3种土壤中门水平的微生物群落组成Fig.3Community composition of microorganisms in three kinds of soil at phylum level
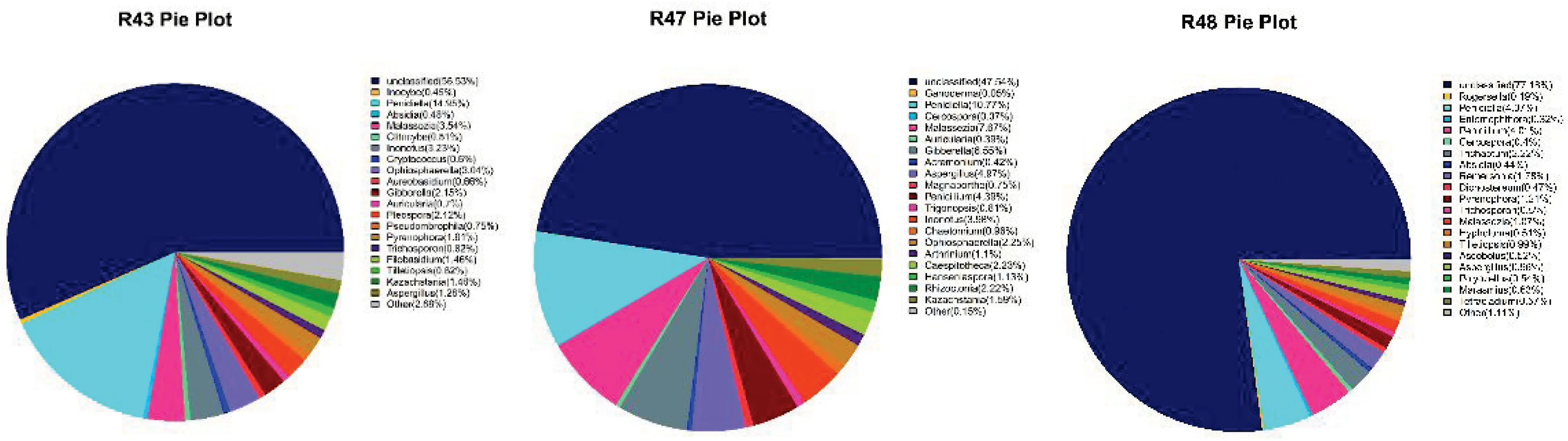
图4 3种土壤中属水平的微生物群落组成 Fig.4Community composition of microorganisms in three kinds of soil at genus level
2.3 不同人参皂苷CK转化微生物群落的多样性分析
3种能够高效转化人参皂苷CK菌群中微生物α多样性指数的统计结果见表1.结果表明:3种菌群中微生物的Shannon指数在R47样本高于R43和R48.R48菌群中的ACE指数最高,R47中最低.Chao1指数在R48中最高,但是在R43中最低,Coverage指数在3个样本中无变化,Simpson指数表现出与Shannon指数相反的变化趋势,在R48中最高,而在R47中最低.
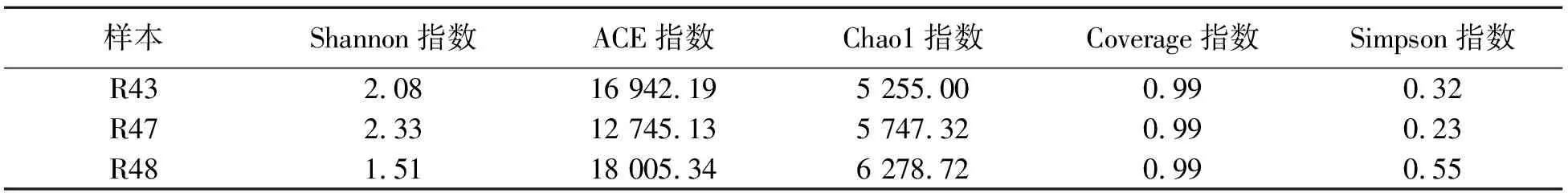
表1 3种土壤中微生物的α多样性Tab.1 Alpha diversity of microorganisms in three kinds of soil
3 结 论
目前,进行人参皂苷CK转化的微生物多采用单一菌株.但是,在自然界物质转化是多种微生物协同作用的结果,因此,利用多种微生物间的协同关系进行转化非常重要.本研究从人参种植地土壤中筛选出能将人参总皂苷转化成人参皂苷CK的复合菌群,获得了具有较强转化能力的菌群R43、R47和R48.3种能够高效转化人参皂苷CK的微生物群落主要包括子囊菌门(Ascomycota)、接合菌门(Zygomycota)和担子菌门(Basidiomycota),其中,子囊菌门在各样本中的含量最高.在属水平上,3个样本中的微生物主要分布在Penidiella、纤孔菌属(Inonotus)、赤霉菌属(Gibberella)、马拉色氏霉菌属(Malassezia)和Ophiosphaerella等菌属.多样性指数中Shannon指数在R47中最高,而在R48样本中含量最低.
