(C5H7N2O2)4(SiMo12O40)的合成、结构及催化氧化碘离子研究
2021-09-09冯潇,郭军,,张丹
冯 潇,郭 军,,张 丹
[1.贵州师范大学化学与材料科学学院,贵州 贵阳 550001;2.瓮福(集团)有限责任公司中低品位磷矿及其共伴生资源高效利用国家重点实验室·博士后工作站]
多金属氧酸盐(POMs)通常称为多酸,是由前过 渡金属离子通过氧链接而形成的金属-氧簇类化合物,由于其独特的结构和组成的多样性,在催化、磁性、医学、材料科学和纳米技术等领域具有很大的应用潜力[1-5]。近年来,发展有机-无机杂化POMs成为热点,有机和无机成分之间微妙的协同效应赋予该类化合物许多新的物理化学性能,为POMs更容易地集成到功能结构和设备中提供了各种选择[6-7]。
Keggin结构的多金属氧酸盐具有高对称性、合适的大小尺寸及结构稳定性,且可以提供大量的末端和桥联氧原子配位点,作为电子受体与很多有机组分结合,形成新型的有机-无机杂化材料[8-9]。而配体的性质如空间结构、配位点的分布等可以有效地调节化合物的拓扑结构,形成结构多样的化合物[10-12]。含N有机配体具有较强的结合能力和多功能的配位模式,可以通过多种连接方式对多金属氧酸盐进行修饰,从而构建基于多金属氧酸盐的新型有机-无机杂化材料[13]。深入拓展研究这一类化合物的合成,对丰富基于多金属氧酸盐化合物的种类以及进一步对其优异的性质展开应用,都具有重要意义。
碘是确保人体正常代谢、维持神经系统和智力发育的必需微量元素,作为基础工业原料和重要的战略物资,其化工产品广泛应用于电子、食品、医药、染料、冶金、合成橡胶、农业、国防尖端科技等诸多行业[14-15]。由于没有天然的碘矿资源,中国主要依靠从海洋藻类植物、磷矿石、地下卤水中提取碘,然而碘离子转化成碘单质的过程很慢,采用催化剂提高反应速率是解决该问题的有效途径[16]。近期研究表明,多钼氧酸盐作为催化剂可以克服RuCl3、K3Fe(CN)6、Mo2O4(H2O)62+、硫酸等存在的弊端,在催化过氧化氢氧化碘离子方面具有较好的效果[17]。笔者以Keggin型硅钼酸作为中心,向体系中引入含N有机配体1-咪唑乙酸,得到了一个新的化合物(C5H7N2O2)4(SiMo12O40),并以过氧化氢为氧化剂,探究了该化合物催化碘离子氧化反应的催化性能。
1 实验部分
1.1 试剂和仪器
试剂:碘化钾、硅酸钠、钼酸铵、1-咪唑乙酸、盐酸、氢氧化钠、30%(质量分数)过氧化氢、浓硫酸,均为分析纯。仪器:Bruker APEX-ⅡCCD型X射线单晶衍射仪;Vario EL Cube型元素分析仪;Nicolet iS5型傅里叶变换红外光谱仪;Smartlab9型X射线衍射仪;Netzsch STA 449 F3型热分析测试仪;PHS-3E pH计;PI-1-01型碘离子选择性电极;217-01型参比电极。
1.2 催化剂的制备
将Na2SiO3·9H2O(0.120 g,0.422 mmol)和(NH4)6Mo7O24·4H2O(1.000 g,0.809 mmol)溶解到15 mL蒸馏水中,搅拌15 min,用6 mol/L的HCl溶液调节pH至1.00,搅拌10 min后转移到60℃水浴中反应30 min。加入1-咪唑乙酸(0.076 g,0.602 mmol),并用1 mol/L的NaOH溶液将pH调回1.00,在60℃水浴继续反应2 h。趁热过滤,几天后得到黄色块状晶体。SiMo-12的傅里叶变换红外光谱(FT-IR)ν:1 083.96 cm-1(Si—Oa)、951.80 cm-1(Mo—Od)、900.77 cm-1(Mo—Ob—Mo)、790.03 cm-1(Mo—Oc—Mo)。SiMo-12的元素分析数据:理论值(质量分数,%)为C10.31、H1.21、N4.81;实验值(质量分数,%)为C10.73、H1.06、N4.82。
1.3 化合物晶体结构检测
选取合适的晶粒用于单晶结构测试。将晶粒置于Bruker APEX-II CCD型X射线单晶衍射仪中,在-123℃下收集衍射数据,射线源为λMo-Ka=0.071 073 nm,同时利用Olex2程序将晶体结构解出,并采用全矩阵最小二乘法进行精修。晶体学参数见表1(CCDC:2024795)。

表1 化合物的晶体学数据Table 1 Crystallographic data for compound
1.4 催化剂的催化性能评价
在c(I-)=2.5×10-3mol/L、c(H2O2)=1.25×10-3mol/L、c(H+)=2.5×10-3mol/L体 系 中 加 入5 mL浓 度 为1 mmol/L的SiMo-12,维持体系的体积为40 mL。运用离子选择电极法测定反应体系中碘离子的起始浓度c0、反应终点浓度ct、反应时间t。利用二者浓度差与时间的关系得到平均反应速率r,并作空白实验与之对照。平均反应速率计算公式:r=(c0-ct)/t。
2 结果与讨论
2.1 化合物的单晶结构解析
晶体结构表明,化合物属于三斜晶系,P-1空间群,详细晶体学数据见表1。标题化合物的分子结构见图1。晶体结构解析结果表明,该化合物由4个1-咪唑乙酸和1个经典的Keggin型[SiMo12O40]4-单元组成。多阴离子与配体的比值为1∶4,结构中的4个1-咪唑乙酸已被H4SiMo12O40酸性氢质子化,作为阳离子平衡电荷对称地分布在多酸笼结构两侧。由此可以确定化合物的结构式为(C5H7N2O2)4(SiMo12O40)。该化合物中多金属氧酸盐阴离子是一个独立的单元,和配体通过氢键以及静电相互作用连接,其本身依旧保持Keggin结构的框架。

图1 化合物沿c轴观察的分子结构图Fig.1 Molecular structure of a compound viewed along c axis
在多金属氧酸阴离子中硅原子位于对称中心,和8个氧原子相邻。Si—O键长为0.158 3~0.165 0 nm,O—Si—O键角为76.7~180.0°;Mo—O键长为0.164 8~0.244 4 nm,O—Mo—O键角为17.6~171.9°。价键计算得出,[SiMo12O40]4-中Mo原子氧化态都是+6价。
相邻的两个结构单元中的1-咪唑乙酸分子以静电引力和氢键N—H…O、C—H…O连接。此外,配体填充在多酸之间除了平衡多阴离子的负电荷外,还能作为连接体与相邻多酸上的端氧和桥氧通过氢键作用,结构单元通过这样的方式沿x轴形成一维链状结构。链与链之间相互平行,形成平行于xy面的二维层状结构,进而构成三维网状结构(见图2)。具体氢键数据见表2。

图2 化合物的一维链状(a)、二维层状(b)、三维网状(c)结构图Fig.2 1D chain(a),2D layer(b),3D network(c)structure diagram of the compound
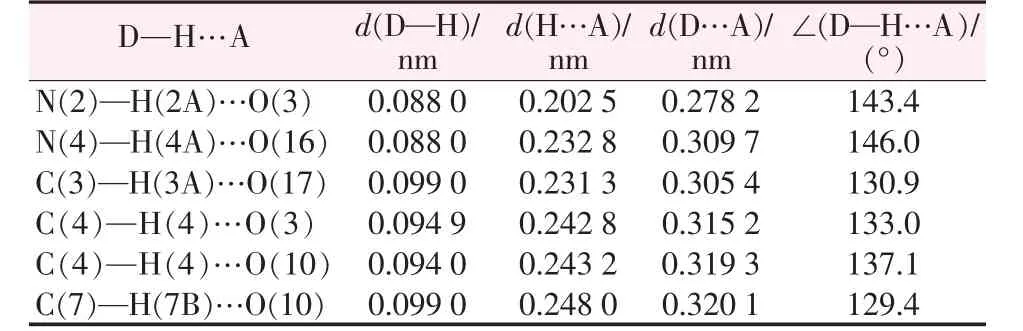
表2 化合物的部分氢键数据Table 2 Partial hydrogen bond parameters of the compound
2.2 化合物的红外光谱分析
化合物的傅里叶红外光谱图(IR)见图3。从图3看 出,在700~1 100 cm-1有4个 吸 收 峰,790.03、900.77、951.80、1 083.96 cm-1处的吸收峰分别归属为{SiMo12O40}4-簇阴离子中νas(Mo-Oc-Mo)、νas(Mo-Ob-Mo)、νas(Mo-Od)、νas(Si-Oa)伸缩振动峰,而1 393.31、1 616.98 cm-1处的吸收峰则归属于1-咪唑乙酸配体中羧基的非对称伸缩振动和对称伸缩振动[18]。

图3 SiMo-12的红外光谱图Fig.3 IR spectrum of SiMo-12
2.3 化合物的X射线粉末衍射分析
化合物的X射线粉末衍射(XRD)分析结果见图4。由图4可知,化合物的粉末X射线衍射数据与单晶X射线衍射的拟合数据相一致,证明化合物为纯相,在实验和拟合数据中峰强度不同是由于实验采集粉末样品数据过程中晶体取向不同引起的。
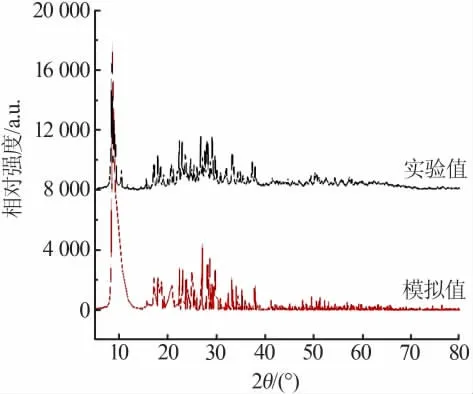
图4 实验和模拟XRD谱图比较Fig.4 Comparison of experimental and simulated XRD patterns
2.4 化合物的热重分析
对化合物进行了热重(TG)测试,结果见图5。氩气气氛,升温速率为10℃/min。由图5看出,化合物在室温~800℃经历了3次质量损失,总质量损失率为41.07%。第一次质量损失在286.0~298.1℃,质量损失率为5.21%,归属于1-咪唑乙酸有机配体的分解;第二次质量损失在298.1~517.2℃,质量损失率为13.87%,为熔融状态下的有机配体以及多酸骨架逐渐分解;第三次质量损失在517.2~800.0℃,质量损失率为21.99%,标志着化合物阴离子骨架的坍塌。
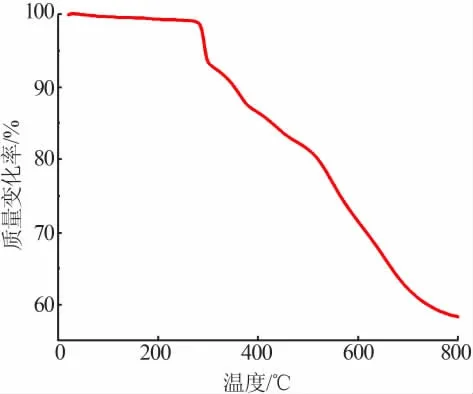
图5 化合物的热重曲线Fig.5 TG curve of the compound
2.5 化合物的催化性能研究
2.5.1 催化反应动力学分析
为探究催化剂本身是否会氧化碘离子,在实验前先将SiMo-12置于待反应的碘离子溶液中静置30 min,观察到电位均未发生任何变化,说明SiMo-12不能与碘离子反应,亦不会氧化碘离子。
在25℃条件下保持体系中c(I-)=2.5×10-3mol/L、c(H2O2)=1.25×10-3mol/L、c(H+)=2.5×10-3mol/L进行空白实验,发现未加催化剂时反应要经历41 h才能达到终点,反应速率为1.687 0×10-8mol/(L·s)。图6a为将5 mL浓度为1 mmol/L的SiMo-12加入该体系的实验结果。反应经过20 min到达终点,此时反应速率达到2.075 0×10-6mol/(L·s),相对于未添加催化剂的反应体系提高了122倍,表明SiMo-12有较好的催化效果。通过测量碘离子的浓度随时间的变化,分别以ln(ct/c0)、1/c对t作图,并利用作图法求解反应级数,结果见图6b。由图6b可知,以1/c对时间t作图得到一条曲线,ln(ct/c0)对t作图趋近于一条直线,拟合图表明碘离子催化反应符合准一级反应动力学,动力学方程式表示为ln(ct/c0)=kt(其中k为反应速率常数,c0为反应起始时刻碘离子浓度,ct为t时刻碘离子浓度),SiMo-12催化过氧化氢氧化碘离子反应动力学的线性相关系数为0.999 4,该条件下动力学常数为0.619 2 min-1。
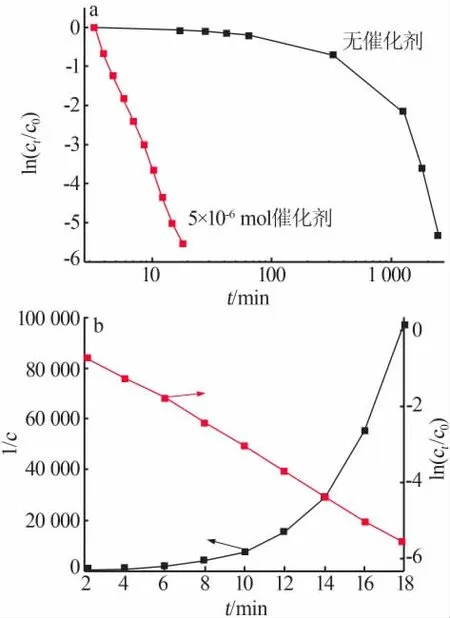
图6 未加催化剂及加入5×10-6 mol SiMo-12的催化动力学图(a);作图法求解催化反应动力学级数(b)Fig.6 Kinetic diagram of catalysis without catalyst and with 5×10-6 mol SiMo-12(a);Plotting method to solve kinetic progression of catalytic reaction(b)
2.5.2 催化条件对催化反应活性的影响
1)在c(I-)=2.5×10-3mol/L、c(H2O2)=1.25×10-3mol/L、c(H+)=2.5×10-3mol/L、25℃、总 体积 为40 mL条件下,考察了催化剂用量对催化反应活性的影响,结果见图7a。从图7a看出,随着SiMo-12用量增加碘离子的反应速率逐渐加快,说明催化剂用量的增加提供了更多的活性中心,活化分子的增加使反应进行得更快。当SiMo-12浓度为2×10-4mol/L时反应速率达到2.314 4×10-6mol/(L·s),随后反应速率继续增大但增速放缓。考虑到经济效益等诸多因素,选择SiMo-12用量为2×10-4mol/L。
2)在c(I-)=2.5×10-3mol/L、c(H+)=2.5×10-3mol/L、c(SiMo-12)=2×10-4mol/L、25℃、总体积为40 mL条件下,考察了过氧化氢用量对催化反应活性的影响,结果见图7b。按照酸性条件下氧化回收碘的化学计量比,将1 mol的I-氧化生成I2需要消耗0.5 mol的H2O2。从图7b看出,随着H2O2用量增加反应速率明显提高,当H2O2浓度为2×10-3mol/L时反应速率达到2.960 7×10-6mol/(L·s),随后继续增加过氧化氢用量反应速率继续增加但增速变缓。这可能是由于H2O2浓度过高时容易分解,部分H2O2不能充分与催化剂反应[19]。因此,选择H2O2浓度为2×10-3mol/L。
3)催化活性受pH的影响极为显著,而POMs的酸催化机理符合传统的Brфnsted酸机理,底物的质子化过程引入H+可改变反应进程。改变溶液中H+浓度,考察了pH对碘离子反应速率的影响,结果见图7c。其他条件:c(I-)=2.5×10-3mol/L,c(SiMo-12)=2×10-4mol/L,c(H2O2)=2×10-3mol/L,25℃,总体积为40 mL。从图7c可知,催化反应速率随着pH增加呈先增大后下降的趋势,当pH为1.4时达到最大反应速率1.121 0×10-5mol/(L·s)。因此,选择pH=1.4。
4)提高反应温度有助于分子、离子的扩散速率加快,致使催化剂、氧化剂、反应底物之间充分接触进而使催化反应速率大大提高。在c(I-)=2.5×10-3mol/L、c(SiMo-12)=2×10-4mol/L、c(H2O2)=2×10-3mol/L、pH=1.4、总体积为40 mL条件下,考察了反应温度对催化反应活性的影响,结果见图7d。从图7d看出,当反应温度从30℃增加到50℃时反应速率急剧上升,随着反应温度的增加催化碘离子氧化的反应速率与温度呈线性关系,温度每升高5℃催化反应速率在原来的基础上提高10%左右。但是,考虑到温度过高可能会使碘单质升华以及过氧化氢分解等,因此选择反应温度为50℃,此时碘离子的反应速率为2.641 6×10-5mol/(L·s)。
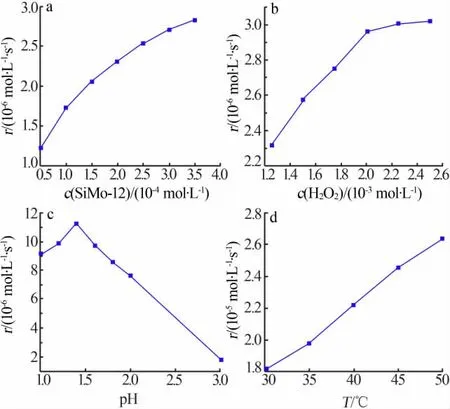
图7 催化剂用量(a)、过氧化氢用量(b)、pH(c)、温度(d)对催化反应活性的影响Fig.7 Effect of the amount of catalyst(a),the amount ofhydrogen peroxide(b),pH(c) and temperature(d)on the activity of the catalytic reaction
3 结论
利用常规水溶液法合成了一种新型有机-无机杂化多金属氧酸盐化合物SiMo-12。晶体结构测试表明,有机配体1-咪唑乙酸和多金属氧酸阴离子之间通过静电作用、质子转移以及氢键作用相互连接。性质研究表明,SiMo-12在催化碘离子氧化中表现出较为优异的催化活性,在c(SiMo-12)=2×10-4mol/L、c(H2O2)=2×10-3mol/L、pH=1.4、T=50℃条件下反应速率达到2.641 6×10-5mol/(L·s),比未加催化剂时的反应速率提高了1 565倍。
