磁性金属有机框架材料制备及吸附性能研究
2021-09-09王力霞任冬梅
王力霞,任冬梅,王 琼,常 春
(渤海大学化学与材料工程学院,渤海大学海洋研究院,辽宁 锦州 121013)
金属-有机框架(MOFs)材料是一种易实现可控合成和功能化修饰的、具有高表面积和结构与形貌可调的结晶多孔材料。由于MOFs材料具有优异的光学性能,在催化、电子器件和气体储存等方面有广泛的应用[1-3]。MIL-101系列MOFs材料的Langmuir比表面积可达5 900 m2/g。目前MIL系列材料越来越受到科研人员的关注[4-7],其中铁氧体磁性纳米材料(CoFe2O4和NiFe2O4)以其优异的磁性能也引起各领域研究人员的极大兴趣,主要应用于磁流体、催化、生物技术/生物医学、磁共振成像、数据存储和环境治理等广泛的领域[8-10]。
随着科技的进步,新材料的合成和设计也在日益加速发展。显然性能单一的材料很难满足材料设计应用的需求,多功能化和微结构化的新型纳米复合材料的研发成为当前科学研究的热点[11-12]。
笔者将具有铁磁性的CoFe2O4和NiFe2O4作为功能内核,通过进一步的溶剂热反应在其表面负载MIL-101(Fe)型金属有机骨架材料,设计与构筑具有超顺磁性、优异光学性能和高比表面积的MIL-101(Fe)/Co(Ni)Fe2O4纳米复合材料。并将MIL-101(Fe)/Co(Ni)Fe2O4纳米复合材料用于吸附污水中的污染物RhB,研究其吸附性能。磁性纳米复合材料由于具有优越的磁性能,可以在合成和应用过程中简化处理过程,大大降低了生产成本。磁性金属有机框架纳米复合材料作为污水处理剂将具有广阔的应用前景。
1 实验部分
1.1 MIL-101(Fe)/Co(Ni)Fe2O4纳米复合材料的制备
1)磁性材料CoFe2O4和NiFe2O4的制备。利用水热法制备纳米CoFe2O4或NiFe2O4。取0.238 g CoCl2·6H2O(或0.237 7 g NiCl2·6H2O)加入到25 mL去离子水中,机械搅拌10 min,加入0.556 g FeSO4·7H2O,搅拌直到完全溶解,再加入1.5 g NaOH,搅拌均匀,得到透明溶液。将透明溶液放入高压反应釜中,密闭加热至200℃并保持5 h。反应结束后取出样品,通过磁铁分离,分别利用蒸馏水和酒精多次洗涤,烘干后得到黑色粉末,分别为CoFe2O4或NiFe2O4。
2)MIL-101(Fe)/Co(Ni)Fe2O4纳米复合材料的制备。称取0.675 g FeCl3·6H2O溶解于30 mL DMF(N,N-二甲基甲酰胺)中,机械搅拌10 min,加入0.206 1 g对苯二甲酸,机械搅拌20 min,获得均匀溶液(溶液1)。称取0.10 g CoFe2O4(或NiFe2O4)溶解于30 mL DMF中,搅拌直到完全溶解,加入0.1 g PVP(聚乙烯吡咯烷酮),继续搅拌20 min,得到溶液(溶液2)。将溶液2加入溶液1中,加入2 mL无水乙醇,机械搅拌。搅拌均匀后置于100 mL反应釜中,进行溶剂热反应。反应温度为110℃,反应时间为24 h。反应结束后,借助磁铁将样品用DMF和无水甲醇各清洗2次,在60℃抽真空干燥12 h,得到棕色粉末,分别为MIL-101(Fe)/CoFe2O4或MIL-101(Fe)/NiFe2O4。
1.2 表征方法
采用D/max-2500PC X射线衍射仪对样品进行物相分析;采用STA 449C Jupiter热重分析仪对样品进行热重分析;采用JSM-6700F冷场发射扫描电镜观察样品的形貌;采用VSM-7300振动磁强计在室温条件下测试样品的磁性能;采用UV-1801紫外可见分光光度计测定RhB溶液的质量浓度。
1.3 吸附性能测试
考 察MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4吸附RhB的性能。准确称量一定质量的RhB溶于蒸馏水中,配制成质量浓度为1 g/L的溶液作为储备液。取出一定量储备液,用蒸馏水稀释,配制成标准液。用紫外可见分光光度计在λmax=554 nm处(RhB的最大吸光度处)测试已知不同质量浓度RhB的吸光度,确定标准曲线。称取一定质量的磁性粉末,加到已知浓度的一定体积的RhB溶液中,机械搅拌,每隔一定时间利用磁铁吸住磁性粉末,将上层RhB溶液倒入比色皿中,利用紫外可见分光光度计测量RhB溶液的质量浓度。测量、记录后,将比色皿中的溶液倒回原烧杯,继续搅拌、测量,直至吸附达到平衡。根据标准曲线确定不同吸附时间RhB溶液的质量浓度。磁性粉末对RhB的吸附量用式(1)计算。

式中:q为磁性粉末对RhB的吸附量,mg/g;ρ0为RhB溶液的初始质量浓度,mg/L;ρt为t时刻RhB溶液的质量浓度,mg/L;V为RhB溶液的体积,L;m为磁性粉末的质量,g。
2 结果与讨论
2.1 MIL-101(Fe)/Co(Ni)Fe2O4纳米复合材料表征
图1a为MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的XRD谱图。由图1a看出,所有标记“*”的衍射峰位置和JCPDS卡片22-1086相符,是面心立方的钴铁氧体结构;所有标记“●”的衍射峰位置对照JCPDS卡片10-0325为面心立方结构的镍尖晶石铁氧体;在10°左右有弱的衍射峰(标记为“◆”),这是MIL-101(Fe)产生的。清晰的XRD峰证实这些复合物的结晶度高,没有其他杂质存在。
图1b为MIL-101(Fe)和MIL-101(Fe)/CoFe2O4的TGA曲线;样品在不同温度的质量损失率见表1。可以把整个曲线分成4个质量损失区域:区域Ⅰ(室温~90℃)的质量损失是材料吸附的游离水蒸发所致;区域Ⅱ(90~310℃)的质量损失主要是材料中的DMF缓慢去除所致,MIL-101(Fe)的质量损失率约为25.2%,MIL-101(Fe)/CoFe2O4的质量损失率约为7.3%;区域Ⅲ(310~520℃)的质量损失很明显,MIL-101(Fe)的质量损失率约为63.1%,MIL-101(Fe)/CoFe2O4的质量损失率约为20.8%,这是由于结合的配体(对苯二甲酸)离去造成的,最终导致材料有机骨架的坍塌;区域Ⅳ(520~990℃)的质量损失是剩余对苯二甲酸的继续质量损失和MIL-101(Fe)转换成Fe2O3的结果。

表1 MIL-101(Fe)和MIL-101(Fe)/CoFe2O4在不同温度的质量损失率Table 1 The mass loss rates of MIL-101(Fe)and MIL-101(Fe)/CoFe2O4 at different temperature
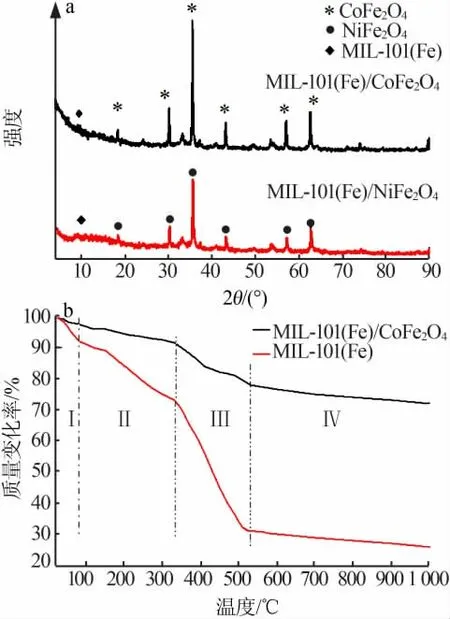
图1 MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的XRD谱图(a);MIL-101(Fe)和MIL-101(Fe)/CoFe2O4的TGA曲线(b)Fig.1 XRD patterns of MIL-101(Fe)/CoFe2O4 and MIL-101(Fe)/NiFe2O4(a);TGA of MIL-101(Fe)and MIL-101(Fe)/CoFe2O4(b)
热重分析表明,复合材料MIL-101(Fe)/CoFe2O4的热稳定性明显高于MIL-101(Fe)。MIL-101(Fe)在各个阶段的的质量损失率约是MIL-101(Fe)/CoFe2O4的3倍,可以推测MIL-101(Fe)与磁性金属有机框架复合材料颗粒之间的质量比约为1∶3,后者具有更高的热稳定性。
图2为MIL-101(Fe)/CoFe2O4(a)和MIL-101(Fe)/NiFe2O4(b)的SEM照片。由图2可见,MIL-101(Fe)/CoFe2O4由粒径为50~110 nm的球状纳米粒子构成,MIL-101(Fe)/NiFe2O4由粒径为50~100 nm的多面体纳米粒子构成;MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4复合物形貌均匀,均为纳米粒子,且结晶度高。

图2 MIL-101(Fe)/CoFe2O4(a)和MIL-101(Fe)/NiFe2O4(b)的SEM照片Fig.2 SEM images of MIL-101(Fe)/CoFe2O4(a)and MIL-101(Fe)/NiFe2O4(b)
磁性能是决定纳米复合物应用的关键因素。在室温下测量CoFe2O4、NiFe2O4、MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的磁化曲线,见图3a。磁化曲线显示出典型的铁磁行为,具体数据见表2。CoFe2O4和NiFe2O4的饱和磁化强度(Ms)分别为172.1、116.0 A·m2/kg,负载MIL-101(Fe)后MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的Ms分别为132.4、87.0A·m2/kg,负载后复合物的Ms下降。CoFe2O4、NiFe2O4、MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的剩余磁化强度(Mr)分别为20.8、26.2、17.6、23.6 A·m2/kg,负载后复合物的Mr略有下降。样品的矫顽力(Hc)相差不大。表明MIL-101(Fe)/CoFe2O4具有高的饱和磁化强度,在外磁场作用下能快速响应(图3b),可以大大降低制备和应用过程中的成本,缩短分离时间,更好地发挥其在高效吸附场合的优势。

图3 CoFe2O4、NiFe2O4、MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4磁化曲线(a);MIL-101(Fe)/CoFe2O4复合物被磁铁吸引的照片(b)Fig.3 Magnetization curve measured of CoFe2O4,NiFe2O4,MIL-101(Fe)/CoFe2O4 and MIL-101(Fe)/NiFe2O4(a);photo of MIL-101(Fe)/CoFe2O4 composite attracted by magnet(b)

表2 CoFe2O4、NiFe2O4、MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的磁性参数Table 2 The magnetic parameters of CoFe2O4,NiFe2O4,MIL-101(Fe)/CoFe2O4 and MIL-101(Fe)/NiFe2O4
2.2 复合物对RhB的吸附性能研究
将磁性金属有机框架材料作为RhB吸附剂,进行了一系列吸附实验。在RhB初始质量浓度为20 mg/L、溶液体积为40 mL、吸附剂用量为0.010 g、25℃、pH=7条件下进行吸附实验,得到CoFe2O4、NiFe2O4、MIL-101(Fe)、MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4对RhB的吸附性能曲线(见图4)。从图4看出,在相同吸附条件下MIL-101(Fe)的最大吸附量最高(111.7 mg/g),这说明大比表面积的金属有机框架材料对吸附起主要作用。CoFe2O4和NiFe2O4的最大吸附量分别为93.8、89.7 mg/g,磁性复合物MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4的最大吸附量分别为97.3、89.9 mg/g。磁性复合物的吸附量要高于CoFe2O4和NiFe2O4。

图4 不同吸附剂样品对RhB的吸附能力曲线Fig.4 Adsorption capacity curves of different adsorbents for RhB
固定条件:RhB溶液体积为40 mL,吸附剂用量为0.010 g,25℃,pH=7。改变RhB初始质量浓度,考察RhB溶液初始质量浓度对MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4吸附能力的影响,结果见图5。由图5看出,加入磁性粉末10 min左右,随着时间的增加吸附量迅速增加,吸附能力增强;之后的20~90 min,随着时间的增加吸附能力减弱;当吸附时间达到100 min后,吸附达到平衡,吸附量趋于不变。另外,随着RhB初始质量浓度的增加,磁性粉末的最大吸附量增加。当RhB初始质量浓度从5 mg/L增加到20 mg/L时,MIL-101(Fe)/CoFe2O4的吸附能力从80.5 mg/g增加到97.3 mg/g,MIL-101(Fe)/NiFe2O4的吸附能力从67.1 mg/g增加到89.9 mg/g,这说明溶液的初始质量浓度越高吸附剂的吸附能力越强。

图5 RhB初始质量浓度对MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4吸附能力的影响Fig.5 Effect of RhB initial mass concentration on adsorption capacity of MIL-101(Fe)/CoFe2O4 and MIL-101(Fe)/NiFe2O4
由图4和图5发现,MIL-101(Fe)/CoFe2O4的吸附能力高于MIL-101(Fe)/NiFe2O4,而且MIL-101(Fe)/CoFe2O4的饱和磁化强度也优于MIL-101(Fe)/NiFe2O4,因此磁性MIL-101(Fe)/CoFe2O4纳米复合材料作为污水处理剂具有良好的应用前景。
2.3 吸附等温线研究
采用Langmuir和Freundlich两个模型研究磁性复合材料MIL-101(Fe)/CoFe2O4的吸附等温线。Langmuir和Freundlich吸附等温方程的形式见式(2)和式(3)。

式中:qe和qmax分别为平衡吸附量和最大吸附量,mg/g;KL为Langmuir吸附常数,L/mg;ρe为RhB的平衡质量浓度,mg/L;KF和n为Freundlich模型的常数,较大的KF和n是吸附剂具有较好吸附性能的表征。
图6为MIL-101(Fe)/CoFe2O4基于Langmuir和Freundlich模型绘制的吸附等温线。通过实验数据线性拟合发现Langmuir模型的R2高于Freundlich模型,说明MIL-101(Fe)/CoFe2O4吸附RhB符合Langmuir模型。从Langmuir模型中计算的MIL-101(Fe)/CoFe2O4吸附RhB的最大吸附量为106.8 mg/g。
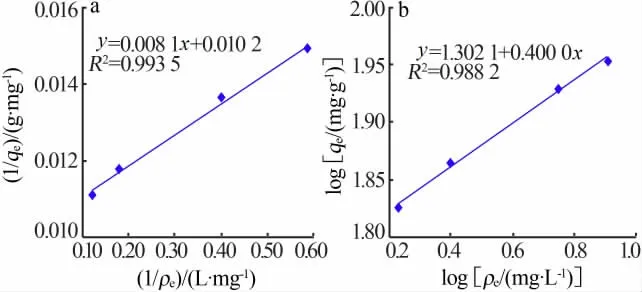
图6 MIL-101(Fe)/CoFe2O4吸附等温线Fig.6 Sorption isotherm of MIL-101(Fe)/CoFe2O4
2.4 吸附动力学研究
采用动力学准一级和准二级模型进行分析,对应的动力学模型见式(4)和式(5)。

式中:qt为t时刻RhB的吸附量,mg/g;q1e和q2e为吸附平衡时RhB的吸附量,mg/g;k1为准一级方程速率常数(min-1),作log(q1e-qt)对t的直线图,通过直线的斜率可以确定k1;k2为准二级方程速率常数[g/(mg·min)],以t/qt对t作图,可以通过截距和斜率得到k2。
图7为MIL-101(Fe)/CoFe2O4吸附RhB的准一级和准二级动力学方程图。通过两个模型的相关系数(R2)对比发现,这个吸附过程服从准二级动力学方程,说明吸附机制取决于吸附质和吸附剂。并且从准二级模型计算的q2e(101.3 mg/g)和吸附实验数据(97.3 mg/g)吻合得比较好。

图7 MIL-101(Fe)/CoFe2O4对RhB的吸附动力学模型(RhB初始质量浓度为15 mg/L,pH=7,温度为18℃)Fig.7 Adsorption kinetics model of RhB by MIL-101(Fe)/CoFe2O4(initial concentration of RhB of 15 mg/L,pH=7,T=18℃)
2.5 吸附热力学
吸附热力学涉及到自由能变化(ΔG,kJ/mol),可以使用式(6)计算。

式中:R为通用气体常数,8.314 J/(mol·K);T为温度,K;ρae为平衡时每升吸附剂吸附吸附质的质量,mg/L;ρse为RhB在溶液中的平衡质量浓度,mg/L。
当 温 度 为20℃时,ΔG由 式(6)计 算 为-10.18 kJ/mol,吸附平衡常数为65.23。自由能是负值表示MIL-101(Fe)/CoFe2O4对RhB的吸附过程是自发过程。
3 结论
1)通过一步水热法合成了磁性CoFe2O4和NiFe2O4纳米粒子,并进一步以溶剂热反应在磁性纳米粒子表面负载MIL-101(Fe)型金属有机框架材料,制备出MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4磁性金属有机框架纳米复合材料。磁性纳米复合物结晶度高,无其他杂质,且形貌均匀,粒径为50~110 nm。
2)MIL-101(Fe)/CoFe2O4和MIL-101(Fe)/NiFe2O4与单一Co/NiFe2O4相比,具有较高的饱和磁化强度(分别为132.4、87.0 A·m2/kg),在外磁场作用下能快速响应,有利于在高效吸附场合应用。
3)对于初始质量浓度相同的RhB溶液,MIL-101(Fe)/CoFe2O4与MIL-101(Fe)/NiFe2O4相比,前者对RhB具有更强的吸附能力。RhB的初始质量浓度为20 mg/L时,MIL-101(Fe)/CoFe2O4的吸附能力为97.3 mg/g。磁性MIL-101(Fe)/CoFe2O4纳米材料作为污水处理剂具有很好的应用前景。
