亚油酸通过调节TLR4/NF-κB信号通路减轻大鼠类风湿关节炎
2021-09-08胡丹东崔玉娟
胡丹东, 崔玉娟, 张 继
(1.北京市延庆区食品药品安全监控中心,北京 102100;2.西北师范大学生命科学学院,甘肃 兰州 730070; 3. 北京市延庆区疾病预防控制中心,北京 102100)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性、炎症性和进行性自身免疫性疾病。RA患者的早期病理特征主要是滑膜炎和关节腔内血管翳的形成[1]。慢性炎症促进RA的发展,在发展过程中巨噬细胞的极化、成纤维样滑膜细胞的异常增殖、炎性因子等原因导致关节软骨的破坏和周围组织的损伤[2]。如果患者得不到及时、正规的治疗,就会造成关节畸形,甚至最终发展为肢体残疾。此外,RA患者易合并脑卒中、心肌梗死等疾病,是致残的主要原因,在一定程度上导致社会劳动的丧失[3]。 根据流行病学资料,全世界RA发病率约为1%[4],因此,RA已成为严重的公共卫生问题。
在现代治疗的帮助下,大多数RA患者可以有效地控制病情,改善症状,减轻疼痛,保护关节功能[5]。 但到目前为止,还没有治疗RA的特效药,治疗方法主要包括药物治疗、物理治疗、手术治疗和免疫吸附治疗,其中,药物治疗作为应用最广泛和最有效的方法,在RA的治疗中起着关键作用[6]。亚油酸是一种功能性的多不饱和脂肪酸,据报道其具有降低血清胆固醇水平、抑制动脉血栓形成、预防癌症、参与人类心血管疾病的控制、免疫调节、细胞生长和细胞凋亡等作用。此外,亚油酸用于治疗关节和肌肉的炎症和疼痛[7]。还有文献报道,亚油酸可促进伤口愈合,减少伤口愈合过程中的炎症细胞数量,并显著抑制炎症因子水平[8]。然而,亚油酸在RA治疗中的潜在作用和可能机制尚未阐明。
RA的病因尚不清楚,但已发现NF-κB信号通路在RA的发展中具有重要作用,相关研究表明可以通过抑制NF-κB信号通路发挥抗RA作用[9]。此外,近年来TLR4已被发现对RA的病理反应有重要影响,其作用机制与RA患者滑膜中TLR4的表达水平高于健康人有关[10];随着研究的不断深入,姜黄素、青藤碱等植物提取物均可通过阻断或抑制TLR4/NF-κB信号通路减轻和预防炎症反应,改善RA,成为治疗RA的潜在药物。因此,TLR4/NF-κB信号通路在RA的发病机制中起着重要作用。
因此,本研究旨在探讨亚油酸在治疗RA中的作用及其可能的机制。研究发现亚油酸通过抑制TLR4/NF-κB信号通路减轻炎症反应,改善胶原诱导的RA,研究结果为亚油酸在RA中的生物学功能提供了新的认识,并为RA的治疗提供了一种新的药物。
1 材料与方法
1.1 实验动物从上海实验动物研究中心(中国)购买的36只体质量为(250-300)g的雄性SD大鼠。所有动物都被安置在控制温度(22 ℃)、湿度(50%)和光照(12 h光照/黑暗)下,自由获得标准饮食和水。
1.2 大鼠RA模型的建立及实验分组RA大鼠模型的建立,将Ⅱ型胶原溶解于0.05 mol·L-1醋酸溶液中,配成浓度为2 g·L-1的溶液,等体积加入胶原溶液与完全弗氏佐剂乳化,采用免疫注射法在尾根部皮内注射100 μg胶原乳剂,在d 7加强免疫。将SD大鼠分为6组,每组6只,包括:对照组、RA模型组、RA+亚油酸(0.1 mL)组、RA+亚油酸(0.2 mL)组、RA+亚油酸(0.4 mL)组和RA+甲氨蝶呤(methotrexate,MTX)(20 mg·kg-1)组。对照组和模型组只给予0.9%生理盐水,其他组给予各体积亚油酸及10 mL·kg-1MTX处理,连续灌胃7 d。然后处死大鼠,分别在不同时间测定各组大鼠的关节肿胀、足体积、足厚、关节周长。亚油酸(中国食品药品检定研究院,批号:111622-201704、含量:99.8%、规格:0.2 mL/支)、MTX(中国食品药品检定研究院,批号:100138-201606、含量:99.8%、规格:400 mg/支)。
1.3 HE染色关节软骨组织固定于4%多聚甲醛,石蜡包埋,切片厚4 μm,用苏木精染色10 min,室温用伊红处理5 min,组织学图像在光学显微镜下放大200倍获得。CX43光学显微镜(奥林巴斯株式会社,日本)。
1.4 ELISA检测采集血清样本,分析细胞因子释放情况。300 g血清在4 ℃下离心(2 000-3 000 r·min-1)15 min,收集上清液。用ELISA法检测血清样本中的IL-1、IL-6、TNF-α和IL-10蛋白水平。ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,中国),MK3酶标仪(美国热电公司,美国)。
1.5 qRT-PCR用TRIzol(碧云天生物技术研究所,中国)法从关节软骨组织中提取总RNA,用TaqMan一步法将RNA反转录成cDNA。通过ABI 7500实时荧光定量PCR仪(美国应用生物系统公司,美国)进行qRT-PCR实验。用2-ΔΔCt法计算IL-1β、IL-6、TNF-α和IL-10的相对mRNA表达水平。以GAPDH为内标,特异性引物如Tab 1所示:
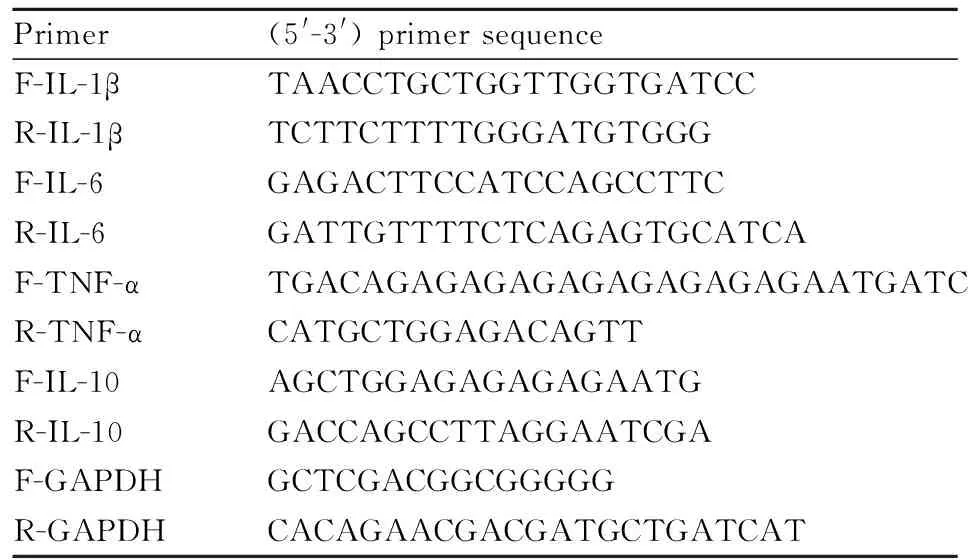
Tab 1 Specific primer sequence, forward and reverse primer sequences of IL-1β, IL-6, TNF-α, IL-10, GAPDH
反应体系为:2×SYBR®Green Realtime PCR预混液12.5 μL、正向引物1 μL、反向引物1 μL、cDNA模版2 μL,加ddH2O至25 μL。循环为:95 ℃变性5 min;95 ℃持续15 s、55 ℃持续15 s、72 ℃持续10 s,进行40个循环;72 ℃延伸5 min。
1.6 Western blot检测用RIPA裂解缓冲液分离关节软骨组织中的蛋白质,BCA试剂盒(碧云天生物技术研究所,中国)定量。再用12%SDS-PAGE电泳分离蛋白质,并转移到PVDF膜上(Millipore,MA,美国)。然后,用5%脱脂乳封闭膜,并在4 ℃下过夜,用抗TLR4(1 ∶1 000,ab22048)、抗p-NF-κB p65(1 ∶1 000,ab86299)、抗NF-κB p65(1 ∶1 000,ab16502)和抗GAPDH(1 ∶2 000,ab181602)等一抗处理。用HRP结合二次抗体(1 ∶2 000,ab6728)在室温下冲洗1 h。最后,用增强化学发光试剂盒(ECL,Millipore,Bedford,MA,美国)观察蛋白质印迹。所有抗体均来自Abcam(MA,美国)。
1.7 免疫组织化学法用4%多聚甲醛固定,石蜡包埋,切片5 μm。用TLR4(1 ∶100,ab22048)、p-NF-κB p65(1 ∶100,ab86299)抗体对组织进行免疫染色。然后用生物素标记的羊抗兔免疫球蛋白G二次抗体孵育,在37 ℃下1 ∶500稀释,再次孵育30 min,用DAB作显色剂。图像在光学显微镜下获取,CX43光学显微镜(奥林巴斯,日本);所有抗体均来自Abcam (MA,美国)。
2 结果
2.1 亚油酸对RA大鼠关节肿胀的影响构建Ⅱ型胶原诱导的RA大鼠模型,通过不同剂量亚油酸和MTX的处理,探讨亚油酸对RA大鼠关节肿胀的影响。如Fig 1A所示,Ⅱ型胶原诱导的RA大鼠关节与对照组相比肿胀明显,而亚油酸显著改善了RA大鼠的关节肿胀。此外,还测量了不同组在相应天数下的足部体积、足部厚度和关节周长,如Fig 1B-D所示,RA大鼠足部体积、足部厚度和关节周长数据明显大于对照组,而经过亚油酸处理后都得到了显著改善(P<0.01)。实验结果表明,亚油酸有效改善了Ⅱ型胶原诱导的大鼠RA导致的关节肿胀。
2.2 亚油酸对RA大鼠关节病理损伤的影响对不同分组的RA大鼠关节软骨组织进行了HE检测。如Fig 2A所示,对照组大鼠关节软骨表面光滑,层次完整,滑膜下层细胞分散且少,无炎症或骨质破坏。而RA大鼠关节部位表现出典型的病理特征,如滑膜细胞显著增加、滑膜增生、伴有炎性细胞浸润和血管翳形成,关节软骨和骨严重破坏,经亚油酸处理后明显减轻了RA大鼠的上述现象。 结果表明亚油酸可改善RA大鼠关节病理损伤。

Fig 1 Effects of linoleic acid on joint swelling in RA rats n=6)

Fig 2 Effects of linoleic acid on joint pathological injury in RA rats n=6)
2.3 亚油酸对RA大鼠炎症反应的影响采用ELISA法检测TNF-α、IL-1β、IL-6和IL-10等炎性因子的表达水平。如Fig 3A所示,与对照组相比,Ⅱ型胶原诱导的RA大鼠TNF-α等炎性因子表达量明显增加,而与模型组相比,亚油酸处理后抑制RA大鼠炎性因子表达(P<0.05)。同时,qRT-PCR对炎性因子的mRNA测定也得到了相同的结果,如Fig 3B所示,与模型组相比,随着亚油酸的增加明显降低了Ⅱ型胶原诱导的TNF-α、IL-1β、IL-6和IL-10的mRNA表达水平。这些数据表明亚油酸能改善RA大鼠的炎症反应。
2.4 亚油酸对RA大鼠TLR4/NF-κB信号通路表达的影响采用免疫组化和Western blot方法检测亚油酸对TLR4/NF-κB信号通路表达的影响。如Fig 4A所示,亚油酸剂量的增加抑制了TLR4/NF-κB信号通路蛋白TLR4和p-p65在组织中的阳性产物表达;Fig 4B所示亚油酸抑制了TLR4/NF-κB信号通路TLR4的表达以及p65蛋白的磷酸化,通过免疫组织化学法和Western blot的检测结果可以明显看到抑制趋势(P<0.05)。结果显示亚油酸抑制RA大鼠TLR4/NF-κB信号通路的表达,通过调节TLR4/NF-κB信号通路改善Ⅱ型胶原诱导的大鼠RA。

Fig 3 Effects of linoleic acid on inflammatory response in RA rats n=6)

Fig 4 Effects of linoleic acid on expression levels of TLR4/NF-κB signaling pathway in articular cartilage tissues of RA rats n=6)
3 讨论
近年来,RA的临床治疗取得了很大进展,主要体现在生物改良抗风湿药物和小分子靶向抑制剂,包括TNF抑制剂、IL-6抑制剂、抗T细胞共刺激药物、抗B细胞药物等,尽管这些生物制剂的作用靶点不同,但研究人员发现这些药物最终都是通过干扰RA的炎症进程发挥作用[11]。虽然近年来RA的治疗取得了很大的进展,但目前这些治疗药物只能部分缓解病情的进展,在RA的治疗方面仍然存在巨大的挑战,这说明开发和筛选新的治疗药物仍然具有重要意义。植物提取物具有资源丰富、细胞毒性相对较小、易获得、成本低廉等诸多积极优势。因此,本研究旨在探讨亚油酸在RA发生发展过程中的可能作用及其机制,体内研究表明亚油酸能明显改善关节肿胀、足部体积、足部厚度,RA大鼠关节周长及关节病理损伤。
RA是一种自身免疫性疾病,其基本病理改变为滑膜炎[12]。研究表明,RA活动期血清和滑膜中炎性细胞因子的表达发生了变化,这些细胞因子中最重要的是TNF-α和IL-1β,它们通常同时存在于炎性细胞中,并且相互作用,其主要机制是激活血管内皮细胞,增强内皮细胞粘附分子的表达,从而聚集关节腔中的白细胞发挥炎症作用,引起相应的临床症状和的软骨破坏[13],同时炎性反应可刺激TNF-α和IL-1β的合成,从而形成恶性循环。TNF-α主要影响滑膜炎的严重程度,而IL-1β对软骨破坏有更大的影响,IL-6和IL-10也与RA的进展密切相关[14]。所以,TNF-α、IL-1β、IL-6和IL-10作为观察指标可以客观、系统地反映RA的病情。因此,本研究进行了ELISA和qRT-PCR检测,数据显示亚油酸可抑制Ⅱ型胶原诱导的RA大鼠TNF-α、IL-1β、IL-6和IL-10的蛋白表达水平和mRNA表达水平。
NF-κB信号通路在RA的发生发展中起着重要作用,因此受到越来越多的关注[15]。NF-κB是一种多效性核转录因子,存在于几乎所有类型细胞的细胞质中,通常以非活性形式存在,在细胞活化、淋巴细胞发育、应激反应、凋亡等细胞活动中发挥重要作用。NF-κB的激活可提高TNF-α、IL-1β、IL-6、IL-8、粘附分子、G-CSF和COX-2的转录水平,同时对TNF-α、IL-1β等多种炎症介质进行正调控和促进[16],而TNF-α和IL-1β可进一步激活NF-κB的表达,从而形成恶性循环,并导致RA反应和结构损伤的维持和进展[17],因此,阻断RA患者病理状态下NF-κB的激活可以下调炎性细胞因子的表达,从而阻断RA的发展。最近的研究表明TLR4与RA的进展和发展密切相关,并在RA患者中高度表达[18],TLR4一种I型跨膜蛋白,并表达于多种组织细胞中,并通过 NF-κB途径启动细胞内的信号转导。TLR4/NF-κB信号通路是RA发病过程中重要的炎症相关通路之一,细胞膜上的TLR4将信号传递给细胞质中的NF-κB、p65,激活NF-κB二聚体从细胞质到细胞核的易位,指导相关基因的转录和翻译,促进细胞分泌下游产物,进一步影响RA的进展和发展,TLR4/NF-κB信号通路已被证明是RA治疗的靶向途径。在本研究中,通过免疫组化法发现亚油酸抑制RA大鼠TLR4/NF-κB信号通路中TLR4和p-p65的表达,同时WB检测也得到了相同的结果。
总之,亚油酸能够抑制RA导致的炎性反应,其机制与亚油酸能通过抑制TLR4/NF-κB信号通路TLR4和p-p65的蛋白表达水平,进而抑制炎性因子TNF-α、IL-1β、IL-6及IL-10的表达有关,通过实验证实了亚油酸通过抑制炎症反应和阻断TLR4/NF-κB信号通路对RA具有潜在的治疗作用。因此,为亚油酸可能成为RA治疗药物提供了依据。
