基于网络药理学及分子对接研究苦参治疗慢性乙型肝炎的作用机制*
2021-09-08李晓斌糟小宾陈贺宁李小科叶永安
李晓斌,曹 旭,糟小宾,李 硕,陈贺宁,朱 顺,李小科**,叶永安**
(1.北京中医药大学第一临床医学院 北京100700;2.北京中医药大学东直门医院 北京100700)
乙型肝炎病毒(Hepatitis B Virus,HBV)感染是全球严重的公共卫生问题之一。HBV感染相关疾病,如肝硬化(Cirrhosis)、肝癌(Hepatocellular carcinoma,HCC),严重威胁人类的生命[1]。据估计,目前我国慢性HBV感染者约7000万例,其中慢性乙型肝炎(Chronic hepatitis B,CHB)患 者 约2000万-3000万例[2]。当前尚缺乏根除HBV共价闭合环状DNA(cccDNA)的方法,因此CHB的治疗以达到“功能性治愈”为目标。抗病毒仍为目前治疗CHB的有效手段,常用药物包括核苷/核苷酸类似物(NAs)及聚乙二醇化干扰素(PEG-IFN),但因耐药风险及严重副反应的存在限制其临床疗效[3]。中医药以其整体观念、辨证论治的特点在CHB治疗上显示出独特的优势,可发挥抑制病毒复制、抗纤维化、调节免疫等诸多疗效。本团队前期的研究观察到中药联合恩替卡韦可提高HBeAg阳性CHB患者的HBeAg清除率[4],并降低其NAs停药后临床复发的风险[5],充分证明中药治疗CHB的潜在疗效,具有极大的研究空间。
中药苦参(Radix Sophorae Flavescentis),味苦性寒,具有清热燥湿,杀虫,利尿之功效。苦参的活性成分如苦参素、氧化苦参碱等可抗病毒、抗炎、调节机体免疫,从多方面发挥治疗CHB的作用[6]。目前关于苦参类制剂治疗CHB已开展大量研究,基于临床症状及体征、血清学指标[7]和免疫学指标[8]的观察均提示苦参的活性成分可有效干预CHB的发生发展。然而,目前的研究多局限于通过某单一活性成分作用于某靶点或通路来论述其机制,未体现多成分、多靶点、多通路的特点,也未从整体角度阐释苦参治疗CHB的作用机制。网络药理学由Hopkins提出[9],具有整体性、系统性的特点,与中医“整体观”一致。网络药理学与中医药研究相结合,科学地阐明“药物-靶点-疾病”关系,有助于中药的系统研发[10]。本研究基于网络药理学方法,采用分子对接技术,筛选苦参治疗CHB的活性成分,预测其潜在分子机制,初步阐释苦参治疗CHB的有效物质基础及作用机制,为系统研究开发苦参提供参考。
1 材料与方法
1.1 苦参活性成分与潜在靶点筛选
通过中医药系统药理学平台(TCMSP)(https://tcmspw.com/tcmsp.php)检索苦参的活性成分,根据口服利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18的2个药物吸收、分布、代谢、排泄属性值(ADME)进行活性成分初步筛选,获得活性化合物及其作用靶点。将所得靶点在Uniprot数据库(https://www.uniprot.org)进行规范。
1.2 慢性乙型肝炎的相关靶点筛选
以“chronic hepatitis B”为关键词,检索Gene Cards数据库(https://www.genecards.org)、OMIM数据库(http://www.omim.org)中与慢性乙型肝炎相关的靶点,合并后删除重复值。
1.3 成分-靶点网络构建与分析
获得苦参活性成分靶点及疾病相关靶点后,取两者交集并进行药物成分靶点-CHB疾病靶点映射得到苦参治疗CHB的潜在作用靶点。用Cytoscape 3.7.2软件构建“相关活性成分-潜在作用靶点”网络并进行可视化。利用Cytoscape的内置工具“network analyze”插件进行网络拓扑结构分析,获得有效成分及靶点的网络拓扑参数,包括连接度(Degree)、介度(Betweenness)及紧密度(Closenesss)等。选取连接度≥中位数为关键活性成分,连接度≥2倍中位数为关键靶点。
1.4 PPI网络构建与分析
将苦参治疗CHB的潜在作用靶点导入STRING数据库,设定种属为“Homo sapiens”,蛋白互作评分≧0.04,获取其相互作用关系,删去无相互作用的靶点。R软件可进行生物信息分析并对结果可视化。通过R 3.6.2,计算PPI网络中各靶点的连接度,连接度越大,与其相互作用的靶点个数越多,选取连接度≥2倍中位数的靶点进行可视化。将其与1.3所得关键靶点取交集得到苦参治疗CHB的核心靶点[11]。核心靶点具有同时与活性成分及其他靶点互作关系密切的特点。
1.5 基因富集分析
在R 3.6.2中,通过“org.Hs.eg.db”包获取潜在作用靶点的entrezID,利用“ClusterProfile”包对其进行GO注释分析及KEGG通路分析。设置p value Cutoff=0.05,q value Cut off=0.05,选取GO分析结果中富集程度最高的前10条及KEGG分析中富集程度最高的前20条通路进行可视化。
1.6 分子对接验证
将关键活性成分导入Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov)获得其2D结构,将核心靶点导入PDB数据库(https://www.rcsb.org),选择合适的蛋白结构。用PyMol软件对靶蛋白结构去水,分离配体和受体。以靶蛋白作为受体,以药物活性成分作为配体,根据靶蛋白复合物中配体的坐标确定分子对接的活性位点,根据靶蛋白活性口袋设置Gridbox坐标及大小,采用AutoDock vina进行分子对接,选取自由结合能最低的结合构象,使用PyMol软件进行可视化处理。
2 结果
2.1 苦参治疗慢性乙型肝炎的活性成分与靶点
在TCMSP数据库共检索得到苦参活性成分(OB≥30%,DL≥0.18)45个,包括槲皮素、苦参碱、苦参素等,活性成分作用靶点共113个。合并Genecards数据库及OMIM数据库的检索结果,共获得人类CHB相关靶点基因8287个。将苦参的作用靶点和CHB相关靶点取交集后,得到苦参治疗CHB的潜在作用靶点97个,具有治疗CHB作用的相关活性成分23个,详见表1。
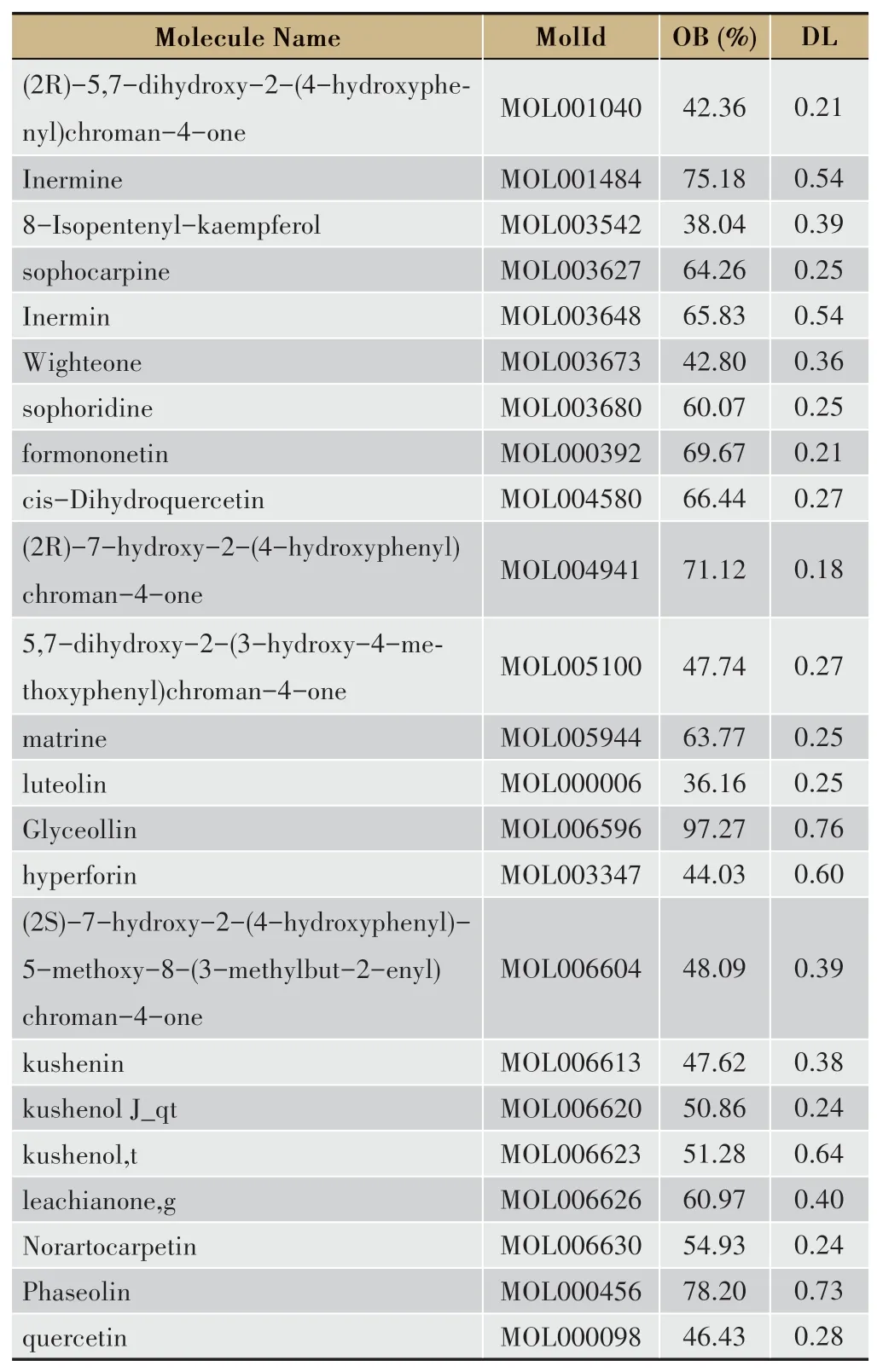
表1 苦参治疗CHB的相关活性成分
2.2 成分-靶点网络的构建与分析
将苦参的相关活性成分及潜在作用靶点信息导入Cytoscape3.7.2,构建苦参治疗CHB的“相关活性成分-潜在作用靶点”网络图。采用Cytoscape 3.7.2的内置“network analyze”插件分析网络的拓扑属性,得到活性成分及靶点基因的连接度、介度、紧密度。连接度越大,图中节点的面积越大,则该节点发挥作用的可能性越大(图1)。经计算,活性成分的连接度中位数为5,故选取连接度≥5为关键活性成分,包括槲皮素(quercetin)、木 樨 草 素(uteolin)、芒 柄 花 黄 素(formononetin)等,关键活性成分的拓扑参数见表2。关键活性成分作用的靶点个数较多,可能为苦参治疗CHB的重要物质基础。靶点的连接度中位数为2,故选取连接度≥4(2倍中位数)为关键靶点,共18个,包括PTGS1、ESR1、PRSS1、PPARG、AR、NCOA2、NCOA1、GSK3B、IL6、ESR2、ICAM1、CHRM3、CHRM1、CHEK1、F7、GABRA1、RELA、CASP3。由图1可知,苦参的一种活性成分可对应一个或多个疾病靶标,多种活性成分可对应相同的疾病靶标,提示苦参治疗CHB具有多成分、多靶标的特点。

图1 苦参治疗CHB的“相关活性成分-潜在作用靶点”网络图
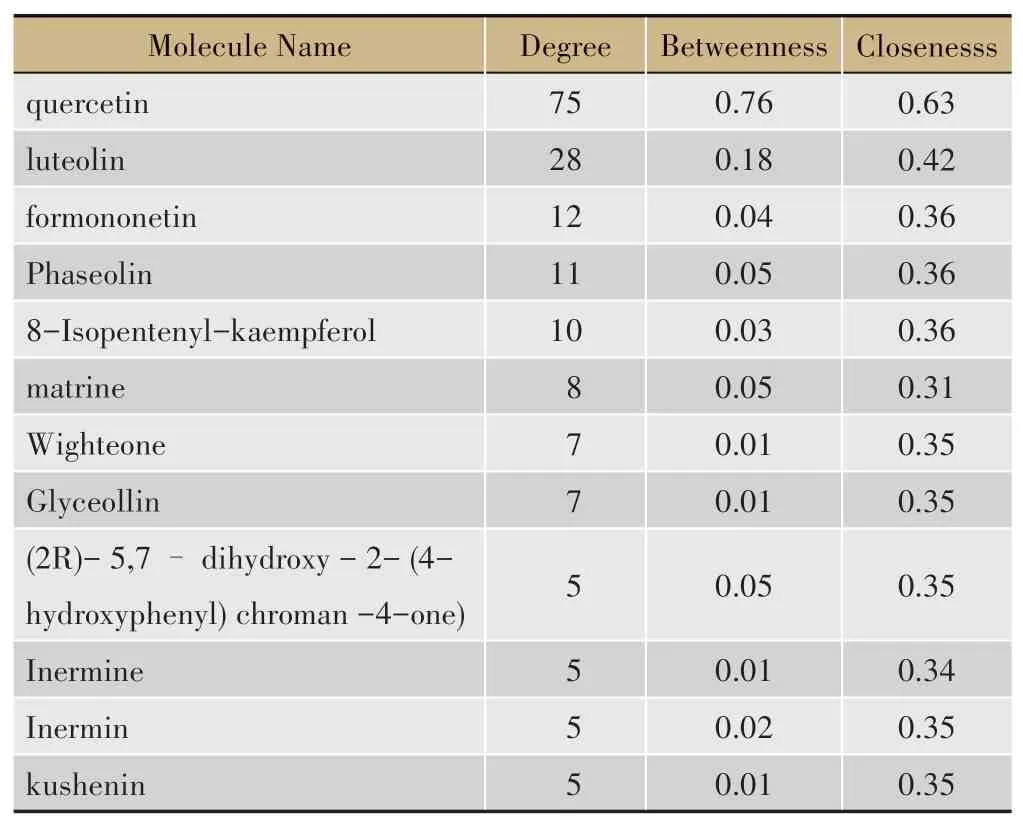
表2 关键活性成分拓扑参数
2.3 靶蛋白相互作用网络(PPI)的构建
将苦参治疗CHB的97个潜在作用靶点导入STRING数据库,获得蛋白互作(PPI)网络。通过R 3.6.2计算可得PPI网络连接度中位数为16,选取连接度≥32(2倍中位数)的靶点进行可视化,共13个(图2)。前面经靶点映射,共获得苦参治疗CHB的关键靶点18个,将其与PPI网络中筛选所得13个靶点取交集,可得到6个核心靶点,分别为IL6、ESR1、PPARG、AR、RELA、CASP3。核心靶点具有与活性成分及其他靶点互作关系均密切的特点,在苦参针对CHB的调控网络中可能起到关键作用。将6个核心治疗靶点导入STRING数据库,获得其相互作用网络(图3)。
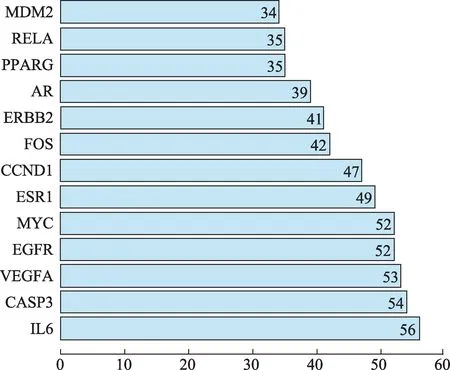
图2 PPI网络连接度≥2倍中位数的治疗靶点柱状图
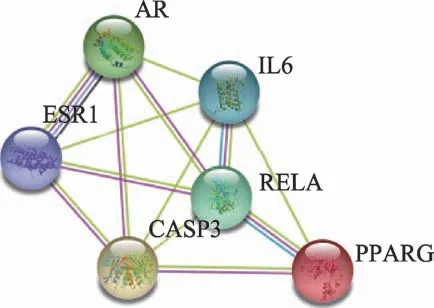
图3 核心治疗靶点蛋白互作关系网络图
2.4 基因富集分析
使用R 3.6.2对97个潜在作用靶点进行GO注释分析及KEGG通路分析。GO注释分析包括生物学过程(biological process,BP)、细 胞 组 成(celluar component,CC)、分子功能(molecular function,MF)3个部分。GO注释分析结果显示潜在作用靶点主要参与的生物学过程(p value≤0.05)1282条,前三条为response to steroid hormone、response to xenobiotic stimulus、response to radiation;参与细胞成分(p value≤0.05)59个,以membrane raft、membrane microdomain、membrane region为主;参与分子功能(p value≤0.05)104条,以DNA-binding transcription activator activity、ubiquitin(-like)protein ligase binding、ubiquitin protein ligase binding的作用较为突出。分别选取富集最显著的前10条进行可视化(图4(A)、(B)、(C))。KEGG通路分析可知,苦参治疗CHB涉及的通路主要有PI3KAkt信号通路、乙型肝炎病毒信号通路,TNF信号通路,细胞凋亡信号通路等(p value≤0.05),涉及病毒感染、炎症、免疫等方面,提示苦参可能通过调节免疫、介导炎症反应、干预细胞凋亡等途径来治疗CHB。选取富集程度高的前20条通路进行可视化(图4(D))。

图4 生物学过程(A)、细胞成分(B)、分子功能(C)及KEGG通路(D)富集结果
2.5 分子对接结果
将“相关活性成分-潜在作用靶点”网络图中连接度最高的成分槲皮素与6个核心靶点进行对接,即受体为IL6(PDB ID:5FUC)、CASP3(PDB ID:3DEH)、PPARG(PDB ID:3SZ1)、RELA(PDB ID:3QXY)、AR(PDB ID:2HVC)、ESR1(PDB ID:2QA8),配体为槲皮素。结合自由能可评价受体和配体之间的结合能力,结合能小于0时,认为配体和受体可以自由结合,且结合自由能越低,二者结合能力越强。结果显示AR、CASP3、RELA、IL6、PPARG可与槲皮素稳定结合,提示槲皮素与上述靶点之间的相互作用可能为苦参治疗CHB的重要机制之一,值得进一步实验验证。ESR1与槲皮素虽未显示有结合力,但作为核心靶点,ESR1可能通过与其他活性成分稳定结合发挥治疗CHB的作用,有待于进一步研究。对接结果见表3、图5(A)、(B)、(C)、(D)、(E)。

表3 槲皮素与核心靶点分子对接结合自由能(kcal/mol)
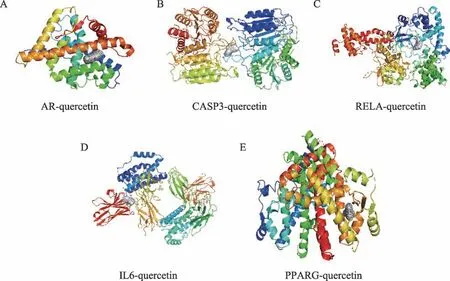
图5 AR-quercetin结合图(A)、CASP3-quercetin结合图(B)、RELA-quercetin结合图(C)、IL6-quercetin结合图(D)及PPARG-quercetin结合图(E)
3 讨论
苦参出自《神农本草经》,传统中医取其清热燥湿、杀虫、利尿之功,主要用于治疗湿热黄疸、泻痢、皮肤瘙痒等病症。随着有关苦参活性物质及其药理作用的研究不断推进,发现苦参的主要活性成分有生物碱、黄酮、三萜皂苷、木脂素、酚酸和少量苯丙素类成分[12],具有抗病毒、抗炎、抗肿瘤、调节免疫的作用。近年来,苦参治疗CHB的研究不断深入,提示苦参在CHB的临床治疗及药物研发等方面有较大的应用价值。本研究通过网络药理学的方法,以中药成分、疾病靶点为研究对象,系统探索了苦参治疗CHB的活性成分、潜在靶点基因和分子机制,预测苦参治疗CHB的物质基础及作用机制,为苦参的后续研究提供科学依据。
3.1 关键活性成分分析
本研究发现苦参具有治疗CHB作用的活性成分共23个,其中关键活性成分有槲皮素、木犀草素、芒柄花黄素、菜豆素、8-异戊烯基-山柰酚、苦参碱、苦参素等。既往大量研究表明上述活性成分具有良好抗CHB的功效,其中以槲皮素、木犀草素、苦参碱、苦参素的研究较深入。槲皮素为黄酮类化合物,实验研究显示槲皮素通过影响亚基因组RNA的转录以及调控热休克蛋白来干扰病毒的转录及复制,减少HBsAg、HBeAg的分泌,降低HBV DNA的水平[13];降低促炎细胞因子如白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的产生,抑制NF-κB的激活,进而减轻炎症反应造成的肝脏损伤[14,15]。木犀草素属天然黄酮类化合物,体内和体外实验均证实木犀草素可有效抑制HepG2.2.15细胞中细胞外信号调节激酶(ERK)介导的肝细胞核因子4(HNF 4)的表达及其与HBV PrC/C启动子的结合,在转录水平上抑制HBV的复制[16]。体外实验发现苦参碱可抑制HepG 2.2.15细胞中HBV DNA的复制及HBsAg的分泌[17]。临床研究证实,苦参碱可提高HBeAg的血清学转换率及HBV DNA的阴转率,改善肝功能,缓解临床症状,且不良反应少见[18]。研究发现苦参素具有抗炎、保肝降酶、抗病毒、抗肝纤维化、免疫调节等作用[19]。FENG等人通过研究苦参素联合阿德福韦酯(ADV)治疗CHB发现,与对照组(ADV)相比,观察组(苦参素联合ADV)血清HBV DNA载量明显减少,透明质酸、Ⅲ型前胶原水平降低,CD4+T细胞、CD8+T细胞水平升高,IgM、IgG、IgA水平升高,血清内毒素水平降低。由此可知,与单用ADV相比,联合苦参素可有效减低患者血清中病毒载量,提高机体免疫力,改善肝功能,延缓肝纤维化的进展,改善预后[20]。此外,一项荟萃分析显示,苦参素与NAs联合使用可有效提高HBeAg血清学转换率、HBV DNA阴转率及ALT复常率[21]。因此,槲皮素、木犀草素、苦参碱、苦参素或为治疗CHB的重要活性成分,具有极大的研究空间,可能为抗CHB药物的研发提供物质基础。
3.2 核心靶点及相关通路分析
本研究显示,苦参有效活性成分参与治疗CHB的核心靶点为IL-6、ESR1、AR、RELA、PPARG、CASP3,这6个核心靶点之间存在显著的相互作用关系。IL-6属TNF信号通路的重要因子,介导免疫调节、炎症诱导等。研究发现,IL-6既可增强淋巴细胞功能,又作为炎症介质参与HBV诱导的肝损伤,对于HBV感染具有双向调节作用[22]。IL-6通过抑制转录因子如HNF-1α、HNF-4α、STAT3与cccDNA的 结合,抑 制HBV DNA转 录[23]。ESR1和AR都 与 性 激 素 相 关。ESR1编码雌激素受体α。雌激素受体α在肝脏的表达上调,与HNF-4α相互作用,可改变其与HBV增强子的结合,进而抑制HBV DNA的转录[24]。AR编码雄激素受体,肝脏的雄激素受体通过直接与病毒核心启动子附近的雄激素响应元件结合来增强HBV RNA转录[25],该活性受HBx的调节。RELA编码RelA蛋白(p65),属NF-κB/Rel蛋白家族的成员。NF-κB/RelA的激活可诱导多种活性靶基因反式激活,包括炎症细胞因子,趋化因子和凋亡介质,在炎症反应中起到重要的作用[26]。PPARG编码过氧化物酶体增殖物激活受体γ,可调节炎症介质的基因表达。研究发现,CHB患者外周血PPARG启动子甲基化增强,该甲基化强度与肝脏炎症和纤维化呈正相关,提示PPARG与HBV的相互作用影响CHB的进展[27]。CASP3编码半胱氨酸-天冬氨酸蛋白酶,在氧化应激的条件下,HBx通过触发CASP3介导的级联反应,降低抗凋亡因子Mcl-1的水平,可能与HBV相关HCC的发生发展有关[28],由此推测,苦参或可延缓HCC的进展。由KEGG富集结果可知,上述核心靶点主要富集在PI3K-Akt及TNF信号通路,这两条通路均与CHB的发生发展密切相关。在体外培养的原代肝细胞模型及HepG2细胞模型中均发现HBX通过激活PI3K-Akt信号通路抑制HBV DNA的复制及细胞凋亡[29-30]。TNF-α作为重要的细胞因子,可通过激活TNF信号通路,参与炎症反应、免疫应答等生物学过程。研究发现在早期感染阶段,TNFα可抑制HBV进入肝细胞及其在细胞内的复制[31];还可使HBV的核衣壳失稳,降低cccDNA的水平[32]。上述研究结果表明,苦参的有效活性成分可能通过以上核心靶点来干预PI3K-Akt及TNF等信号通路,进而起到治疗CHB的作用,进一步证实苦参抗CHB的潜在临床价值,其机制有待于深入研究。
综上所述,本研究基于网络药理学的方法,采用分子对接技术,应用多种生物信息学工具,对苦参多成分、多靶点、多途径治疗CHB的复杂网络关系进行研究。根据研究结果可推测,苦参可能主要通过干预病毒复制、炎症反应、细胞凋亡及肿瘤发生等生物学过程,起到治疗CHB的作用,为后续实验研究进一步 验证其作用机制提供了依据。
