好氧反硝化细菌的分离鉴定及其应用研究
2021-09-07谢晓娜张正波欧阳秋飞杨郑州方春秋
谢晓娜, 张正波,2, 欧阳秋飞, 杨郑州, 方春秋
(1.百色学院 农业与食品工程学院, 广西 百色 533000; 2.浙江环耀环境建设有限公司, 杭州 310014)
随着工业化和城市化进程的加快, 氮素污染导致的水体富营养化日趋严重, 废水脱氮研究尤为迫切。 传统的生物脱氮包括好氧条件下自养硝化过程和厌氧条件下的异养反硝化过程[1], 这2 个过程相对独立, 分别由硝化菌和反硝化菌完成, 由于2 种菌的需氧浓度不同, 很难进行统一。
近年来, 研究人员逐渐发现一些具有异养硝化-好氧反硝化双功能的菌株, 这些菌株在好氧生长结束后, 会迅速进行反硝化作用, 将NO3-或NO2-转化为N2O 或N2[2]。 异氧硝化细菌与自养菌相比, 生长速度快, 并能利用有机物质作为碳源和能源在有氧条件下将氨氮转变为N2[3], 这样可在同一好氧环境条件下降低水体中的硝态氮(NO3--N)和氨态氮(NH4+-N)[1], 从而提高生物脱氮效率[4],实现了在同一反应器中完成硝化和反硝化作用, 很大程度上节省了占地面积和投资成本。
异养硝化-好氧反硝化菌具有诸多的优势。 近十几年, 国内外学者发现了新的异养硝化-好氧反硝化菌株, 拓宽双功能菌的种类, 并研究其脱氮性能和机理[1,5], 以求在实际工程中获得更好的应用[6-7]。 本研究从脱氮性能较佳的城镇污水处理厂活性污泥中分离活性菌株, 探究其在好氧条件下对不同无机氮源的去除能力, 并评估其对生活污水的脱氮能力,为将其开发成为脱氮强化菌剂提供研究基础。
1 材料与方法
1.1 培养基
Luria-Bertani 培 养 基(LB): 蛋 白 胨10 g/L,NaCl 5 g/L, 酵母提取物5 g/L, pH 值7.0。
硝化模拟污水培养基(EM): 以相同浓度NH4Cl 代替DM 培养基中的KNO3。
1.2 好氧反硝化细菌的筛选
(1) 富集培养。 取杭州某污水厂活性污泥1 g放入装有100 mL DM 培养基的三角瓶(250 mL)中,用四层纱布封住瓶口, 于28 ℃、 160 r/min 摇床中振荡培养48 h。
(2) 分离纯化。 用接种环取上述富集培养物于DM 培养基平板上划线分离, 单菌落长出后挑取单菌落; 再次划线纯化, 获得2 株细菌, 分别命名为菌株B1 和F, 并进行LB 培养基斜面接种, 于4 ℃冰箱中保藏。
1.3 试验用水
试验用水取自浙江省丽水市某城镇污水处理厂进水口, 其中COD 的质量浓度为312 mg/L, 总氮的 质 量 浓 度 为69.04 mg/L, 氨 氮 的 质 量 浓 度 为34.89 mg/L, pH 值为5.7。
1.4 试验方法
(1) 菌株的硝酸盐还原能力及氨去除能力测试。 将斜面活化2 株分离得到的菌株, 转接到100 mL LB 培养基中, 于30 ℃、 160 r/min 摇床培养24 h, 取10 mL 菌液, 于8 000 r/min 离心, 弃上清液, 再利用无菌蒸馏水洗涤沉淀, 再次离心, 如此重复3 次, 以去除菌体产生的无机氮素, 最后用10 mL 无菌蒸馏水制备成菌悬液。
取3 mL 的上述菌悬液分别接种30 mL EM 培养基和DM 培养基中, 以3 mL 的无菌蒸馏水为对照。 于30 ℃、 100 r/min 摇床培养22 h, 分别测量培养液中的NO3--N、 NH4+-N 和亚硝态氮(NO2--N)的浓度。
(2) 混合菌株去除污水氮素效率。 将试验用水分装成30 mL/瓶(250 mL 三角瓶), 每瓶添加6 g/L的葡萄糖溶液1 mL。 用1 mol/L NaOH 溶液调节pH 值为6.0、 7.2、 8.0, 备用。
分别取2 个菌株LB 培养基各10 mL 混匀, 按照上述方法制备成混合菌剂悬液, 取3 mL 混合菌剂(培养液V(B1)∶V(F)=1 ∶1)悬液接种于上述每瓶污水中, 以3 mL 的无菌蒸馏水为对照。 于30℃、 100 r/min 摇床培养22 h, 分别检测培养液中的NO3--N、 NH4+-N 的浓度。 每个处理重复3 次。
1.5 分析方法
NH4+-N 采用水杨酸分光光度法测定, NO3--N采用酚二磺酸分光光度法测定, NO2--N 采用N-(1-萘基)-乙二胺测定, 总氮采用碱性过硫酸钾消解紫外分光光度法测定, COD 采用重铬酸钾法测定(HJ 828—2017)。
选取我院慢性心力衰竭(多病因)患者240例(2016年5月—2017年5月)作为观察组,选取同期我院体检健康人员240例作为对照组,观察组男、女为139例、女101例,年龄61至84(71.83±5.12)岁,病史1至8(3.81±0.44)年,对照组男、女为135例、女105例,年龄62至83(72.61±5.56)岁,病史1至7(3.94±0.51)年。一般资料对比,P>0.05。
1.6 菌株的鉴定
(1) 用革兰氏染色法、 芽孢染色法观察菌体形态特征。
(2) 16s rDNA 鉴定[8]。 将按照上述培养方法培养分离的2 株细菌, 分别用一对通用引物f 27(5′-AGAGTTGATCCTGGCTCAG-3′)和r1492(5′-GGTTACCTTGTTACGSCTT-3′)对 细 菌 的 基 因 组DNA 进行16S rDNA 扩增, 扩增引物及扩增产物测序均由上海生工技术有限公司提供。 PCR 反应程序为: 94 ℃5 min, 94 ℃1 min, 56 ℃1 min, 72℃2 min, 40 个循环; 72 ℃10 min。
(3) Biolog 微生物自动分析系统。 采用GENⅢ微孔鉴定板对2 株分离菌株进行了94 种表型测试,包括71 种碳源利用测试和23 种化学敏感性测试。试验程序按照Biology 公司的鉴定操作指南进行[9]。
2 结果与讨论
2.1 好氧反硝化细菌的筛选
采用富集培养和平板分离相结合的方式分离出2株细菌菌株B1 和F, 经过LB 培养基活化培养制成菌悬液, 加入硝化模拟污水EM 培养基和反硝化模拟污水DM 培养基进行培养22 h。 分别测定培养液中NO3--N、 NO2--N 和NH4+-N 的浓度, 结果见表1。

表1 分离菌株处理模拟污水Tab. 1 Treatment of simulated sewage by isolated strains
2 株分离菌株B1 和F 都有较好的NO3--N 去除 效 果, DM 培 养 基 中NO3--N 去 除 效 率 均 高 于80%, 其中菌株B1 处理的去除率达到84.93%。 在培养后的DM 培养物中, 均检测到少量的NO2--N和NH4+-N。 由于NO2--N 是硝酸盐反硝化的中间产物[10-11], 表明NO3--N 的去除有好氧反硝化作用的参与。 NH4+-N 的产生则是菌体生长代谢的产物, 通过硝酸盐还原作用将NO3--N 转化为NH4+-N 供菌体利用[12], 在以NO3--N 为唯一氮源培养基中, 好氧反硝 化 菌 Pseudomonas sp. Qy37[13]、 Alteromonas macleodii 8D[14]也存在类似的现象。 李耀东等[15]对好氧反硝化菌Pseudomonas sp. BN5 的氮平衡研究发现, 氮的去除为菌株反硝化作用和细胞同化作用共同的结果, 本研究中菌株B1 和F 对DM 培养基中NO3--N 去除也表现为反硝化和细胞同化生长共同作用。
菌株B1 和F 均能在硝化模拟培养基EM 中生长, 同时具有较好的NH4+-N 去除效果, 去除率均在60%左右, 这与白洁等[8]分离的异养硝化-好氧反硝化细菌Zobellella sp.B307 的NH4+-N 去除率比较接近。 由于EM 培养基以NH4+-N 为唯一氮源体系, 在菌株处理和对照处理的EM 培养基中, 均检测到微量的NO2--N 和NO3--N, 且各处理浓度无显著差异, 这可能是培养过程中氧气充足, 自然氧化反应引起的结果。
异氧菌的好氧反硝化脱氮机制并未阐明, 在以NH4+-N、 NO2--N 和NO3--N 等为唯一氮源时, 菌株的脱氮性能差异显著[16], 有些菌种只能利用其中的1 种 或2 种 氮 源, 如Acinetobacter calcoaceticus HNR 只能利用NH4+-N[17], 而Pseudomonas stutzeri C3 则可以利用NO3--N, 但不能利用NH4+-N[18]。 本研究中菌株B1 和F 均可以利用NO3--N 和NH4+-N,有较好的开发利用潜力。
2.2 好氧反硝化细菌处理城镇污水的生物脱氮效率
用分离得到的2 株细菌, 制备成混合菌剂(培养液V(B1) ∶V(F) =1 ∶1), 用于处理城镇生活污水, 考察其生物脱氮效果, 结果如表2 所示。
由表2 可以看出, 在pH 值为6.0 ~ 8.0 范围内, 该混合菌剂对污水中的NH4+-N 和总氮均有较高的去除效果。 当pH 值为中性7.2 时, 处理22 h后NH4+-N 和 总 氮 的 去 除 效 果 最 好, 分 别 为77.09%、 59.25%; 而 当pH 值 为6.0 和8.0 时,NH4+-N 和总氮去除率无明显差异, 且低于中性条件时的去除率, 这与朱晓明等[19]研究恶臭假单胞菌(Pseudomonas Putida)XK51 脱氮最适合pH 值为7.0 相一致, 当pH <6.5 或pH >8.0 时, 脱氮效率会明显降低。 同一pH 值条件下, 混合菌剂对污水中NH4+-N 的去除率明显高于总氮的去除率, 且混合菌剂对城镇生活污水NH4+-N 的去除率(77.09%)明显高于模拟污水EM 培养基的NH4+-N 去除率(60.20%)。 这可能是因为城镇生活污水中不仅含有有机氮源, 还含有形式多样的无机氮源, 其丰富的混合氮源体系有利于NH4+-N 的代谢[10]。

表2 分离菌株混合菌剂对城镇污水的生物脱氮效果Tab. 2 Effect of isolated mixed strain agents on biochemical nitrogen removal from municipal sewage
2.3 好氧反硝化细菌菌种鉴定
在LB 培养平板上, 菌株B1 形成的菌落, 表面凸起, 干燥, 边缘形成不规则。 经光学显微镜观察, 菌株呈杆状, 革兰氏染色阳性, 产芽孢。 菌株F 形成的菌落, 表面平整, 不光滑, 干燥, 边缘形成不规则。 经光学显微镜观察, 菌株呈杆状, 革兰氏染色阳性, 产芽孢。
菌株B1 和F 的16S rDNA 基因序列通过Blast比对分析, 菌株B1 与Bacillus cereus WPySW2(CP 053289.1)的同源性达100%, 根据形态特征, 初步鉴定菌株B1 为蜡状芽孢杆菌(Bacillus cereus); 菌株F 与Bacillus subtilis J-5(CP 018295.1)的同源性达99%, 根据形态特征, 初步鉴定菌株F 为枯草芽孢杆菌(Bacillus subtilis), 如图1 所示。
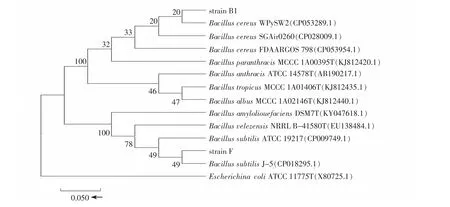
图1 基于16S rDNA 基因序列同源性构建菌株B1 和F 的系统发育树Fig. 1 Phylogenetic tree of strain B1 and F based on the sequences of 16S rDNA gene
2 个菌株通过Biolog 自动微生物鉴定系统(GENⅢ微孔鉴定板)分析, 菌株B1 与Bacillus cereus 的SIM 值最高为0.276(小于0.5), 菌株F 与Bacillus subtilis 的SIM 值最高为0.181(小于0.5)。 由于2 株菌的SIM 值均小于0.5, 仅能确定分离菌株B1 和F为芽孢杆菌属[9]。 结合16S rDNA 分析的结果, 可认定菌株B1 为蜡状芽孢杆菌(Bacillus cereus), 菌株F为枯草芽孢杆菌(Bacillus subtilis)。
3 结论
(1) 从活性污泥中分离得到2 株异养硝化-好氧反硝化细菌B1 和F, 经鉴定分别为蜡状芽孢杆菌(Bacillus cereus)和枯草芽孢杆菌(Bacillus subtilis)。
(2) 菌株B1 和F 均可以利用单一无机氮源NH4+-N 和NO3--N, 对反硝化模拟污水DM 培养基中NO3--N 去除率分别为84.93%和81.19%, 对硝化模拟污水EM 培养基中NH4+-N 的去除率分别为60.20%和60.95%。
(3) 2 株细菌的混合菌剂对城镇生活污水均具有较好的脱氮效果, 当pH 值为7.2 时, 处理22 h后NH4+-N 和总氮的去除率分别为77.09%、 59.25%。因此, 该好氧反硝化细菌B1 和F 可开发作为生物脱氮菌剂的潜力菌株。
