早期胃癌非治愈性内镜黏膜下剥离术后肿瘤残余和复发的影响因素及预后分析
2021-09-07方蒙李锐杨荟玉刘冰熔刘丹
方蒙,李锐,杨荟玉,刘冰熔,刘丹
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
胃癌是起源于胃黏膜上皮的恶性肿瘤,是常见的恶性肿瘤之一。早期胃癌(early gastric cancer,EGC)指仅局限于胃黏膜层或黏膜下层而不论有无淋巴结转移的胃癌。随着体检意识的增强和内镜检查技术的发展,EGC的检出率呈逐年上升的趋势。以内镜黏膜下剥离术 (endoscopic submucosal dissection,ESD)为代表的内镜微创治疗技术已成为EGC的主要治疗手段,其治愈性切除率可达73.6%~95.0%[1-2]。随着ESD技术的广泛应用,ESD术后的非治愈性切除病例逐年增加。研究显示,7%~10%的非治愈性切除的EGC患者发生局部复发或远处转移,其中30%以上患者死于胃癌复发[3]。对非治愈性切除的患者追加外科手术,外科术后病理提示淋巴结转移率为5%~10%[4],肿瘤残余率为5.2%~14.3%[5]。临床实践中一般建议对非治愈性切除的EGC患者追加外科手术,但部分患者因高龄、一般状态差等拒绝追加手术治疗[5-7]。本文通过回顾性分析非治愈性切除的EGC患者的临床资料并进行随访,分析其临床病理资料特点,探讨肿瘤复发和转移的影响,以期为EGC非治愈性切除患者的后续治疗提供临床指导。
1 资料与方法
1.1 研究对象收集2013年1月至2020年5月于郑州大学第一附属医院行ESD治疗后经病理证实为非治愈性ESD切除的EGC患者的临床资料。(1)治愈性切除的判定标准:病变完全切除、病变直径≤2 cm、切缘阴性、无溃疡且无淋巴脉管浸润的分化型黏膜内癌。(2)相对治愈性切除的判定标准为病变完全切除、切缘阴性且无淋巴脉管浸润,同时满足以下条件之一:①病变直径>2 cm、无溃疡的分化型黏膜内癌;②直径≤3 cm、有溃疡的分化型黏膜内癌;③直径≤2 cm、无溃疡的未分化型黏膜内癌;④无溃疡、病变直径≤3 cm、黏膜下层浸润深度<500 μm的黏膜下癌。(3)不符合以上标准者判定为非治愈性切除[2]。(4)排除标准:①既往有胃手术史;②ESD术后追加放化疗;③病历资料不完整。本研究已获得郑州大学第一附属医院科研和临床试验伦理委员会批准。患者知晓本研究内容并签署知情同意书。
1.2 随访根据非治愈性ESD术后6个月内是否追加外科手术将患者分为随访组和手术组。分别于ESD和外科手术后3、6、12个月复查随访组和手术组患者的胃镜,术后6个月复查腹部CT,此后每年复查1次。通过电话、门诊系统进行随访,随访时间自确诊之日至2020年12月。残留指ESD术后 6个月内原病灶处及其周围1 cm内经病理检查发现肿瘤病灶;复发包括局部复发、同时性癌和异时性癌[4]。
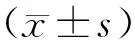
2 结果
2.1 基线资料最终纳入73例非治愈性切除的EGC患者,其中手术组28例,随访组45例。与随访组比较,手术组低/未分化型、SM2浸润较多(P<0.05);两组性别、年龄、病灶最大径、饮酒史、家族史、病灶部位、内镜分型、有无溃疡、垂直切缘、水平切缘、神经侵犯及淋巴脉管侵犯情况比较,差异无统计学意义(P>0.05)。见表1。
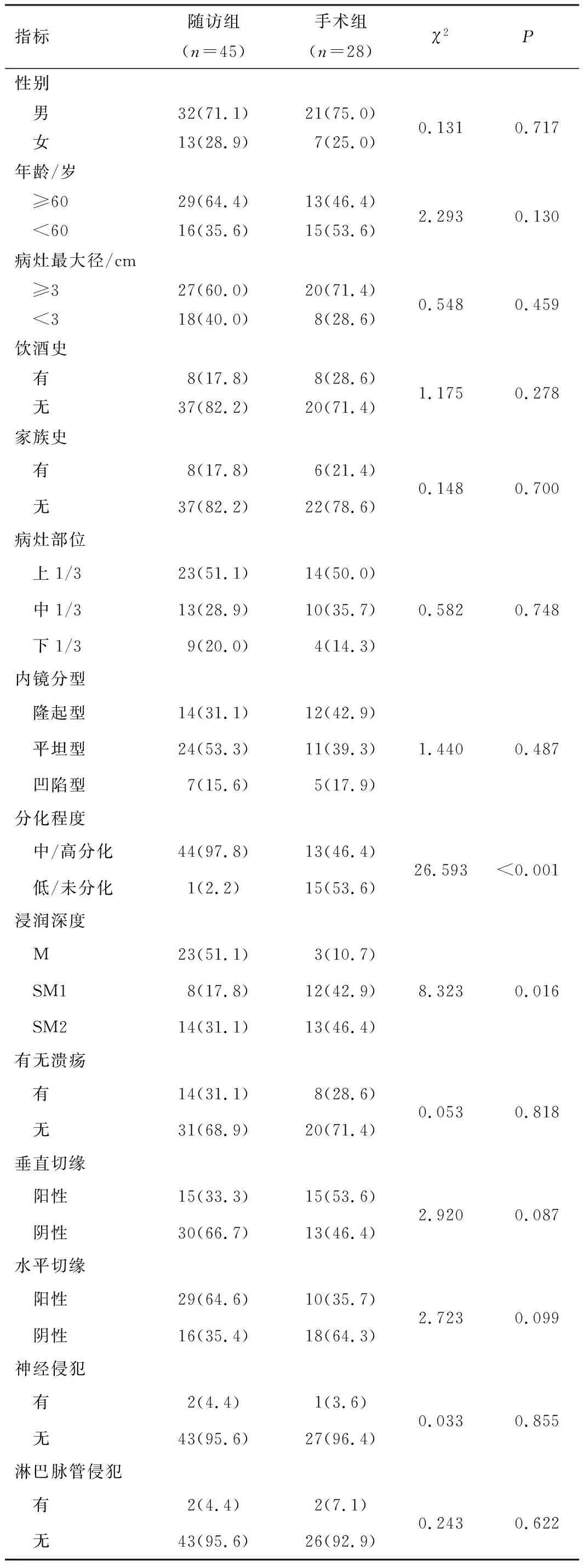
表1 两组基线资料比较[n(%)]
2.2 生存预后随访组中位随访时间[20.0(12.0~30.0)个月]与手术组[20.0(14.0~27.0)个月]比较,差异无统计学意义(P=0.647)。随访期间无失访病例,两组均无死亡及远处转移发生。手术组有1例在术后12个月发现局部复发,复发后再次行ESD治疗,术后病理为高级别上皮内瘤变;随访组有3例分别于术后7、8、22个月发现局部复发,复发后均追加外科手术,术后病理为高级别上皮内瘤变,无淋巴脉管浸润及淋巴结转移。两组无复发生存率比较,差异无统计学意义(P=0.641)。见图1。

图1 EGC非治愈性ESD切除后手术组和随访组患者
2.3 手术组肿瘤残留的影响因素手术组患者的术后病理显示:6例(21.4%)有肿瘤残留,其中2例病理分期为pT2N0M0期,4例为pT1bN0M0期;1例(3.5%)有淋巴结转移,病理分期为pT1bN1M0期。单因素logistic回归分析显示,SM2浸润是肿瘤残留的危险因素(P<0.05)。见表2。
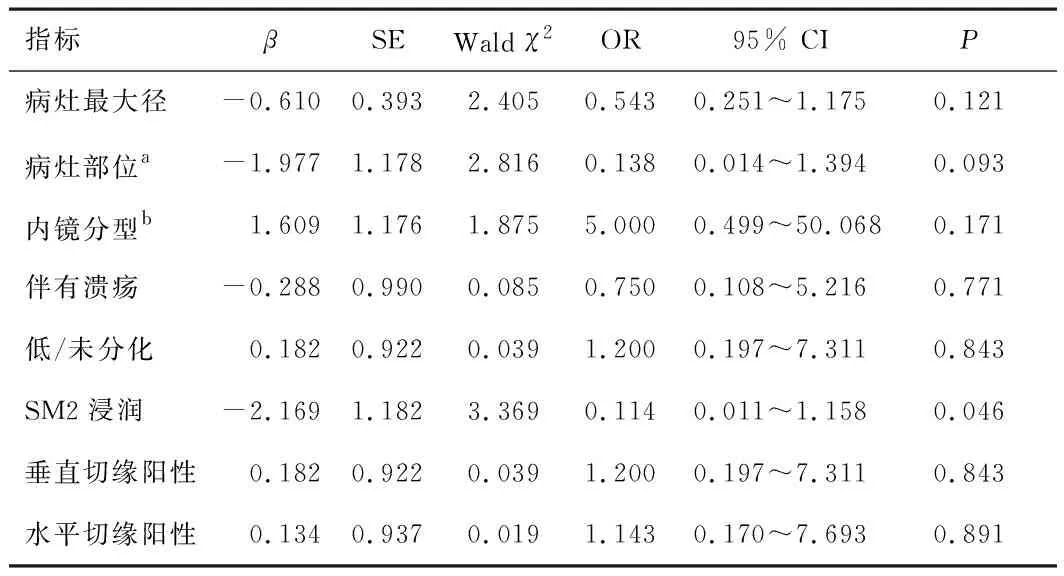
表2 手术组肿瘤残留的单因素logistic回归分析
2.4 肿瘤复发的影响因素对研究所纳入的73例患者进行了7~52个月的随访,共4例发生胃内复发,均为局部复发。单因素logistic 回归分析显示,淋巴脉管侵犯是胃内复发的危险因素(P<0.05)。见表3。

表3 EGC非治愈性切除肿瘤复发危险因素的单因素logistic回归分析
3 讨论
Jeon等[8]研究显示,手术组和随访组的无复发生存率无明显差异。一项纳入288例非治愈性切除的ESD胃癌患者的回顾性研究发现,随访组5 a无复发生存期短于手术组[9],但该研究只分析了扩大适应证的病例,不能代表所有非治愈性切除的患者。
Sunagawa等[5]在一项纳入200例患者的单中心回顾性分析中报道,垂直切缘阳性和水平切缘阳性是肿瘤残留的高危因素。在本研究中,手术组患者中有6例存在肿瘤残余,2例术后病理显示肿瘤侵及固有肌层,单因素logistic回归分析显示肿瘤残留与SM2浸润有关,而与病灶最大径、肿瘤部位、内镜分型、是否伴有溃疡、分化程度、切缘阳性无关。切缘阳性指最边缘组织2 mm内含有肿瘤细胞,其结果的判断与术中边缘烧灼情况以及术后切除标本固定送检的质量等临床因素密切相关。SM2浸润则提示肿瘤可能侵犯到黏膜下层深层,受其他因素的影响较少。因此,ESD术前应常规对病灶进行内镜下放大及染色等评估,必要时可使用超声内镜协助判断病变的浸润深度,严格按照适应证选择病例,减少非治愈性切除。病灶直径>3 cm是肿瘤残余的危险因素,但纳入的研究对象中包含部分内镜黏膜切除术病例,病灶整块切除率较低,不能完全代表肿瘤直径与非治愈性ESD术后肿瘤残余的关系,且病灶直径偏大时,肿瘤是否残留可能受到内镜医生操作技术的影响[7]。Yang等[10]认为,非治愈性切除患者发生淋巴结转移与淋巴脉管瘤栓、SM2浸润有关。本研究中手术组患者淋巴结转移病例1例,因病例数较少而未进行淋巴结转移的危险因素分析。
Lee等[11]认为切缘不清晰和病灶位于胃上1/3是肿瘤复发的危险因素,但该研究仅纳入了切缘阳性的患者,并非针对所有非治愈性ESD患者。既往多项研究[12-14]报道淋巴脉管侵犯是EGC内镜下治疗后复发的危险因素。本研究也显示非治愈性切除后肿瘤复发与淋巴脉管侵犯有关。因此,考虑到较高的复发风险,应对淋巴脉管侵犯的患者进行严格的定期随访,以对肿瘤复发情况及时做出准确判断。
本研究存在一定的局限性。首先,本研究为回顾性研究,手术组较随访组低/未分化型、SM2浸润更多见。其原因可能是临床认为这2种因素与淋巴结转移或肿瘤复发关系密切[8-9,11-12,15]。在医生充分告知患者及家属潜在风险后,对涉及上述情形的患者多追加了外科手术。其他回顾性研究[16-17]亦见类似问题,需开展前瞻性研究进一步证实该研究结果。本研究样本量偏少,随访时间偏短,未发现死亡及远处转移病例,可能导致结果偏倚。其次,本研究因病例少剔除了2例非治愈性ESD术后追加化疗的患者,未将其与随访组及手术组进一步对比分析。今后将继续延长随访时间,扩大样本量,对采取多种不同治疗方案的非治愈性切除ESD患者的预后进行更深入的研究。
SM2浸润的EGC患者的肿瘤残留风险高。ESD术前应细致评估病变浸润情况,减少非治愈性切除的发生。淋巴脉管侵犯患者的肿瘤复发风险高。应严格定期随访,以对肿瘤复发情况及时做出准确判断。对于中/高分化、SM浸润浅而拒绝外科手术的非治愈性ESD切除的EGC患者,密切随访是可选择的策略。
