黑麦草对土壤中抗生素的降解及其机理研究
2021-09-07吴玉清王永会胡鸿飞赵雨佳
吴玉清,王永会,李 祥,胡鸿飞,赵雨佳
(1.鸿灌环境技术有限公司,江苏苏州215200;2.常州大学环境与安全工程学院,江苏常州213164)
抗生素的组成分为霉菌、细菌、其他微生物产生的次级代谢产物、人工合成的类似化合物。美国每年抗生素在畜禽养殖业中使用量约为15.9万吨,中国每年用在畜禽养殖的抗生素大约在8万吨以上。据Wise 2002年统计,抗生素在全球每年的用量为10~20万吨,其中中国约占年消费量的四分之一,并且全球抗生素用量每年都在逐步增加。
目前,畜禽养殖业中各种抗生素的滥用现象十分广泛。绝大部分抗生素不能被机体全部消化分解。据统计,约80%及以上的抗生素经畜禽的排泄物和其他分泌物或者其他途径排出体外,通过不同途径对水和土壤环境造成污染。
1 材料与方法
1.1 药品和试剂
磺胺二甲基嘧啶(SM2),纯度>98%,上海卒瑞有限公司;金霉素(CTC)、四环素(TC)、强力霉素(DC)、洛美沙星(LOM)、诺氟沙星(NOR)、恩诺沙星(ENR)、环丙沙星(CIP),纯度均>96%,阿拉丁公司。
1.2 主要实验仪器
FAI104N电子天平;KQ-2 50E医用超声波清洗器;101-L电热恒温鼓风干燥箱;UGC-12MT氮吹仪;GM-0.3311隔膜真空泵;DZS-708型pH计;X1R高速冷冻离心机;LC-MS/MS高效液相色谱-质谱仪;SPE固相萃取装置,质谱,三重串联四级杆,Water TQ Detector,Waters,USA;HZQ-F160全温振荡培养箱;LAS植物根系分析仪;THS-82A恒温摇床;SPX-250BSH-11生化培养箱;LDZX-50KB高压灭菌锅;SPX-250智能生化培养箱;-86-340型-80℃超低温冰箱;KQS200DB数控超声清洗器;JAHY11制冰机;DHG-9123A烘箱。
1.3 培养基的配制
氨化培养基的配制:
(1)液体培养基的配制:分别称取氯化钠1.2 g,葡萄糖2 g,七水合硫酸镁0.3 g,磷酸氢二钾0.4 g,硫酸铵1.2 g,硫酸亚铁0.2 g,将所有药品加入水中溶解,并加蒸馏水定容至500 mL,调节pH至7.3左右,120℃在灭菌锅中灭菌0.5 h。
(2)蛋白胨(0.2%)的配制:取1 g蛋白胨粉末慢慢溶于水中,并加蒸馏水定容到500 mL的锥形瓶内,120℃下灭菌锅中灭菌0.5 h。
1.4 其他试剂的配制
(1)抗生素标准液的配制
2 000μg/mL标准溶液:取100 mg抗生素加入水中,并定容到50 mL制成标准液。然后取1.25 mL标准溶液定容至25 mL,配制浓度为1μg/g;同时取6.25 mL标准溶液定容至25 mL,配制浓度为5μg/g。
(2)抗生素提取液(EDTA+甲醇)的配制
甲醇溶液的配制:准确称取0.026 g标准样品溶于甲醇,定容到25 mL棕色容量瓶中,配制1 mg/mL浓度的标准溶液。试验用水均为超纯水。
0.1 moL/L盐酸溶液的配制:量取8.6 mL浓盐酸加入水中,并定容到1 L。
1.5 土壤样品前处理
实验污染土壤采自常州风干水稻田,过20目筛,研磨,备用。
1.6 抗生素污染土壤配置及盆栽试验
1.6.1 污染土壤配置
土壤样品和猪粪按100∶1混匀,过20目筛,备用。
1.6.2 黑麦草的种植和培育
取3盆实验空白土样不种植黑麦草,作为对照组。每种抗生素取3盆种植黑麦草,种子发芽之后测定不同时段土壤中残留抗生素的量。
1.7 土壤中抗生素的提取
1.7.1 提取液的选择
抗生素的提取液组成成分为EDTA和甲醇溶液,抗生素提取液比例为:EDTA缓冲溶液∶甲醇=1∶1(V/V)。
1.7.2 抗生素的提取
称取5.1 g土壤样品放到离心管中,然后加入配制好的抗生素提取液(比例为1∶1,pH=4)10 mL,振荡1 min左右确保样品充分混匀,超声萃取10 min后,5 000 r/min下离心分离6 min提取上清液。分别再加入8 mL、6 mL抗生素提取液到离心管中,按上述步骤提取两次。将收集的滤液过滤膜后用超纯水稀释到400 mL。分别用2 mL的超纯水和甲醇冲洗并活化几次,然后将滤液流过HLB固相萃取柱富集。上样完毕后,用5%的甲醇水溶液清洗萃取柱,然后干燥10 min。之后用离心管收集洗脱液,并氮吹使液体少于0.5 mL。将接近干的洗脱液加入甲醇定量至2 mL,加入20μL、100 μL/L的西玛通,充分摇匀后作为内标物(对比测定含量)。最后将其过0.25μm滤膜,转至棕色小瓶中,4℃下避光保存待测。
2 黑麦草对典型抗生素的降解效果
2.1 黑麦草对土壤中四环素类和磺胺类抗生素的降解
液相色谱-质谱(LC-MS/MS)测出土壤初始残留量:四环素0.878 mg/kg,金霉素1.267 mg/kg,强力霉素0.381 mg/kg,磺胺二甲基嘧啶0.177 mg/kg。
实验空白组与种植黑麦草后同期四环素类和磺胺类抗生素残留量对比如图1~图4所示。
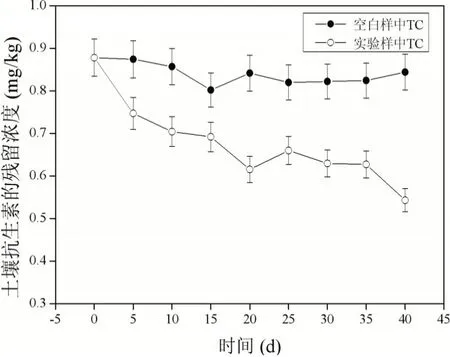
图1 空白样与实验样中四环素(TC)的降解效果对比

图2 空白样与实验样中金霉素(CTC)的降解效果对比

图3 空白样与实验样中强力霉素(DC)的降解效果对比
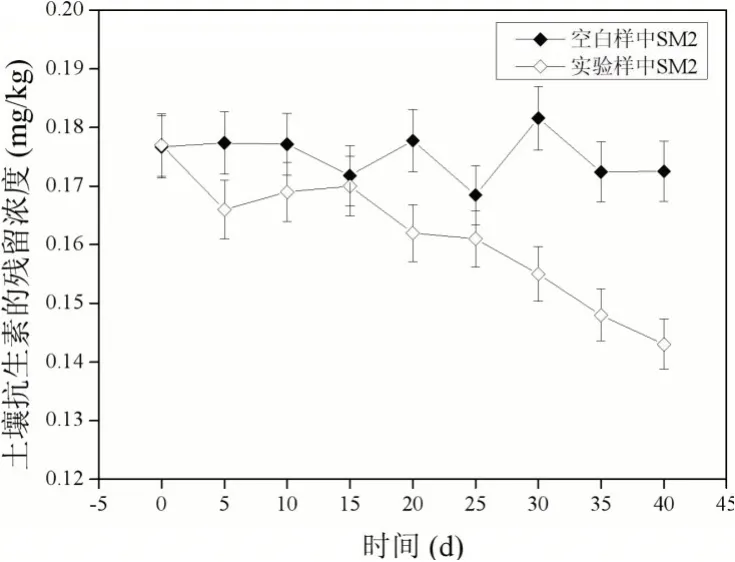
图4 空白样与实验样中磺胺二甲基嘧啶(SM2)的降解效果对比
2.2 黑麦草对土壤中喹诺酮类抗生素的降解
液相色谱-质谱(LC-MS/MS)测出土壤初始残留量:恩诺沙星0.294 mg/kg,洛美沙星0.543 mg/kg,环丙沙星0.236 mg/kg,诺氟沙星1.439 mg/kg。
实验空白组与种植黑麦草后喹诺酮类抗生素的残留量如图5~图8所示。
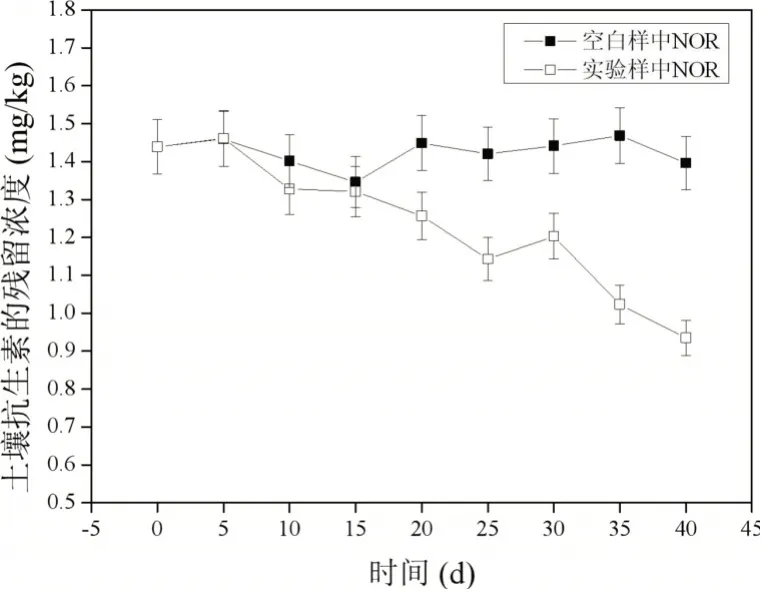
图5 空白样与实验样中诺氟沙星(NOR)的降解效果对比

图6 空白样与实验样中洛美沙星(LOM)的降解效果对比

图7 空白样与实验样中恩诺沙星(ENR)的降解效果对比

图8 空白样与实验样中环丙沙星(CIP)的降解效果对比
2.3 分析与讨论
(1)黑麦草对土壤中四环素类和磺胺类抗生素的降解效果
黑麦草对土壤中四环素类和磺胺类抗生素的降解效果不尽相同。其中对四环素的降解率为31.3%,金霉素的降解率为38%,强力霉素的降解率为29.4%,磺胺二甲基嘧啶的降解率为19.2%。经分析可知,黑麦草对磺胺二甲基嘧啶的降解率最低,对金霉素的降解率最高。在实验空白组中,四环素类和磺胺类抗生素的土壤残留含量趋于平稳,含量的大小差异比较微小,基本排除了除黑麦草之外其他因素的降解干扰。由此可见,黑麦草对土壤中四环素类和磺胺类抗生素有一定的降解效果。
(2)黑麦草对土壤中喹诺酮类抗生素的降解效果
黑麦草对土壤中喹诺酮类抗生素的降解效果也有一些差异。其中对恩诺沙星的降解率为24.8%,环丙沙星的降解率为34.3%,洛美沙星的降解率为22.3%,诺氟沙星的降解率为35%。其中黑麦草对诺氟沙星和环丙沙星的降解率比较高,洛美沙星的降解率相对较低。在实验空白组中,土壤中残留的喹诺酮类抗生素含量变化较少,趋于平稳,差异也比较微小,基本排除了除黑麦草之外其他因素的降解干扰。由此可见,黑麦草对土壤中喹诺酮类抗生素也有一定的降解效果。
(3)黑麦草对土壤中残留典型抗生素的降解效果
实验得出,黑麦草对于喹诺酮类抗生素的降解效果比四环素类和磺胺类抗生素要好,可能与抗生素自身的理化性质有关。四环素类的土壤-水平衡系数(k)为100~3 900 L/kg,磺胺类抗生素的土壤水平衡系数(k)为0.9~10 L/kg,喹诺酮类的土壤-水平衡系数(k)为496~61 000 L/kg,喹诺酮类抗生素的数值比磺胺类抗生素高出近千倍。这可能就是黑麦草植物降解喹诺酮类抗生素比磺胺类抗生素的效果要好出许多的原因。除此之外,土壤的pH、湿度、孔隙率等对土壤中遗留的抗生素的降解、吸附、吸收和迁移也有重要的影响。
3 土壤中微生物活性和氧化作用的测定
3.1 土壤中微生物活性的测定
3.1.1 土壤微生物呼吸作用的测定(图9)

图9 黑麦草对抗生素污染土壤中微生物呼吸作用的影响
采用碱吸收法测定土壤呼吸作用,实验步骤如下:
(1)将土壤样品先进行预处理,准备500 mL的敞口玻璃瓶3个,再准备盛放液体的敞口瓶3个,每瓶中放入20 mL浓度为1 mol/L的NaOH溶液。将瓶子放入敞口玻璃瓶中。
(2)将20 g试验土壤放于敞口玻璃瓶内,并加入0.1 g葡萄糖作为营养液。
(3)将敞口玻璃瓶的瓶口严封,放在28℃的恒温箱中培养24 h。
(4)将盛放氢氧化钠的小瓶取出,加入几滴酚酞试剂,用0.1 mol/L盐酸滴定。
(5)准备同样规格体积的敞口玻璃瓶,不加入实验土壤,其他步骤同上。
(6)根据空白样和实验样的差值计算二氧化碳的释放量。
3.1.2 土壤微生物氨化作用的测定
根据氨氮标准曲线可以得出公式
y=6.403 6x-0.135 42,R=0.999 4
根据测定的数据对照曲线查出氨氮质量,根据空白样的数据算出土壤微生物氨氮的抑制率和刺激率(如图10)。

图10 黑麦草对抗生素污染土壤中微生物氨化作用的影响
3.2 分析与讨论
在黑麦草降解抗生素的过程中,测定不同时间段抗生素的活性变化,从呼吸作用和氨化作用两个方面进行分析和评价。
黑麦草对抗生素污染土壤中微生物的呼吸抑制有缓解作用。由图9可知,土壤中微生物的呼吸作用在前15天左右呈现抑制,原因可能是抗生素污染对土壤中微生物的酶活和其他生命活动产生了抑制作用;15天后,由于植物吸收、转移和降解作用使微生物的呼吸抑制得到缓解,刺激了植物呼吸作用中CO的产生。在降解过程中,种植了黑麦草的实验土壤中微生物的呼吸强度是空白土壤的1.4倍。在实验前10天微生物氨化作用不明显,抑制率10%~40%,实验中后期微生物的氨化作用刺激率开始逐级升高,上升趋势明显。种植了黑麦草后的土壤微生物的氨化强度比未种植的氨化强度高出了3.2倍。
通过实验数据分析,黑麦草对抗生素污染土壤中微生物的活性刺激效果良好,有明显的刺激和恢复效果。土壤中抗生素的浓度越高,对微生物的抑制作用越强;反之抑制效果越弱。因此,土壤中残留抗生素的浓度如果一直比较高并得不到有效降低将对土壤的供氮能力产生一定影响。
4 降解过程中黑麦草根系体表特征分析
4.1 降解过程中黑麦草根系的变化(图11)

图11 黑麦草生长过程中根系体表特征
通过对黑麦草生长过程中植物体表特征进行分析,研究黑麦草根系的变化和土壤中残留抗生素降解效果之间的关系,为植物吸附、迁移和降解土壤中残留抗生素类有机物提供依据。
利用根系分析仪对不同生长时间阶段下的黑麦草植物根系的总长度、总切面面积、总表面积等特征进行研究分析。
4.2 分析与讨论
试验发现,黑麦草在生长过程中根系变化明显,在实验的第40天根系总长度为35.62 mm,平均长度为8.96 mm,平均直径为0.233 5 mm,总切面面积为0.059 6 cm,总表面积为0.187 3 cm,平均切面积为0.008 8 cm,平均表面积为0.027 7 cm。根系的各方面指标和土壤中抗生素含量减少有关。同时,植物根系的生长发育对被抗生素抑制活性的微生物也有一定的刺激恢复作用。植物协同微生物的修复功能在一定程度上对土壤中残留抗生素的降解起到了促进作用。
5 结论与展望
本实验研究了黑麦草对土壤抗生素的降解及其机理,结论如下:
(1)黑麦草对土壤中残留的典型抗生素的降解效果差异比较明显。对CTC的降解率最高,为38%;SM2的降解率最低,为19.2%。对NOR和CIP的降解率分别为35%和34.3%,LOM的降解率相对最低,为22.3%。
(2)黑麦草可以明显改善土壤中微生物的生物活性,提高其刺激率,对抗生素污染土壤中微生物的呼吸抑制有缓解作用。种植了黑麦草的实验土壤中微生物的呼吸强度是空白土样中的1.4倍。对于土壤微生物的氨化作用,在实验前10天微生物氨化作用的抑制率范围为10%~40%,实验中后期微生物的氨化作用刺激率开始逐级增高,上升趋势明显。种植黑麦草后的土壤微生物的氨化强度比未种植的氨化强度高出了3.2倍。
(3)在黑麦草的整个生长周期中,其根系的体表特征发生了明显变化,根系在前10~25天受抗生素残留的影响,增长速度较慢,随着抗生素的降解,25~30天根系各方面指标的增长速度较快,30~40天趋于平稳。
