单羟基七元瓜环的固相微萃取纤维对环境水样中苯酚类物质的分析检测
2021-09-06王莎莎冉金凤
王莎莎, 李 霈, 冉金凤, 董 南*
(贵州大学 化学与化工学院,贵州 贵阳 550025)
苯酚类(Phenols)化合物是一类重要的化学工业原料,许多工业领域诸如煤气、焦化、医药、农药等工业排除的废水中均含有酚类化合物。因其生产和应用的广泛性已逐渐成为人类生存环境中普遍存在的污染物[1-3]。酚类物质进入环境后,直接影响了饮用水的质量,对水生物和人们的生命健康产生巨大的危害[4-5]。因为水体的稀释作用,苯酚类物质在水中的浓度很低,因此测定前需对样品进行富集、浓缩以提高仪器分析的灵敏度。液-液萃取、离子交换萃取、固相萃取(SPE)等是传统的样品处理方法,但大量使用有机溶剂和操作繁琐是其主要的缺点。固相微萃取(Soild phase microextraction, SPME)是一种新型微型化和绿色环保的样品前处理技术,于1989年由加拿大Waterloo大学Pawliszy教授课题组提出。这种方法具有样品用量少、操作简单、富集倍数高的特点,可以集成样品的吸附、解吸、进样于一体,不使用或使用很少的有机溶剂[6-7]。SPME有多种萃取形式包括管内固相微萃取、固相微萃取纤维和固相微萃取搅拌棒等。SPME对化合物的萃取主要依赖其涂层的物理化学性质(如溶剂稳定性和热稳定性)、萃取性能和涂层的厚度[8-9]。由于酚类化合物较强极性的特点,目前使用的一些商品涂层纤维如聚二甲基硅氧烷(PDMS) 和聚丙烯酸酯(PA)表现出对这类化合物选择性较差、热稳定性较低的缺点,因而报道开发了一些新的SPME纤维来萃取这类化合物。这些纤维涂层包括聚苯胺[10]、纳米羟基磷灰石[11]、金属有机框架[12]和碳纳米管等[13]。
瓜环是一类人工合成的新型大环化合物。亚甲基桥联不同数目的苷脲单元形成不同空腔大小的瓜环(Q[n],n=5~10)。瓜环的空腔是疏水的,与小分子可通过疏水作用发生包结作用。瓜环的端口由羰基氧原子构成呈负电性,可通过离子-偶极、氢键作用与极性分子发生主客体相互作用[14-15]。多种识别模式使瓜环表现出分子识别能力强的特点。
本团队曾报道将普通七元瓜环衍生化为单羟基七元瓜环后与端羟基聚二甲基硅氧烷(OH-PDMS)一起作为固定相,溶胶-凝胶法制备了基于单羟基七元瓜环的新型涂层,并将其应用于固相微萃取搅拌棒和毛细管气相色谱固定相[16-17]。实验结果表明该涂层的热稳定性好、应用对象广泛,可以萃取从非极性到极性的化合物。在本工作中,将此涂层制备成固相微萃取纤维形式并联用气相色谱,对环境水样中的5种酚类化合物同时进行了富集和检测,取得了满意的结果。
1 实验
1.1 仪器与试剂
DF-101S集热式恒温加热磁力搅拌器(郑州长城工贸有限公司),MODEL818精密酸度计(美国奥利龙公司),JY-B型快速涡旋混匀器(江苏姜堰市康健医疗器具厂),HP6820气相色谱仪(美国安捷伦公司),FFAP毛细管色谱柱(30 m×0.25 mm×0.25 µm)(中国科学院兰州化学研究所),商品PDMS萃取头(厚度100 μm)和PA 萃取头(厚度85 μm)购买于色谱科公司(美国)。
制备涂层的试剂包括三氟乙酸(TFA)、 γ-缩水甘油醚氧丙基三甲氧基硅烷(KH-560)、甲基三甲氧基硅烷(MTMOS)、端羟基聚二甲基硅氧烷(OH-PDMS)和含氢硅油(PMHS),购自阿拉丁试剂公司。其余试剂如丙酮、乙酸、氯化钠、二氯甲烷等为分析纯。去离子水由 Millipore公司超纯水器制得。对照品2-硝基苯酚、2,6-二甲基苯酚、苯酚、2,5-二甲基苯酚、4-乙基苯酚购自阿拉丁试剂公司,用甲醇配成浓度分别为1.0×10-4g/mL的混合储备液,于冰箱中4℃保存。
根据文献方法[17],实验室自制单羟基七元瓜环(Q[7]-OH)。
1.2 溶胶-凝胶涂层的制备
将20 mg Q[7]-OH和300 µL 98% TFA先后加入到7 mL聚乙烯离心管中混匀溶解,然后依次加入500 µL CH2Cl2、300 µL KH-560、300 µL OH-PDMS、30 µL MTMOS和 50 µL PMHS ,将溶液混匀后于12 000 r/min下离心5 min,取上层清液作为溶胶–凝胶涂层。溶胶-凝胶形成的过程可参考文献[17],涂层的可能结构如图1所示。在上述制备过程中不加入Q[7]-OH,其他过程相同就可得到空白溶胶-凝胶PDMS涂层。
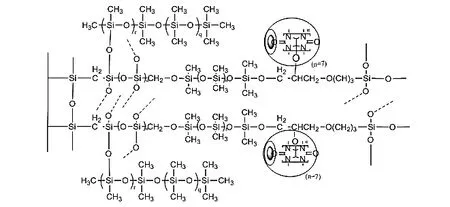
图1 涂层的可能结构
1.3 固相微萃取头装置的制备
取一根长度约为15 cm,直径约20 μm的石英纤维作为涂层载体。涂渍前对石英纤维进行预处理。将大约 2 cm的石英纤维浸泡在丙酮中 2 h以除去石英纤维表面的杂质。室温干燥后,将石英纤维浸泡在1 mol/L的NaOH溶液中1 h以对其表面进行羟基化处理。去离子水洗净后,再将其放入0.1 mol/L的HCl溶液中0.5 h以中和纤维表面残留的NaOH,最后用去离子水洗净、烘干备用。将已预处理好的石英纤维放入“1.2”项制备好的溶胶中浸泡20 min后,通过反复垂直提拉的次数来控制涂层的厚度。最后将涂渍好的石英纤维于室温下成胶24 h备用。
依次取下5 µL微量进样针针尖的套筒和推杆,先将上述涂渍好的石英纤维穿过密封垫,再将石英纤维和密封垫一起穿进套筒中,固定于微量进样器中后用环氧树脂将推杆和石英纤维粘合,得到如图2所示的固相微萃取头装置。将做好的萃取头在氮气保护下于GC进样口进行程序升温老化。依次分别在60、180、250℃下老化1 h,之后在300℃下老化0.5 h。实验之前,需要将老化好的萃取头置于气相色谱仪进样口解吸3 min以消除纤维涂层上的杂质。制备好的萃取头经电镜测量其涂层厚度大约为68 μm(如图2所示)。萃取头的涂层表面具有粗糙、多孔的特点,与本团队以前报道的结果一致,因此不做过多赘述。有关的表征如电镜、红外、热重等可参见文献[16-17]。
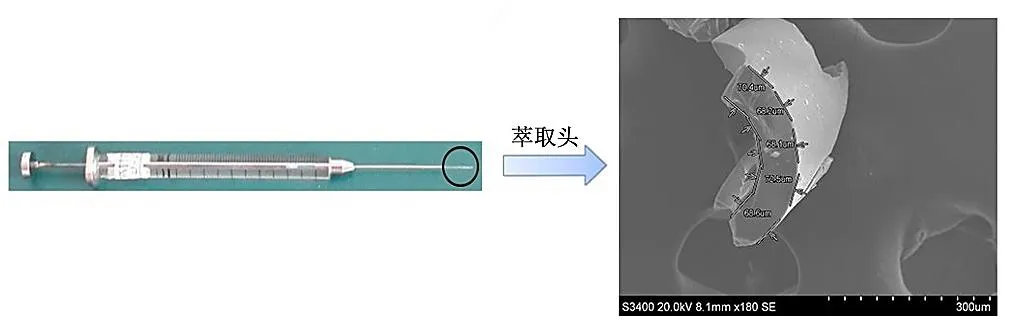
图2 自制固相微萃取头装置
1.4 SPME Fiber- GC实验方法
精密量取经0.45 µm 滤膜过滤后的水样样品8.0 mL置于10 mL带密封垫的样品瓶中,用盐酸调节溶液的pH为3.0,加入固体NaCl使溶液呈饱和状态。采用浸入式萃取方式:轻轻推出1 cm的萃取头,使之浸泡在待测溶液里,30℃下搅拌萃取50 min。萃取完成后,将萃取头收回套筒内,再插入气相色谱仪进样口中推出萃取头解吸3 min。为避免涂层上滞留的被分析物对下一次分析结果产生影响,在每次萃取开始前,萃取头应在气相色谱进样口解吸5 min后再使用。
1.5 气相色谱条件
采用FFAP毛细管柱(30 m×0.25 mm×0.25 µm)为色谱分离柱;程序升温过程:设置初始温度为100℃,保持该温度1 min,之后以10℃/min的速度升温到180℃,保持15 min,再以15℃/min的速度升温到220℃保持15 min。进样口温度为250℃;检测器温度为280℃;载气为高纯氮气(99.999%);不分流进样;流速为2.0 mL/min;检测器为氢火焰离子检测器(FID)。
2 结果与讨论
2.1 萃取条件的优化
用自制的PDMS/Q[7]-OH固相微萃取纤维考察萃取温度、pH值、盐离子浓度、萃取时间、解吸时间等因素对5种苯酚类化合物萃取效率的影响,确定最佳萃取条件。
2.1.1萃取温度
萃取温度对固相微萃取具有较大的影响。温度升高可加快传质速度,缩短分析物在涂层上达到平衡所需要的时间,但是过高的温度会减小被分析物在涂层上的分配系数导致萃取效率降低[18]。采用自制的PDMS/Q[7]-OH固相微萃取头,分别在20、30、40、50、60、70℃下进行浸入式萃取,经气相色谱仪分析后得到各萃取温度与5种苯酚类化合物峰面积的关系。从图3a可以看出,在30℃时,5种苯酚类化合物的萃取效率均为最佳,故选30℃为实验萃取温度。
2.1.2 萃取溶液的pH值
酸性或碱性化合物在溶液中的存在形式受溶液pH值的影响很大。一般中性存在形式更利于涂层的萃取。酚类化合物是酸性物质,在酸性条件下以分子形式存在有利于萃取。从图3b可以看出,5种苯酚类化合物在pH为3时,萃取效率均为最佳,故选择pH为3作为最佳萃取pH值。
2.1.3 盐离子浓度
盐效应可通过增加溶液中离子强度的方式降低有机物在水中的溶解度,使待测物以分子形式析出,有利于在涂层上的吸附。从图3c可以看出,随着加入盐离子浓度的增大,5个酚类化合物的萃取效率在提高。盐离子浓度为0.3 g/mL时几乎已达到其饱和浓度,因此采用饱和氯化钠作为盐离子浓度。
2.1.4 萃取时间
萃取时间越长,待测物在纤维涂层上吸附的量越多,最后吸附达到平衡,萃取量不再增加。从图3d可以看出,当萃取时间为50 min时达到最大吸附量,所以选择50 min为最佳萃取时间。
2.1.5 解吸时间
一般来说,解吸时间越长,目标物解吸越彻底,但解吸时间过长会损害涂层,影响纤维的使用寿命。从图3e可以看出,解吸时间为3 min时就可获得最好的萃取效率,因此选择3 min为最佳解析时间。
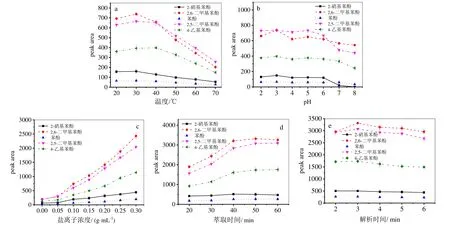
图3 PDMS/Q[7]-OH涂层的萃取纤维对酚类化合物萃取条件的优化
2.2 自制PDMS/Q[7]-OH萃取头与商品萃取头的萃取性能比较
将自制的PDMS/Q[7]-OH萃取头与非极性的商品PDMS萃取头、极性的PA萃取头以及自制空白溶胶-凝胶PDMS 萃取头对水样中苯酚类化合物的萃取效果进行了比较,结果见图4。从图4可以看出,四种萃取头对酚类化合物的萃取效率依次为:PDMS/Q[7]-OH>商品PA>溶胶-凝胶PDMS>商品PDMS。商品PDMS萃取效率最低与 PDMS涂层是非极性而酚类化合物是强极性有关。空白溶胶-凝胶 PDMS比商品PDMS萃取效率好是因为溶胶-凝胶制备方法使得涂层具有三维网状结构,萃取面积增大,吸附位点多,从而萃取效率得到提高[19]。商品PA因其涂层极性与酚类化合物相近因而具有较好的萃取效率。PDMS/Q[7]-OH的萃取效率最好是因为Q[7]对苯酚类化合物具有良好的分子识别作用[20],它可提高涂层对目标化合物的选择性,另外涂层三维网状结构的优势也提高了涂层的萃取效率,这两方面共同作用的结果使得自制PDMS/Q[7]-OH萃取头的萃取性能最好。
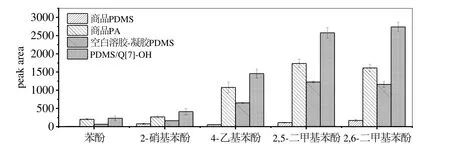
图4 PDMS/Q[7]-OH萃取头与商品萃取头对苯酚类化合物萃取性能的比较(c=500 μg/L)
2.3 PDMS/Q[7]-OH SMP fiber- GC-FID分析方法的方法学验证
精密量取相同体积不同浓度的混合标准溶液分别加入到8 mL水样中配成一系列浓度的加标溶液,按照“1.4”和“1.5”项下的方法进行处理并测定。以峰高值Y对质量浓度(X,μg/L)进行线性回归,五个酚类化合物的线性范围、相关系数、检出限、定量限、富集倍数和日内、日间精密度总结于表1。
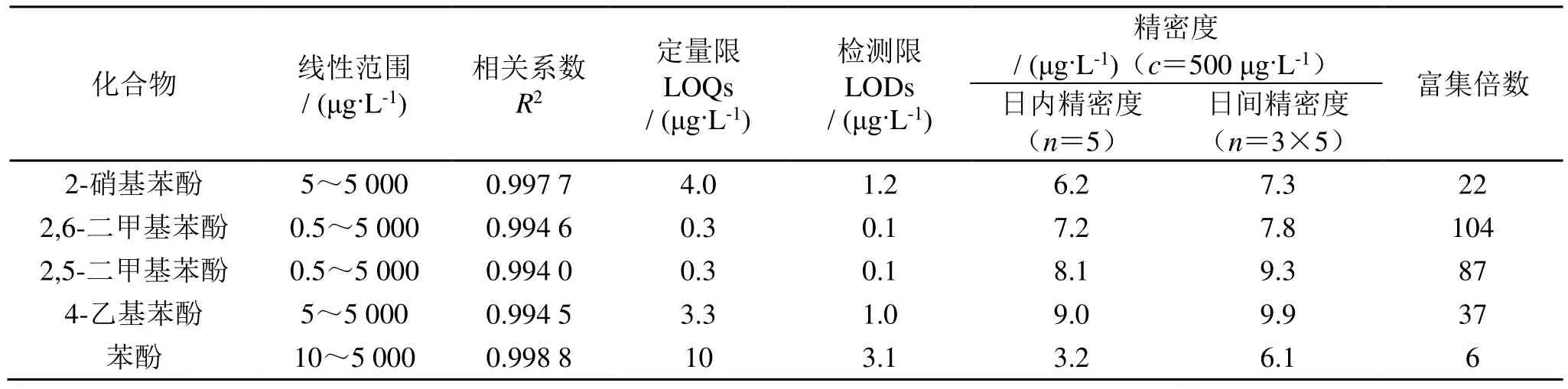
表1 五个酚类化合物的线性范围,相关系数,检测限,精密度和富集倍数
检出限(LOD)、定量限(LOQ)分别按照公式LOD=3S0/S和 LOQ=10S0/S进行计算,其中S0为10次空白试剂所测值的标准偏差,S为分析校准曲线的斜率。富集倍数(EF)由富集后的浓度与富集前的浓度之比得到。从表1可看出,本法的线性范围在0.5~5 000 μg/L,检测限在0.1~3.1 μg/L之间,日内日间精密度的RSD≤9.9, 说明该法具有较宽的线性范围、良好的灵敏度以及重现性。本法对五个酚类化合物的富集倍数为6~104倍,差别较大。2,6-二甲基苯酚和2,5-二甲基苯酚的富集倍数最高,4-乙基苯酚次之,2-硝基苯酚较低,苯酚最低。这是因为涂层的萃取量是一定的,在萃取时,5个酚类化合物之间必然存在着对涂层的竞争吸附作用。与涂层作用能力越强,该化合物被涂层吸附得也越多。2,6-二甲基苯酚、2,5-二甲基苯酚和 4-乙基苯酚都带有疏水性的烷基基团,它们增加了整个分子的疏水性,从而提高了与 Q[7]的空腔疏水作用[20],导致与涂层的作用增强,富集倍数提高。2-硝基苯酚上的强电负性基团硝基增强了与涂层三维网状结构上吸附位点的氢键相互作用,因而比苯酚与涂层的作用能力强,富集倍数高。
2.4 实际样品分析
采取当地花溪河水的水样利用本法进行了检测,没有发现目标化合物。向水样中分别加入高、中和低3种浓度的标准品混合溶液,测定结果如表2,相关的色谱图如图5所示。3个加标浓度的平均相对回收率在 70.1%~113.7%之间,RSD在1.1%~8.9%之间,说明所建立方法的准确度和精密度良好,可用于实际水样中痕量酚类物质的测定。
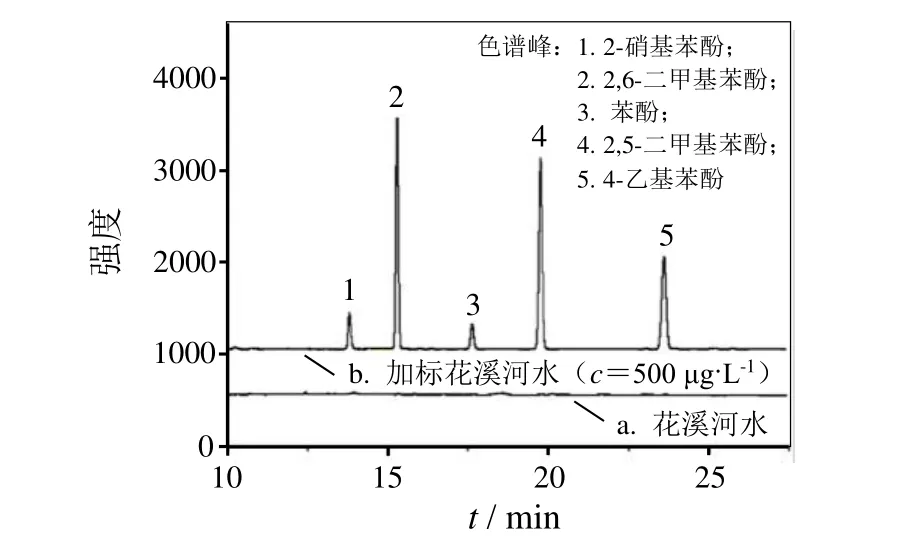
图5 PDMS/Q[7]-OH SPME纤维萃取酚类化合物的HPLC-UV色谱图
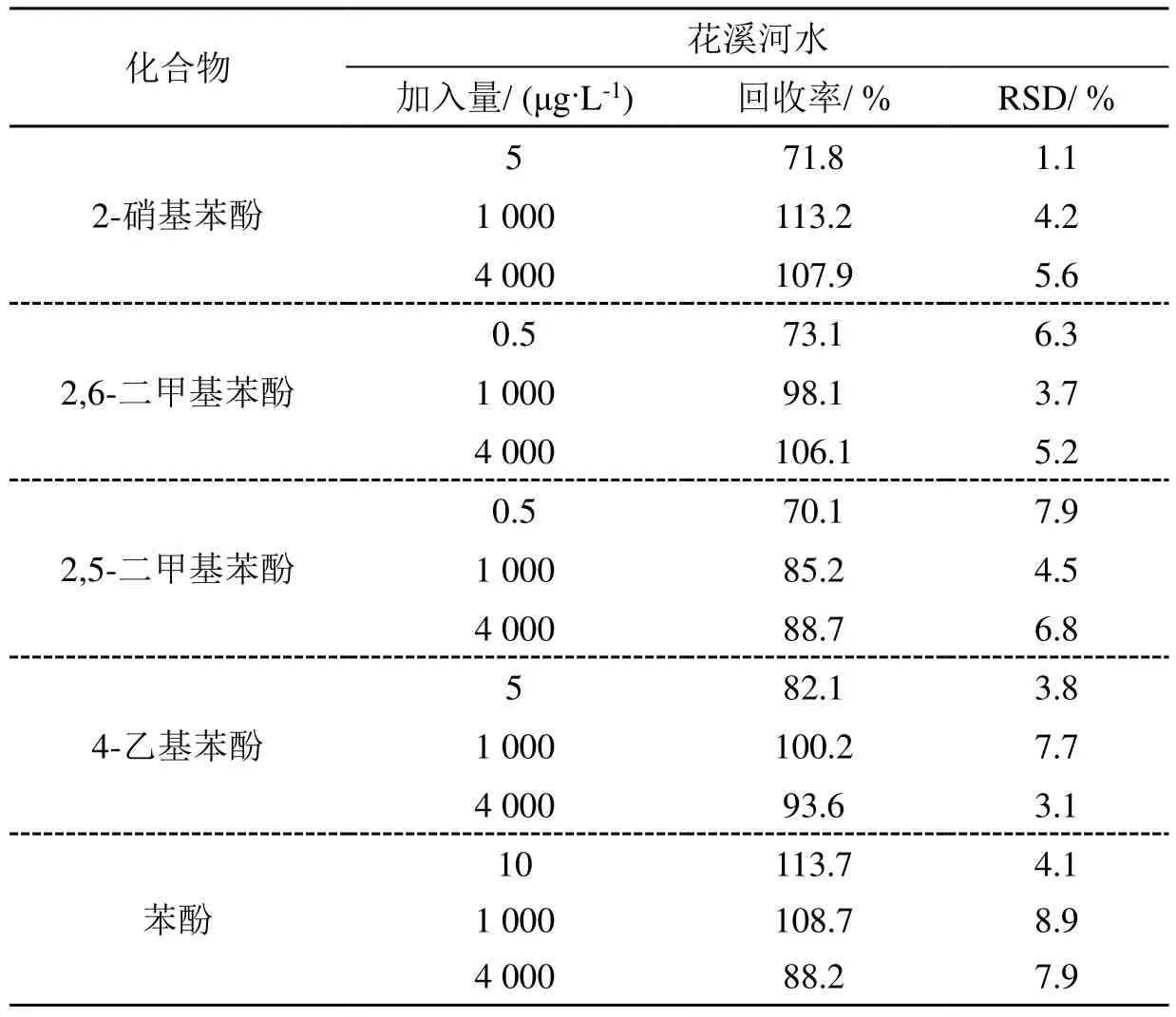
表2 花溪河水样品的分析测定结果(n=3)
2.5 本方法与其他分析方法的比较
将本方法与文献报道具有不同涂层的SPME处理环境水样中酚类并进行检测的方法进行了比较,结果如表3所示。从表3可看出,本方法与文献报道的方法相比具有相当或更好的灵敏度和重现性,同时具备较宽的线性范围,说明自制PDMS/Q[7]-OH涂层选择性好,萃取性能高,能较好地提高仪器测定的灵敏度。

表3 本法与其他分析方法的比较
3 结论
使用自制的PDMS/Q[7]-OH固相微萃取纤维,建立了SPME fiber-GC-FID分析测定水样中5种酚类化合物的方法。方法的线性范围宽、检出限低(0.1~3.1 μg/L)、重复性好(RSD小于9.9%)、回收率高(70.1%~113.7%),满足水样中痕量酚类物质的检测要求。
