小菜蛾活化蛋白激酶C受体1基因PxyRACK1在变态发育调控中的作用
2021-09-06胡晓汉田素芬陈艺欣顾晓军黄劲飞
胡晓汉, 田素芬, 林 硕, 陈艺欣, 魏 辉, 顾晓军,*, 黄劲飞,*
(1.福建农林大学植物保护学院, 福州 350002; 2. 福建省农业科学研究院, 福建省作物有害生物监测与治理重点实验室,福州 350013; 3. 福建省农业科学研究院, 农业农村部福州作物有害生物科学观测试验站, 福州 350013)
活化蛋白激酶C受体1(receptor for activated C kinase 1, RACK1)是一种胞浆内游离的WD-重复蛋白(WD-repeat protein),广泛存在于各类原核生物和真核生物中(段红英等, 2007; Adamsetal., 2011)。WD-重复蛋白通常由4~10个重复的WD基元组成,WD基元得名于其C端含有色氨酸-天冬氨酸(WD)保守序列(Huetal., 2017)。在生物体内,WD-重复蛋白具有组装细胞骨架、转运蛋白质、运输囊泡、调控细胞周期等功能(Huetal., 2017)。
RACK1作为支架型蛋白,在生物体中参与了多种信号通路(代静等, 2017)。在昆虫中也是如此,如在黑腹果蝇Drosophilamelanogaster中,RACK1作为折叠蛋白参与了自噬体的形成(Érdietal., 2012),并在p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)/RACK1通路中调节蛋白质平衡从而影响细胞衰老和肌肉应激反应等(Belozerovetal., 2014)。近年来,RACK1在调控昆虫生长发育方面的功能越来越受到关注。在果蝇(Kadrmasetal., 2007; Wangetal., 2012)、棉铃虫Helicoverpaarmigera(侯元春等, 2012)、云杉卷叶蛾Choristoneurafumiferana(Quanetal., 2006)中均发现RACK1能够响应蜕皮激素(20-hydroxyecdysone, 20E)的诱导,参与蛋白磷酸化并激活下游转录因子。此外,RACK1还能与家蚕Bombyxmori蛹期特异因子Broad Complex(Br)相互作用(王永虎, 2013; Chengetal., 2014)。
BroadComplex(Br)是全变态昆虫蛹期蜕皮激素20E通路的初级响应基因,对成功化蛹具有关键作用(Chengetal., 2014)。小菜蛾Plutellaxylostella中发现了Br-Z2/3(PxyBr-Z2/3)和Br-Z7(PxyBr-Z7)两种异构体,其中PxyBr-Z2/3是小菜蛾化蛹变态的主要调控基因(Huangetal., 2019; 胡晓汉等, 2021)。目前,RACK1在小菜蛾蛹期发育的功能及其对PxyBr-Z2/3的调控机制尚未见报道。本研究基于小菜蛾基因组信息(Youetal., 2013),克隆并测序了小菜蛾RACK1基因PxyRACK1完整开放阅读框,测定了PxyRACK1在不同发育阶段的表达动态,构建了PxyRACK1的dsRNA原核表达体系,并利用显微注射法探究了该基因的沉默对PxyBr-Z2/3基因表达及试虫化蛹的影响,以期为完整理解昆虫RACK1的功能及Br表达的影响因素提供资料,进而为新型昆虫生长调节剂的开发提供思路。
1 材料与方法
1.1 供试虫源
供试虫源为本实验室长期室内饲养的小菜蛾敏感种群,具体饲养方法参考韩艺欣等(2019):幼虫寄主植物为萝卜苗;幼虫化蛹后,收集蛹置于养虫笼中待羽化;成虫羽化后以10%(w/v)蜜糖水补充营养;取鲜嫩萝卜苗(6 cm长)榨汁后,均匀涂于铝箔锡纸(10 cm×10 cm)(购自郑州鸿富源工贸有限公司)供成虫产卵。饲养温度为25±1℃,相对湿度为70%±5%,光周期为14L∶10D。
1.2 小菜蛾RACK1基因全长克隆
参考天根生化科技(北京)有限公司总RNA提取试剂盒说明书提取供试小菜蛾的总RNA,参考Clontech公司SMART RACE cDNA Amplification Kit试剂盒说明书,合成5′RACE-ready和3′RACE-ready cDNA第1链。RACE扩增采用Nested-RACE方法,以5′/3′ RACE-ready cDNA为模板,由NCBI登录的RACK1基因(GenBank登录号: NP_001292436.1)设计特异引物,使用特异性引物和通用引物(UPM Mix和NUP)进行PCR扩增,引物序列见表1。反应体系(20 μL): cDNA(约1 000 ng/μL)1 μL, 正反向引物终浓度为10 μmol/L, dNTPs终浓度为0.25 μmol/L, Taq DNA Polymerase 2.5 U, 10×PCR Buffer(含2.5 mmol/L MgCl2) 2 μL。PCR反应条件: 94℃ 2 min; 98℃ 10 s, 60℃ 1 min, 68℃ 2 min, 35个循环;最后68℃ 10 min。扩增产物经琼脂糖凝胶DNA回收试剂盒[天根生化科技(北京)有限公司]回收并纯化目的条带,连接到pEAST-blunt质粒,转化挑取阳性克隆,送样上海生工进行测序。
1.3 生物信息学分析
测序后用DNAMAN软件拼接核苷酸序列,获得RACK1的基因序列全长,并上传至NCBI的GenBank数据库。登录NCBI网站(http:∥www.ncbi.nlm.nih.gov),采用Blast程序与GenBank公布的生物序列进行比较,并根据氨基酸序列分析其保守区域。同时,利用Lasergene软件中的MegAlign程序以及MEGA 7.0软件,与已知RACK1氨基酸序列进行Cluster W法比对,邻接法(neighbor-joining, NJ)构建系统发育树。
1.4 小菜蛾RACK1基因表达动态测定
收集小菜蛾卵和1龄幼虫各100 mg,2龄幼虫20头,3龄第1-2天幼虫、4龄第1-4天幼虫、预蛹、1-4日龄蛹和成虫各5头,每龄期样品重复收集3次,分别提取总RNA。利用全式金生物技术有限公司的反转录试剂盒利用检测合格的小菜蛾总RNA合成cDNA第1链。根据1.2节中克隆的序列分别设计特异性引物RACK1-QF/RACK1-QR(表1),并选择小菜蛾看家基因EF-1α为参照基因进行qPCR反应,内参基因定量引物参考符伟等(2012)(表1)。qPCR反应参考NovoStart® SYBR qPCR SuperMix Plus (近岸蛋白质科技有限公司)的说明书,反应体系(20 μL): cDNA(约1 000 ng/μL)1 μL, 正反向引物(10 μmol/L)各 0.4 μL, 2×TransStart Top Green qPCR SuperMix 10 μL, ddH2O 8.2 μL。反应程序: 95℃ 3 min; 95℃ 6 s, 60℃ 30 s, 40个循环。每样品重复测定3次,记录相关数据。
1.5 dsRNA合成
根据1.2节中克隆的小菜蛾PxyRACK1基因序列(GenBank登录号: MW160739),并以pIZT/v5-his载体中GFP基因序列为阴性对照,利用Primer Premier 5.0软件设计PxyRACK1 dsRNA扩增引物RACK1-dsRNA-F/RACK1-dsRNA-R(5′端加上SacⅠ和KpnⅠ酶切位点)和GFPdsRNA扩增引物GFP-dsRNA-F/GFP-dsRNA-R(5′端加上SacⅠ和SalⅠ酶切位点)(表1),引物由福州尚亚生物技术有限公司合成。
分别以预蛹期小菜蛾cDNA和pIZT/v5-his质粒为模板,使用采购自南京诺唯赞公司的Phanta Max Super-Fidelity DNA Polymerase进行PCR反应。混匀各组分并短暂离心后,进行PCR反应: 95℃ 3 min; 95℃ 15 s, 59℃ 15 s, 72 ℃ 30 s, 35个循环;72℃最后延伸5 min。利用琼脂糖凝胶DNA回收试剂盒[天根生化科技(北京)有限公司]回收并纯化PCR产物后,取4 μL连接pEASY-Blunt Cloning载体以构建pEASY-Blunt-PxyRACK1与pEASY-Blunt-GFP质粒。
使用内切酶SacⅠ和KpnⅠ双酶切构建好的pEASY-Blunt-PxyRACK1质粒和L4440空载体(由福建农林大学应用生态研究所馈赠)及使用内切酶SacⅠ和SalⅠ双酶切 pEASY-Blunt-GFP质粒及L4440空载体(酶切时间均为1 h)。酶切后将PxyRACK1和GFP片段分别与L4440载体片段用T4连接酶过夜连接。连接产物再转化至大肠杆菌EscherichiacoliHT115感受态细胞诱导表达dsRNA,并将所表达的dsRNA纯化,表达与纯化方法参考王雪庆等(2018)。
1.6 RNA干扰实验
挑取相同日龄、体型一致的4龄第2天小菜蛾幼虫用于RNA干扰实验,形态鉴定参考陈艺欣等(2011)。其中dsPxyRACK1处理组与dsGFP对照组各设置6个重复,每个重复10头试虫放入直径15 cm玻璃培养皿中,注射剂量为100 nL(约1 000 ng/μL)。注射dsRNA 24 h 后,处理组与对照组各随机选取5头试虫并重复3次,提取总RNA,反转录成cDNA;利用Primer Premier 5.0软件设计引物Br-Z2/3-QF/Br-Z2/3-QR(表1),以EF-1α为内参基因,利用qPCR检测PxyRACK1和PxyBr-Z2/3的表达。qPCR反应体系参照1.4节。反应程序: 94℃ 2 min; 94℃ 5 s, 60℃ 30 s, 40个循环。每样品重复测定3次。
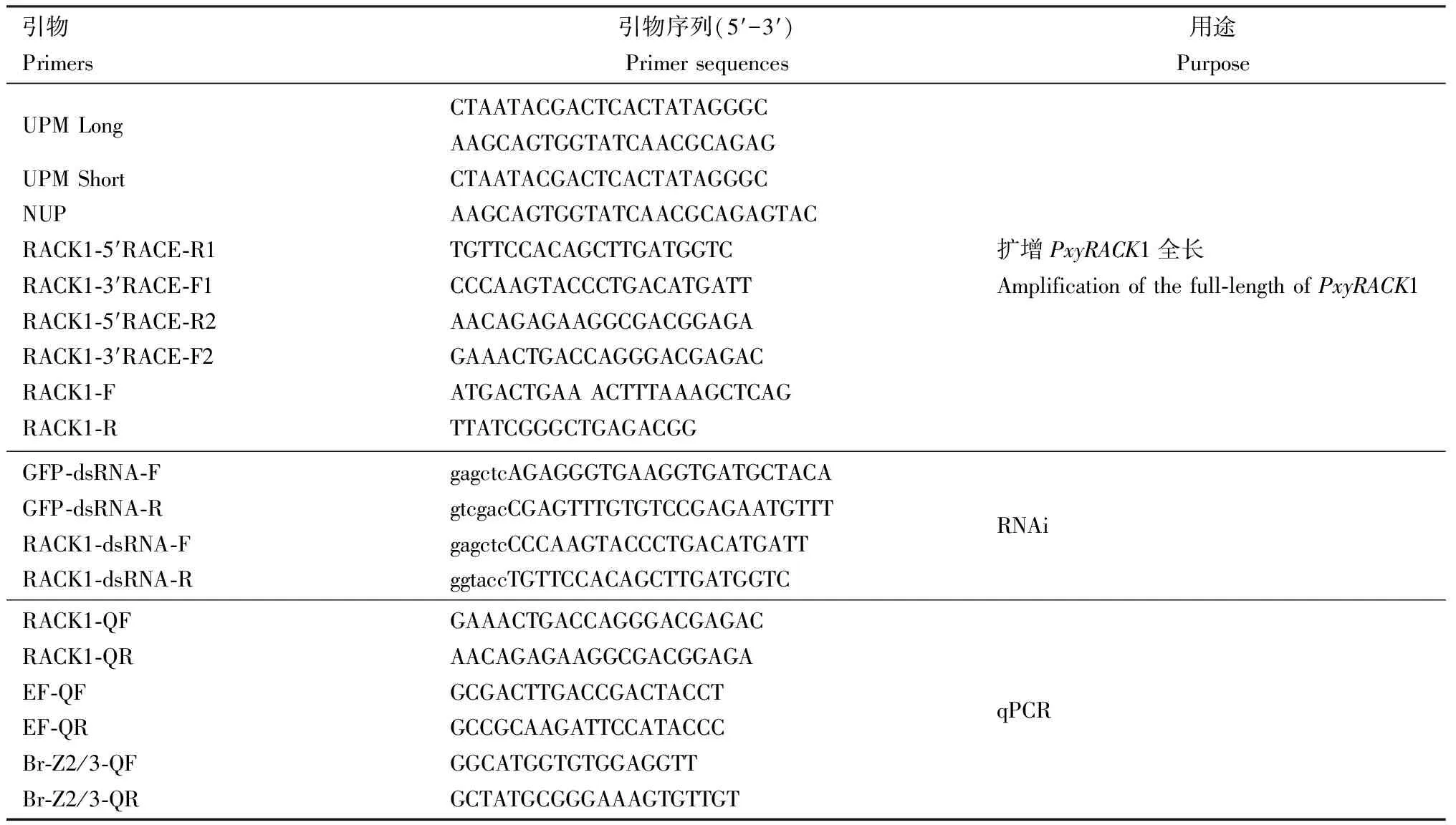
表1 本研究所用引物Table 1 Primers used in this study
1.7 RNAi的生物学效应观测
RNAi后,处理组和阴性对照组各取3个重复用于小菜蛾生物学观测,每8 h观察记录试虫死亡数和化蛹数,计算死亡率、化蛹率和平均化蛹时间。 待小菜蛾化蛹后称取蛹重。 死亡率=(死亡虫数/总试虫数)×100%;化蛹率=(化蛹数/总试虫数)×100%。
1.8 数据分析
基因相对表达量的计算采用2-ΔΔCt法(Livak and Schmittgen, 2001)。利用统计学软件SPSS 22.0对基因表达动态进行单因素方差分析(ANOVA),并用Tukey氏检验检验基因相对表达量差异显著性。RNAi的生物学效应观测实验中,采用独立样本T检验检测RNAi效果。差异显著性水平均设定为P<0.05。
2 结果
2.1 PxyRACK1的克隆和序列
凝胶电泳检测发现5′端片段条带约为5 00 bp(图1: A),3′端片段条带约为1 100 bp(图1: B),而中间片段PCR扩增获得大小约为1 000 bp的单一条带(图1: C)。上述电泳条带经回收纯化并测序后,拼接得到1 148 bp基因片段。将测序的结果与已登录的小菜蛾RACK1基因(GenBank登录号: NP_001292436.1)比对,结果显示克隆基因序列全长与目的基因序列一致性为98.40%,而其推导氨基酸序列一致性为100%,表明成功克隆小菜蛾PxyRACK1基因序列全长(GenBank登录号: MW160739),ORF长960 bp,5′端非编码区长63 bp,3′端非编码区长125 bp。编码区共编码319个氨基酸,预测蛋白大小为35.88 kD,等电点为7.677。预测的氨基酸序列中含有7个WD40重复序列,每个WD40重复序列含39~42个氨基酸(图2)。
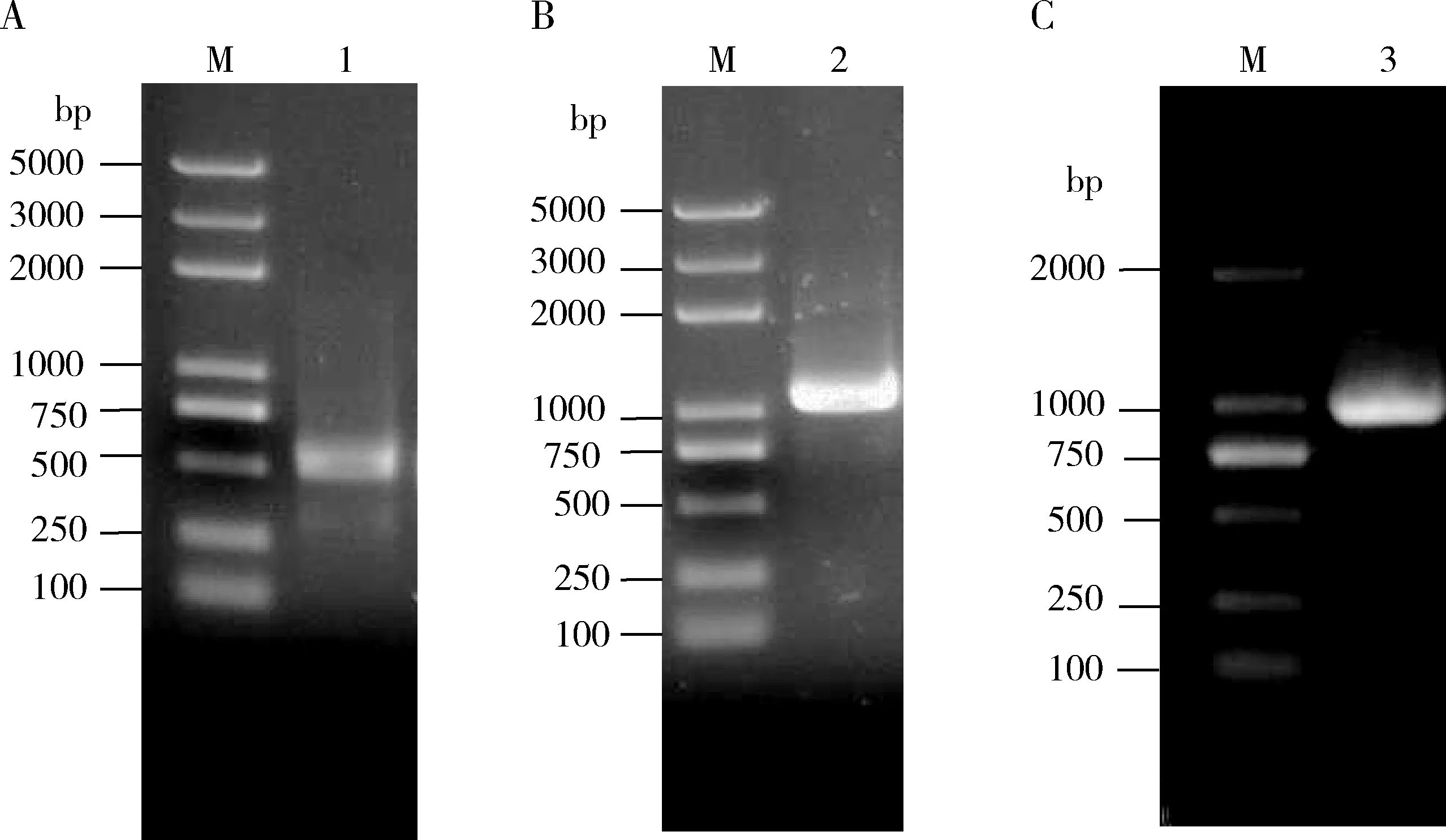
图1 小菜蛾PxyRACK1的全长cDNA扩增Fig. 1 Full-length cDNA amplification of PxyRACK1 of Plutella xylostellaM: 2000 DNA分子标准量 2k Plus DNA Marker; A: PxyRACK1的5′端片段的扩增Amplification of the 5′end of PxyRACK1; B: PxyRACK1的3′端片段的扩增Amplification of the 3′end of PxyRACK1; C: PxyRACK1基因编码区的扩增Amplification of the encoding region of PxyRACK1. 1: PxyRACK1的5′端片段的扩增产物Amplification product of the 5′end of PxyRACK1; 2: PxyRACK1的3′端片段的扩增产物Amplification product of the 3′end of PxyRACK1; 3: PxyRACK1基因编码区的扩增产物Amplification product of the encoding region of PxyRACK1.

图2 小菜蛾PxyRACK1的核苷酸序列和推导的氨基酸序列Fig. 2 Nucleotide and deduced amino acid sequences of PxyRACK1 of Plutella xylostella图中阴影标示GH-WD基元,下划线部分为7个WD40重复序列。The conserved GH-WD residues are marked in shade. Underlined amino acids are seven WD40 repeats.
2.2 小菜蛾PxyRACK1的同源比对和系统进化分析
比较分析不同生物的RACK1氨基酸序列发现,小菜蛾PxyRACK1与其他物种的同源蛋白具有高度相似性,且所有物种的7个WD40重复序列的同源性均极高(图3)。小菜蛾PxyRACK1氨基酸序列与同为鳞翅目昆虫的甜菜夜蛾Spodopteraexigua、烟芽夜蛾Heliothisvirescens、棉铃虫Helicoverpaarmigera的RACK1序列一致性分别为98.70%, 98.10%和 98.10%,与同为昆虫纲但不同目的德国小蠊Blattellagermanica和黑腹果蝇Drosophilamelanogaster的RACK1序列一致性较低,分别为92.70%和86.80%, 而与亲缘关系较远的智人Homosapiens的RACK1序列一致性也达到78.20%(数据未显示)。基于氨基酸序列邻接法建立的系统发育树见图4,结果表明,鳞翅目昆虫的RACK1蛋白首先聚在一起,尽管RACK1蛋白在不同目昆虫之间存在一定差异,但总体而言昆虫RACK1蛋白进化较为保守。
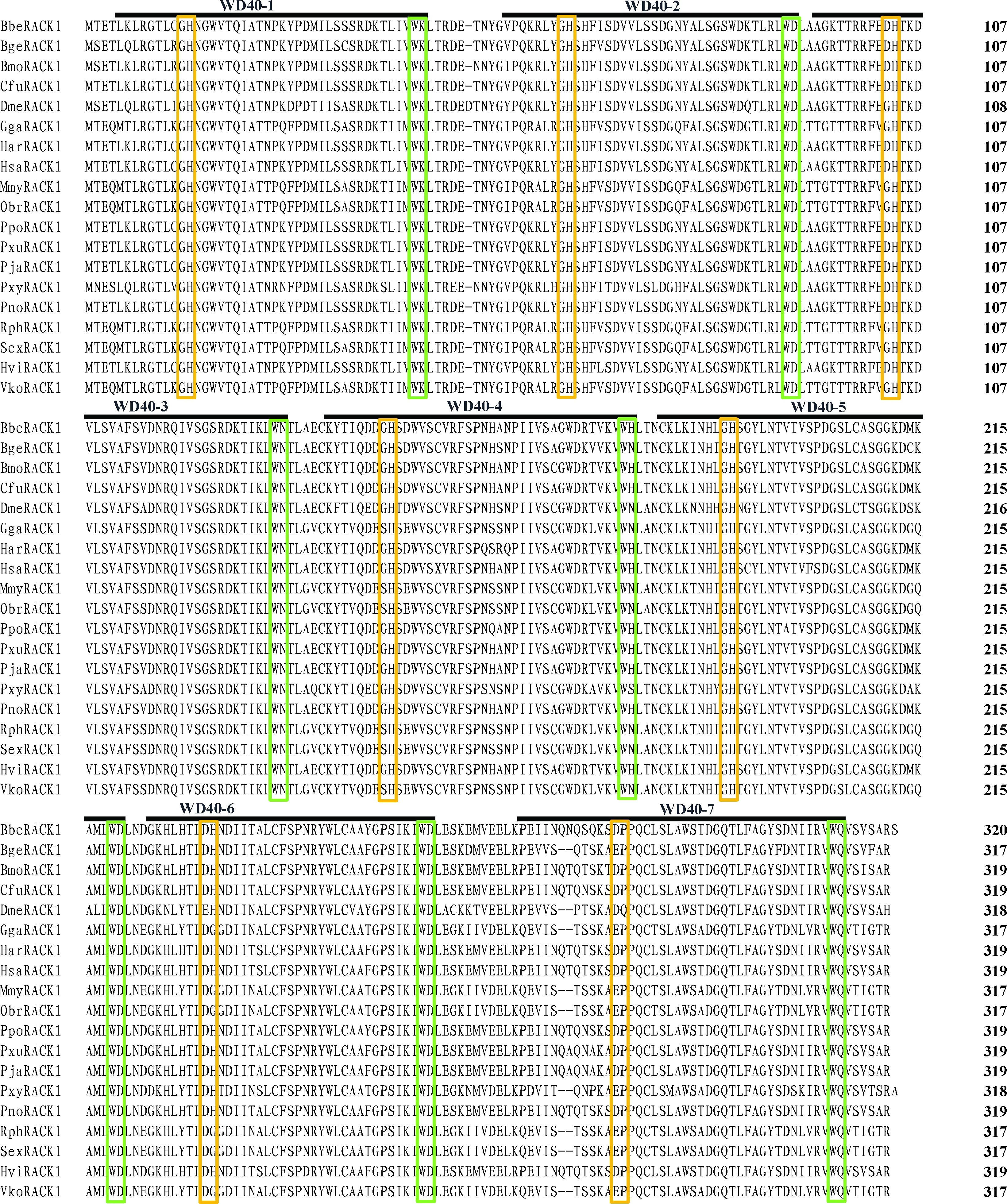
图3 小菜蛾与其他物种RACK1蛋白的WD40重复序列比对Fig. 3 Sequence alignment of WD40 repeats of RACK1 proteins from Plutella xylostella and other speciesRACK1蛋白来源物种及GenBank登录号Origin species and GenBank accession numbers of RACK1 proteins: Bbe: 白桦尺蛾Biston betularia (ADO33039.1); Bge: 德国小蠊Blattella germanica (ABI63548.1); Bmo: 家蚕Bombyx mori (NP_001041703.1); Cfu: 云杉色卷蛾Choristoneura fumiferana (AAZ29605.1); Dme: 黑腹果蝇Drosophila melanogaster (NP_001260218.1); Gga: 原鸡Gallus gallus (NP_001004378.1); Har: 棉铃虫Helicoverpa armigera (AEI84399.1); Hsa: 智人Homo sapiens (NP_006089.1); Mmy: 大鼠耳蝠Myotis myotis (KAF6349892.1); Obr: 冬尺蠖蛾Operophtera brumata (KOB78365.1); Ppo: 玉带凤蝶Papilio polytes (BAM18977.1); Pxu: 柑橘凤蝶Papilio xuthus (BAM17717.1); Pja: 日本对虾Penaeus japonicus (AHF21001.1); Pxy: 小菜蛾Plutella xylostella (NP_001292436.1); Rno: 褐家鼠Rattus norvegicus (NP_570090.2); Rph: 菲律宾帘蛤Ruditapes philippinarum (AWV55265.1); Sex: 甜菜夜蛾Spodoptera exigua (ABX55886.1); Hvi: 烟芽夜蛾Heliothis virescens (AAK51552.1); Vko: 科莫多巨蜥Varanus komodoensis (KAF7250119.1).
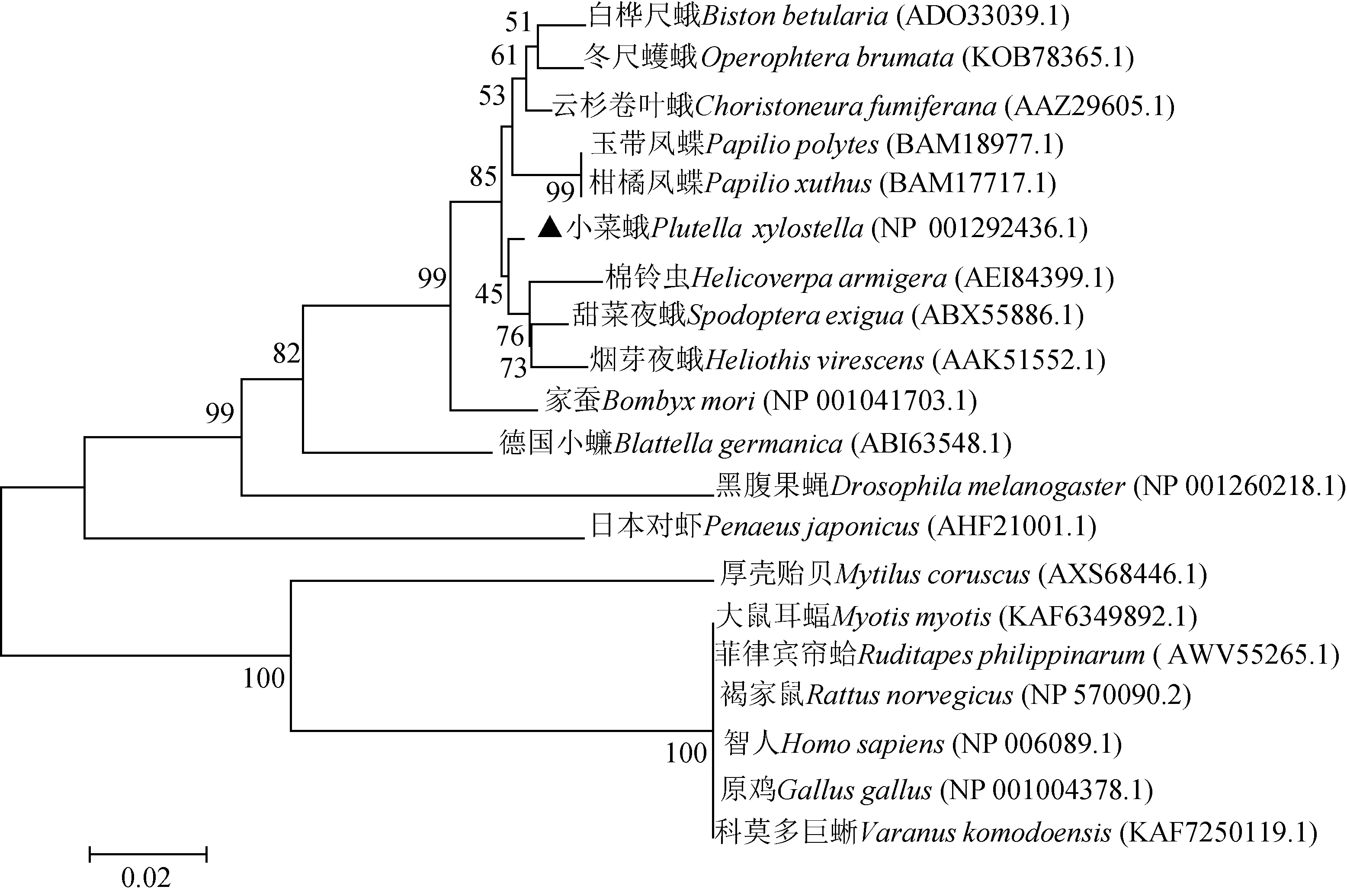
图4 邻接法构建的基于氨基酸序列的小菜蛾与其他物种的RACK1系统进化树(1 000次重复)Fig. 4 Phylogenetic tree of RACK1 of Plutella xylostella and other species constructed with neighbor-joining methodbased on the amino acid sequence (1 000 replicates)
2.3 小菜蛾PxyRACK1的表达动态
qPCR结果表明,PxyRACK1在小菜蛾各个生长发育阶段均可表达。以卵期表达量为参比,4龄第2天幼虫中的相对表达量最高(相对表达量1.32),2日龄蛹中的相对表达量最低(相对表达量0.87),但二者也仅相差1.5倍左右(P<0.05);而4龄第4天幼虫(相对表达量0.96)、预蛹(相对表达量1.00)和4日龄蛹(相对表达量0.99)中的表达量则与卵期表达量相近(图5)。
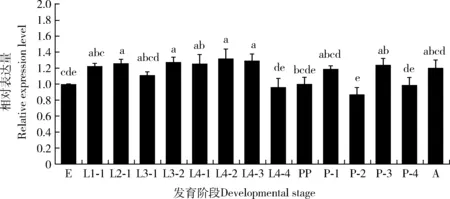
图5 PxyRACK1在小菜蛾不同发育阶段的表达谱Fig. 5 Expression profiles of PxyRACK1 at different developmental stages of Plutella xylostellaE: 卵Egg; L1-1: 1龄第1天幼虫Day-1 1st instar larva; L2-1: 2龄第1天幼虫 Day-1 2nd instar larva; L3-1-2: 分别为3龄第1-2天幼虫 Day-1-2 3rd instar larvae, respectively; L4-1-4: 分别为4龄第1-4天幼虫 Day-1-4 4th instar larvae, respectively; PP: 预蛹Prepupa; P-1-4: 分别为1-4日龄蛹1-4 d-old pupae, respectively; A: 成虫Adult. 图中数据为平均值±标准误;柱上不同字母表示基因表达量在不同发育阶段之间差异显著(P<0.05, Tukey氏检验)。Data in the figure are mean±SE. Different letters above bars indicate significant differences in the gene expression level among different developmental stages (P<0.05, Tukey’s test).
2.4 RNAi后PxyRACK1的表达量变化
注射dsPxyRACK1 24 h后,小菜蛾4龄幼虫中PxyRACK1表达量显著下降了36.26%(P<0.05)(图6: A),而PxyBr-Z2/3表达量下降了83.46%(P<0.05)(图6: B)。
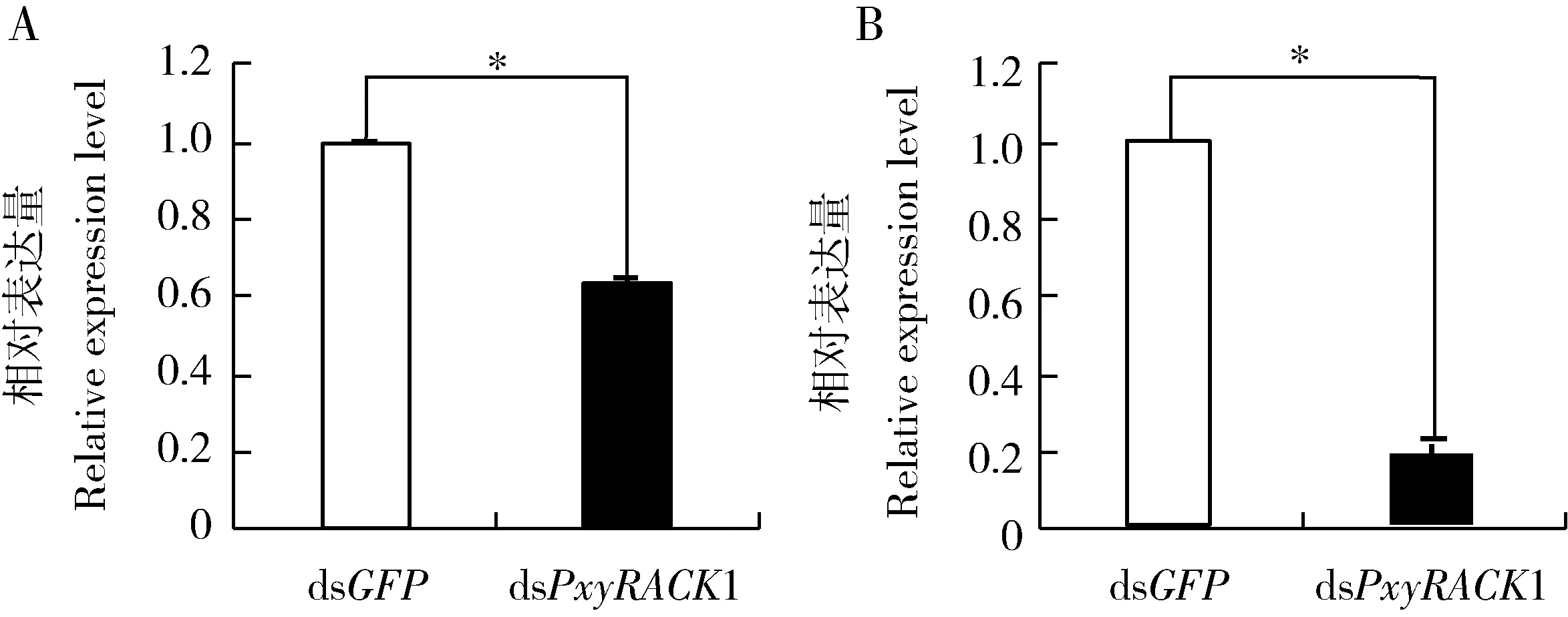
图6 RNAi干扰PxyRACK1 24 h后小菜蛾4龄幼虫中PxyRACK1(A)和PxyBr-Z2/3(B)的表达量Fig. 6 Expression levels of PxyRACK1 (A) and PxyBr-Z2/3 (B) in the 4th instar larvaeof Plutella xylostella at 24 h after RNAi of PxyRACK1图中数据为平均值±标准误;柱上星号表示处理组与对照组(dsGFP注射组)之间差异显著(P<0.05, 独立样本T检验)。Data in the figure are mean±SE. Asterisk above bars indicates significant difference between the treatment group and the control group (dsGFP injected group) (P<0.05, independent samples T-test). 下同The same below.
PxyRACK1基因沉默后部分试虫停止取食,处理48 h后虫体逐渐变黑(图7),最终死亡。处理组化蛹高峰期推迟(图8: A),处理后64 h后处理组试虫死亡率达到最高并稳定为46.66%,而注射GFPdsRNA的对照组试虫死亡率仅为6.67%(P<0.05) (图8: B)。同时,64 h后对照组试虫平均化蛹率为93.33%,而处理组仅为43.33%(P<0.05) (图8: C);对照组平均化蛹时间为40.36 h,处理组则延长至47.07 h(P<0.05)(图8: D);72 h后统计处理组和对照组平均蛹重,分别为4.727和5.327 mg(P<0.05)(图8: E)。

图7 分别注射dsGFP(A)和dsPxyRACK1(B)48 h后的小菜蛾4龄幼虫Fig. 7 The 4th instar larvae of Plutella xylostellaat 48 h after injection of dsGFP (A) anddsPxyRACK1 (B), respectively
3 讨论
RACK1结构的最大特点是含有7个由40个氨基酸残基组成的WD40重复序列(WD1-WD7)基元,且多数基元的N端有一个甘基酸-组氨酸(GH)结构,而C端有一个色氨酸-天冬氨酸(WD)结构(段红英等, 2007)。PxyRACK1的编码区中也存在7个WD40重复序列,并且每个WD40重复序列均与其他物种的WD40重复序列高度相似(图3),证明了本研究所克隆的PxyRACK1编码区的可靠性。重复的WD基元是RACK1与其他互作蛋白形成同源或异源二聚体的关键位点(Sklanetal., 2006)。RACK1正是通过其不同的 WD40位点与活化的蛋白激酶C(protein kinase C, PKC)结合后将其转运到细胞内相应位置,进而调控特定生理生化过程(McCahilletal., 2002)。由于RACK1参与多个基本生物过程,涉及细胞生长和蛋白合成等(Chang, 2002; Chenetal., 2006),所以RACK1在小菜蛾生长、发育过程中呈“看家基因式”表达。各测定时间表达水平虽然存在一定差异,但是总体差异不大(图5)。也正因为该蛋白在生物体内的重要性,其沉默后导致试虫死亡率显著升高(图8: B)。
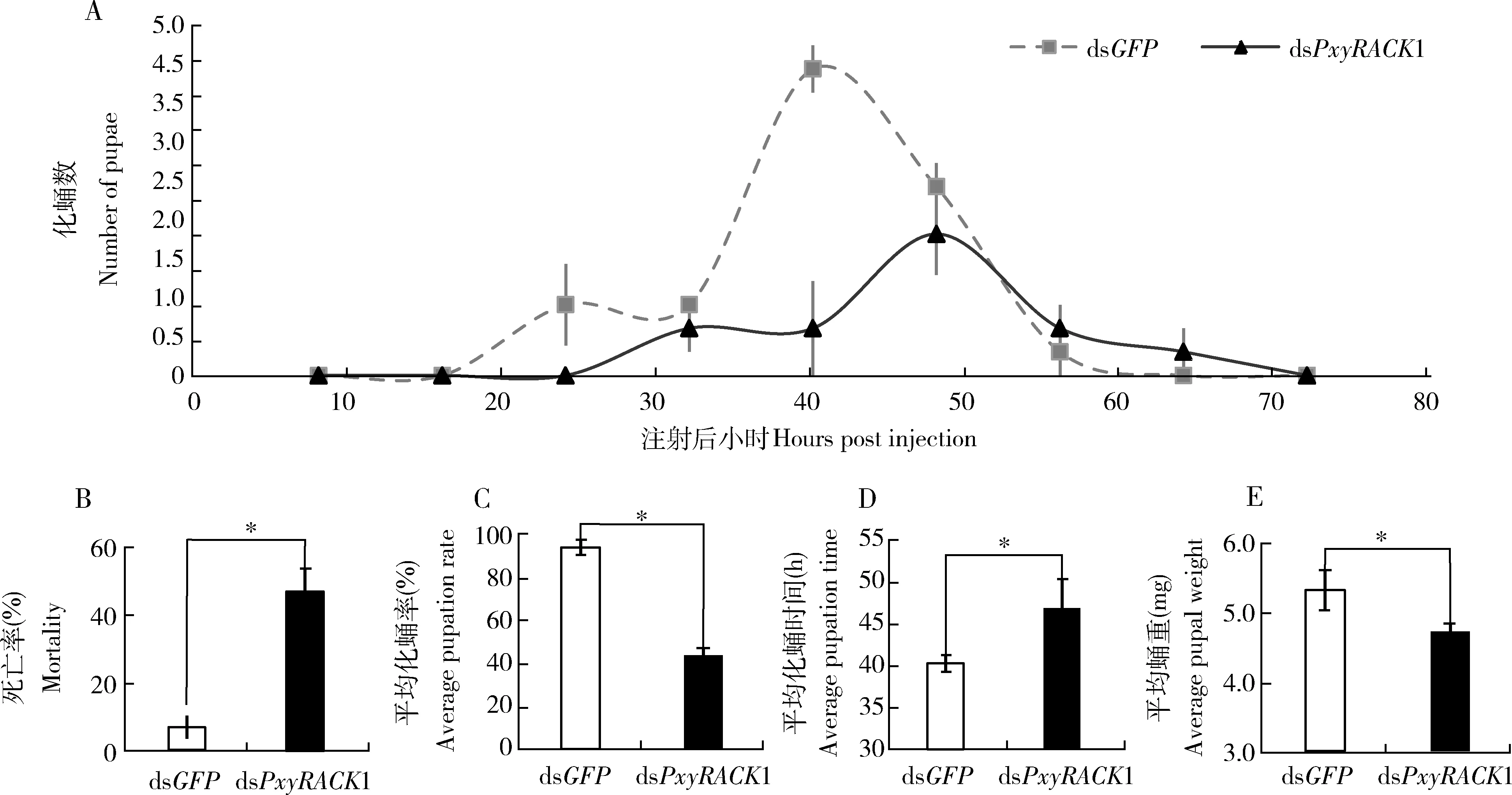
图8 注射PxyRACK1 dsRNA对小菜蛾的化蛹动态(A)、死亡率(B)、平均化蛹率(C)、平均化蛹时间(D)以及平均蛹重(E)的影响Fig. 8 Effect of dsPxyRACK1 injection on the pupation dynamics (A), mortality (B), average pupation rate(C),average pupation time (D) and average pupal weight (E) of Plutella xylostella死亡率、化蛹时间和化蛹率均在显微注射后64 h后测定,蛹重在显微注射后72 h后测定。The mortality, pupation time and pupation rate were detected at 64 h after microinjection, and the pupal weight was measured at 72 h after microinjection.
在昆虫中,保幼激素(juvenile hormone, JH)通路和20E通路联合调控其生长发育进程(Dubrovsky, 2005)。以往研究证实RACK1和这两个通路之间存在关联性。因为20E能够提高棉铃虫6龄幼虫体内RACK1的表达,而保幼激素类似物烯虫酯则能降低其表达(侯元春等, 2012);利用RNAi技术和RACK1/PKC的专性抑制剂地喹碘铵(6CI,7CI)处理云杉卷叶蛾的CF-003细胞系均能抑制蜕皮激素通路转录因子CHR3的表达以及减少蜕皮激素受体(ecdysone receptor, EcR)在细胞核中的积累(Quanetal., 2006)。Br是全变态昆虫蛹期20E通路的早期响应基因,研究也发现RACK1与Br存在相互作用。如在家蚕中不仅利用酵母双杂交技术证实了相互作用的存在,而且还发现Br蛋白的磷酸化及其进入细胞核并发挥转录因子功能也都离不开RACK1的作用(王永虎, 2013; Chengetal., 2014)。在果蝇唾液腺中,RACK1沉默后,Br表达也降低(Wangetal., 2012)。类似地,本研究中也发现PxyRACK1基因沉默后,PxyBr-Z2/3基因表达水平显著下降(图6: B)。Br表达受阻后症状与过量JH影响相似(Spokony and Restifo, 2007; Duanetal., 2016),表现为试虫死亡率升高、化蛹推迟、化蛹率下降以及蛹重减轻(图8)。
综合国内外研究结果,除20E外,全变态昆虫蛹期特异基因Br表达的影响因子至少包括JH、RACK1及全变态昆虫卵和低龄幼虫中的异时性通路(heterochronic pathway)关键基因hunchback和高龄幼虫的CREB结合蛋白(CREB-binding protein, CBP)基因cbp(陈冀阳, 2020)。不过,有关各因素对Br表达的影响机制尚未完全明确。开展这方面研究能够为提高基于Br表达调控改变害虫生长发育进程达到控制害虫的目的提供有益借鉴,并能丰富新型昆虫生长调节剂的开发路径。
