绿豆象气味结合蛋白基因的克隆及表达分析
2021-09-06王宏民庄国动郑海霞张仙红
王宏民, 张 静, 张 冲, 庄国动, 郑海霞, 张仙红
(山西农业大学, 山西太谷 030801)
气味结合蛋白(odorant binding proteins, OBPs)是一类小分子水溶性蛋白,大量存在于嗅觉系统的感器淋巴液中(Pelosietal., 2014, 2018),在昆虫的嗅觉识别过程中发挥着关键的作用(Briandetal., 2001)。随着高通量测序技术的发展,越来越多的鞘翅目昆虫OBPs得到鉴定,如Liu等(2015)构建了马铃薯甲虫Leptinotarsadecemlineata触角转录组,并鉴定出26个OBPs;胡军等(2019)以莲草直胸跳甲Agasicleshygrophila三代全长转录组测序数据为基础,鉴定出53个OBPs;李广伟等(2017)在黄斑星天牛Anoplophoranobilis雌虫触角中共鉴定到16个OBPs;从其他昆虫如松墨天牛Monochamusalternatus(Wangetal., 2014; Gao and Wang, 2015)、白蜡窄吉丁Agrilusplanipennis(Mamidalaetal., 2013)、大猿叶甲Colaphellusbowringi(Lietal., 2015)、黄粉甲Tenebriomolitor(Liuetal., 2015)、中欧山松大小蠹Dendroctonusponderosae(Anderssonetal., 2013)等中也获得多个OBPs。
根据OBPs氨基酸序列中半胱氨酸的数量和间距(Pelosietal., 2014),可将其分为5种主要类型:(1)Classic OBPs:在昆虫OBPs中占据多数,含有6个保守的半胱氨酸残基,第2个和第3个半胱氨酸残基之间存在3个其他氨基酸残基,第5个和第6个半胱氨酸残基之间存在8个其他氨基酸残基;(2)Dimer OBPs:具有两组6个保守的半胱氨酸;(3)Plus-C OBPs:包含6个保守的半胱氨酸残基、2个额外的半胱氨酸残基和1个保守的脯氨酸(张治科等, 2017);(4)Minus-C OBPs:缺失2个保守的半胱氨酸位点;(5)Atypical OBPs:C末端较长,具有9~10个半胱氨酸残基。大量研究表明,触角是OBPs表达的重要部位,但在其他组织部位如头、胸、腹等也有序表达(张治科等, 2017),且由于昆虫个体在不同性别、不同发育阶段等情况下进行的生命活动不同,因此与其相关的OBPs的表达情况也会随之变化。
绿豆象Callosobruchuschinensis属鞘翅目(Coleoptera)豆象科(Bruchidae)瘤背豆象属Callosobruchus,是一种分布广泛且为害严重的害虫种类,对绿豆、红豆、豇豆等豆科植物种子造成严重的为害(王宏民等, 2017; 崔小林等, 2020)。由于绿豆象的幼虫、蛹阶段均隐蔽在种子内而不利于防治,裸露的成虫阶段是进行其防控的重要时期。因此在绿豆象成虫寻找寄主植物和产卵部位的过程中,对其嗅觉识别进行有效的干扰是降低其为害的重要手段。目前,有关OBP基因在绿豆象不同组织中表达的研究还未见报道。因此,本研究基于绿豆象触角转录组数据和鉴定OBPs(郑海霞等, 2018)的基础上,对绿豆象部分OBP基因进行克隆、生物信息学分析及不同组织中的表达情况的研究,旨在为深入研究气味结合蛋白在绿豆象嗅觉识别机制中的作用及基于嗅觉的绿豆象防治提供理论依据。
1 材料与方法
1.1 供试昆虫
供试绿豆象来源于室内贮藏的绿豆种子中,由山西农业大学昆虫重点实验室培养箱(温度27±1℃,相对湿度70%±5%,光周期16L∶8D)饲养至12代时备用。试虫饲养方法:将绿豆平铺在9 cm玻璃培养皿中,接入10对雌雄绿豆象成虫,产卵1 d后取出成虫,20 d左右取新羽化的绿豆象雌雄成虫备用。
1.2 主要试剂
UNlQ-10柱式总RNA抽提试剂盒、即用PCR扩增试剂盒(Taq)、DNA Marker(100(2 000 bp)、SanPrep柱式DNA胶回收试剂盒、X-Gal、IPTG、SGExcel FastSYBR Master(含ROX)购自上海生物工程有限公司;PrimeScriptTM1st Strand cDNA Synthesis Kit、pMDTM19-T Vector Cloning Kit购自TaKaRa公司;大肠杆菌EscherichiacoliDH5α 感受态细胞购自天根生化科技有限公司。
1.3 总RNA提取及cDNA合成
切取羽化1 d的绿豆象成虫(不分性别)触角150对,提取RNA用于克隆实验。另外,切取羽化1 d的绿豆象成虫头部(不含触角,雌雄各100头)、触角(雌雄各150头)、翅(雌雄各80头)、腹(雌雄各10头)和足(雌雄各100头)5种组织用于qRT-PCR。切取时尽量保证其组织的完整性,切取后迅速用液氮冷冻,置于-80℃冰箱备用。参照UNlQ-10柱式总RNA抽提试剂盒提供的说明书进行提取,使用Biodrop Duo分光光度计检测RNA浓度及纯度,1%琼脂糖凝胶电泳检测RNA完整性。利用PrimeScriptTM1st Strand cDNA Synthesis Kit试剂盒进行cDNA合成,-20℃保存备用。
1.4 绿豆象气味结合蛋白基因的克隆
基于实验室前期的绿豆象成虫触角转录组测序数据,选择Blast比对相似度较高的6条OBP序列进行实验,使用Primer Premier 5.0软件设计引物(表1)。以1.3节合成的绿豆象成虫触角cDNA为模板,克隆绿豆象OBP基因的开放阅读框序列。PCR反应体系(25 μL): PCR Mixture 12.5 μL, cDNA模板2.0 μL, 上下游引物(10 μmol/L)各1.0 μL, 其余用水补足。PCR反应条件: 95℃预变性3 min; 94℃变性30 s, X℃(随引物不同而调整)退火1 min, 72℃延伸1 min, 30个循环;72℃终延伸10 min。PCR产物采用1%的琼脂糖凝胶电泳, 将符合预期大小的目的条带纯化,并连接到pMD19-T载体上,转化至大肠杆菌DH5α感受态细胞中,进行蓝白斑筛选,37℃培养12 h后,随机挑选3个阳性菌落送至测序。

表1 引物信息Table 1 Primer information
1.5 绿豆象气味结合蛋白基因的生物信息学分析
利用DNAMAN软件翻译测序成功的OBPs基因序列,并与其他昆虫的OBP基因进行序列比对,蛋白质的理化性质由ProtParam(https:∥web.expasy.org/protparam/)分析。运用NCBI-Conserved Domains工具预测OBPs的保守区域,在线工具ExPASy-ProtScale(https:∥web.expasy.org/protscale/)进行疏水性分析,SignalP 4.0 Server(http:∥www.cbs.dtu.dk/services/SignalP-4.0/)预测蛋白信号肽位置,利用MEGA7.0软件采用邻接法重复1 000次,构建Bootstrap验证的系统进化树(徐素平, 2014)。
1.6 绿豆象气味结合蛋白的组织表达分析
基于1.4节克隆的6个CchiOBPs基因序列,利用Primer Premier 5.0软件设计定量引物(表1),引物要求产物片段在80~250 bp之间。选择最佳稀释倍数稀释雌雄各组织cDNA为模板,分别对6个CchiOBPs基因及内参基因β-tubulin进行qRT-PCR扩增。反应体系(20 μL): SYBR Mix 10 μL, cDNA模板0.8 μL,上下游引物(10 μmol/L)各0.4 μL, ddH2O补足20 μL。PCR反应条件: 95℃ 3 min; 95℃ 5 s, 58℃ 20 s, 40个循环。以每个OBP在雌性腹部的表达量为基准,采用2-ΔΔCt法计算6个CchiOBPs基因在每个组织中的相对表达量(Livak and Schmittgen, 2001)。每个组织测试3个重复样品,每样品重复测定3次。
1.7 数据分析
使用IBM SPSS Statistics 19软件进行数据分析,采用Duncan氏多重极差检验对每个基因在相同性别不同组织中的表达量进行差异显著性分析,利用独立样本T检验对每个基因在相同组织不同性别的表达量进行差异显著性分析。
2 结果
2.1 绿豆象OBP基因的克隆和命名
克隆获得的绿豆象6个气味结合蛋白基因,参照Blast结果中序列相似度较高鞘翅目昆虫OBP基因的命名方式,将绿豆象OBP基因依次命名为CchiOBP1-CchiOBP6,GenBnak登录号分别为MN832700-MN832703和MN901841-MN901842,长度分别为423, 432, 396, 441, 279和405 bp。
2.2 绿豆象OBP基因的序列特征和系统发育
绿豆象6个OBP基因均具有完整的开放阅读框,分别编码140, 143, 131, 146, 92和134个氨基酸,编码蛋白分子量分别为15.40, 16.62, 14.69, 16.56, 10.37和15.02 kD,等电点分别为8.58, 8.32, 4.44, 8.60, 6.82和4.63。序列比对发现CchiOBP1, CchiOBP2, CchiOBP3, CchiOBP4和CchiOBP6均含有6个保守的半胱氨酸位点,且第2个和第3个位点之间含有3个其他氨基酸残基,属于Classical OBPs; CchiOBP5经比对分析后确定为部分序列,为一段C端不完整的Minus-C OBP。6个CchiOBPs在N端均具有信号肽。
通过对本实验克隆的绿豆象6个OBP基因进行序列同源性分析,结果显示CchiOBP1与榆蓝叶甲Pyrrhaltaaenescens的PaenOBP17的氨基酸序列一致性最高,达56.03%;CchiOBP2与马铃薯甲虫Leptinotarsadecemlineata的LdecOBP72的氨基酸序列一致性最高,达69.29%;CchiOBP3与灭字虎天牛Xylotrechusquadripes的XquaOBP3的氨基酸序列一致性最高,达54.48%;CchiOBP4与松褐天牛Monochamusalternatus的MaltOBP4的氨基酸序列一致性最高,达62.70%;CchiOBP5与灭字虎天牛XquaOBP5的氨基酸序列一致性最高,达57.41%;CchiOBP6与云斑天牛Batocerahorsfieldi的BhorOBP3的氨基酸序列一致性最高,达38.84%。
系统发育树(图1)表明,7种叶甲科昆虫、5种天牛科昆虫、3种小蠹科昆虫、2种象甲科昆虫、1种穴甲科昆虫、1种丽金龟科昆虫、1种长蠹科昆虫和1种龙虱科昆虫的OBPs分为4大分支。CchiOBP1和CchiOBP4聚为1大分支;CchiOBP3和CchiOBP6聚为1大分支;CchiOBP2和CchiOBP5各自单独为1分支。聚为1支的CchiOBP1/CchiOBP4及CchiOBP3/CchiOBP6在进化上距离较近,推测可能有相近或相似的功能;而单独成支的CchiOBP2和CchiOBP5进化上距离较远,可能行使不同的功能。
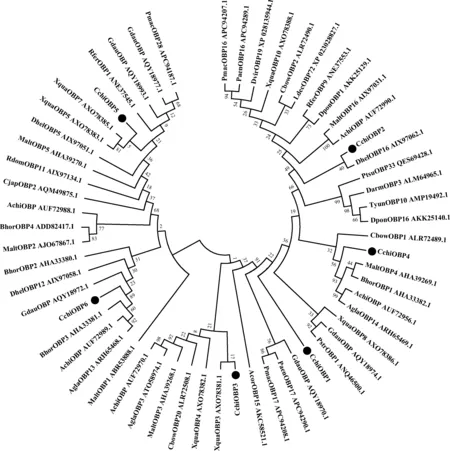
图1 邻接法构建的基于绿豆象CchiOBP1-6与其他昆虫OBPs氨基酸序列的系统进化树(1 000次重复)Fig. 1 Phylogenetic tree of CchiOBP1-6 of Callosobruchus chinensis and OBPs from other insect species constructedby the neighbor-joining method based on amino acid sequence (1 000 replicates)蛋白来源物种及GenBank登录号Origin species of proteins and their GenBank accession numbers: 松墨天牛Monochamus alternatus (MaltOBP1: ABR53888.1; MaltOBP2: AJO67867.1; MaltOBP3: AHA39268.1; MaltOBP4: AHA39269.1; MaltOBP5: AHA39270.1; MaltOBP16: AIX97031.1); 灭字虎天牛Xylotrechus quadripes (XquaOBP3: AXO78381.1; XquaOBP4: AXO78382.1; XquaOBP5: AXO78383.1; XquaOBP7: AXO78385.1; XquaOBP8: AXO78386.1; XquaOBP10: AXO78388.1); 星天牛Anoplophora chinensis (AchiOBP: AUF72970.1, AUF72956.1, AUF72990.1, AUF72988.1, AUF72989.1); 云斑天牛Batocera horsfieldi (BhorOBP1: AHA33382.1; BhorOBP2: AHA33380.1; BhorOBP3: AHA33381.1; BhorOBP4: ADD82417.1); 光肩星天牛Anoplophora glabripennis (AglaOBP3: ATO58974.1; AglaOBP13: ARH65468.1; AglaOBP14: ARH65469.1); 沙葱萤叶甲Galeruca daurica (GdauOBP: AQY18970.1, AQY18974.1, AQY18977.1, AQY18993.1, AQY18972.1); 榆黄毛萤叶甲Pyrrhalta maculicollis (PmacOBP16: APC94207.1; PmacOBP17: APC94208.1; PmacOBP28: APC94187.1); 大猿叶虫Colaphellus bowringi (CbowOBP1: ALR72489.1; CbowOBP2: ALR72490.1; CbowOBP20: ALR72508.1); 榆蓝叶甲Pyrrhalta aenescens (PaenOBP16: APC94289.1; PaenOBP17: APC94290.1); 黄曲条跳甲Phyllotreta striolata (PstrOBP1: ANQ46500.1); 马铃薯甲虫Leptinotarsa decemlineata (LdecOBP72: XP_023028827.1); 玉米根萤叶甲Diabrotica virgifera virgifera (DvirOBP19: XP_028135944.1); 中欧山松大小蠹Dendroctonus ponderosae (DponOBP1: AKK25129.1; DponOBP16: AKK25140.1); 云南切梢小蠹Tomicus yunnanensis (TyunOBP10: AMP19492.1); 华山松大小蠹Dendroctonus armandi (DarmOBP3: ALM64965.1); 棕榈象甲Rhynchophorus ferrugineus (RferOBP9: ANE37553.1; RferOBP1: ANE37545.1); 香樟齿喙象Pagiophloeus tsushimanus (PtsuOBP33: QES69428.1); 花绒寄甲Dastarcus helophoroides (DhelOBP12: AIX97058.1; DhelOBP16: AIX97062.1; DhelOBP5: AIX97051.1); 铜绿丽金龟Anomala corpulenta (AcorOBP15: AKC58521.1); 谷蠹Rhyzopertha dominica (RdomOBP11: AIX97134.1); 黄边大龙虱Cybister japonicus (CjapOBP2: AQM49875.1).
2.3 OBP基因的组织表达谱
qRT-PCR结果表明,绿豆象6个OBP基因在测定的绿豆象成虫组织中均有不同的表达量(图2)。雌成虫中,CchiOBP1-CchiOBP4和CchiOBP6在触角中的表达量最高,分别为在腹部中的183 076.0, 5 787.6, 2 399.9, 32 967.3和174.7倍,均达极显著水平(P<0.01),且其他4种组织间表达量无显著差异(P>0.05)。CchiOBP5在雌成虫触角和头部(不含触角)中的表达量均较高,分别为腹部的5.1和4.2倍,且极显著高在于翅、腹和足中的表达量(P<0.01)。
雄成虫中,CchiOBP1-CchiOBP4在触角中均高表达,分别为在腹部中的987.1, 1 043.3, 250.8和1 005.5倍,且与在其他4种组织中的存在极显著差异(P<0.01),但在这4种组织间表达量无显著差异(P>0.05)。CchiOBP5在足部的表达量最高,为腹部中的3.2倍,极显著高于在其他组织中的(P<0.01),其次为在头部(不含触角)中的,在触角中的表达量最低,与头部(不含触角)表达量存在极显著差异(P<0.01)。CchiOBP6在触角和足部的表达量也较高,分别为在腹部中的24.8和15.7倍,与在其他3个组织间表达量差异极显著(P<0.01)。
绿豆象6个CchiOBPs基因在同一组织不同性别间的表达量存在差异。雄成虫触角、头(不含触角)、腹和足4个组织中CchiOBP1的表达量均显著高于雌成虫的(P<0.05),分别是雌成虫的2.8, 49.5, 511.0和54.6倍;在翅部的表达量显著低于雌成虫的(P<0.05),是雌成虫的0.07倍。雄成虫触角和翅中CchiOBP2的表达量显著低于雌成虫的(P<0.05),分别是雌成虫的0.3倍和0.2倍;在雄成虫足部的表达量显著高于雌成虫足部的(P<0.05),是雌成虫的5.6倍;在头部(不含触角)和腹部的表达量无显著差异(P>0.05)。CchiOBP3基因在雌雄虫间5个组织中的表达量均存在显著差异(P<0.05),在雄成虫头(不含触角)、翅、腹和足中的表达量均显著高于在雌成虫中的(P<0.05),分别是雌成虫的8.6, 16.3, 3.8和17.0倍;在触角中的表达量显著低于雌成虫的(P<0.05),是雌成虫的0.4倍。CchiOBP4在雄成虫腹和足部的表达量显著高于雌成虫的(P<0.05),分别是雌成虫的12.1倍和9.2倍;在触角和翅部的表达量显著低于雌成虫的(P<0.05),均为雌成虫的0.4倍;在头部(不含触角)的表达量无显著差异(P>0.05)。CchiOBP5在雄成虫翅、腹和足部的表达量显著高于雌成虫的(P<0.05),分别是雌成虫的13.3, 4.8和6.1倍;在触角中的表达量显著低于雌成虫的(P<0.05),是雌成虫的0.3倍;在头部(不含触角)的表达量无显著差异(P>0.05)。CchiOBP6在雄成虫翅、腹和足部的表达量显著高于雌成虫的(P<0.05),分别是雌成虫的1.3, 5.6和7.2倍;在触角和头部(不含触角)的表达量无显著差异(P>0.05)。
3 讨论
本研究以绿豆象触角转录组数据为基础,首次克隆出6个气味结合蛋白基因。序列分析表明,CchiOBP1-CchiOBP4和CchiOBP6均含有6个保守的半胱氨酸位点,属于Classical OBPs, CchiOBP5一段缺少第3个和第4个半胱氨酸,推测为Minus-C OBP。与其他昆虫OBPs序列同源性比对发现,绿豆象CchiOBP1, CchiOBP2和CchiOBP5与叶甲科(Chrysomelidae)昆虫OBPs的相似性较高,其中CchiOBP2与马铃薯甲虫的LdecOBP72的氨基酸序列一致性高达69.29%,CchiOBP3,CchiOBP4和CchiOBP6与天牛科(Cerambycidae)昆虫OBPs的相似性较高。类似的结果,如黄斑星天牛的气味结合蛋白AnobOBP14与松墨天牛的气味结合蛋白MaltOBP4序列一致性高达85%(李广伟等, 2017),柑橘大实蝇Bactroceraminax的气味结合蛋白BminOBP25氨基酸序列与桔小实蝇Bactroceradorsalis的气味结合蛋白BdorOBP的氨基酸序列一致性为88%(司品法等, 2018),说明近缘物种OBPs序列有较高的同源性,这些昆虫的亲缘关系较近。
基因的表达谱是预测基因功能的重要手段,谷少华(2013)认为参与嗅觉识别的OBPs主要在触角中特异性表达,而在其他组织中表达的OBPs可能参与其他的生理功能。本研究中CchiOBP1,CchiOBP2,CchiOBP3,CchiOBP4和CchiOBP6在绿豆象雌雄成虫触角中均呈现高表达,且显著高于在其他组织中的,表明其对应的5个CchiOBPs可能是参与绿豆象多种嗅觉识别过程的重要蛋白。研究表明,OBPs除了参与嗅觉识别外,还可能参与其他组织的生理功能,如味觉识别、食物中的脂肪酸溶解、营养物质运输等(张方梅等, 2019)。本研究结果显示绿豆象部分OBP基因在触角以外的组织中均有一定的表达量(图2),如CchiOBP1在雌成虫头部(不含触角)和足部有较高的表达量,CchiOBP5在雌成虫头部(不含触角)也高表达,而CchiOBP5在雄成虫足部的表达量显著高于在其他组织中的,与前人报道的昆虫足部也分布有味觉感器和嗅觉感器研究 (王娟, 2015; 杨叶青等, 2017; 张方梅等, 2019)一致,因此推断CchiOBP1和CchiOBP5可能参与绿豆象除嗅觉之外的其他生理功能。此外,已克隆的6个基因在绿豆象翅和腹部的表达量均相对较低,说明翅和腹部可能不是绿豆象CchiOBP行使功能的重要组织。
据报道,Minus-C OBPs与Classical OBPs相比,在不同组织中表达量差异较小(杨叶青等, 2017)。本研究表明,属于Minus-C OBPs的CchiOBP5的基因在5个组织中的表达量差异较小,最大差异为雌成虫触角表达量是其腹部的5.1倍;而属于Classical OBPs的5个CchiOBPs的基因则在不同组织中表达差异较大,在雌成虫中尤为明显,如CchiOBP1在雌成虫触角中的表达量是其在腹部表达量的183 076.0倍,头(去除触角)、翅和足组织中的表达量为其腹部中的18.0~79.6倍。
OBP基因在雌雄成虫中普遍存在偏向表达,这可能与雌雄成虫在生命活动中各自承担的角色不同有关,如甘薯蚁象的CforOBP8在雄成虫翅部的表达量明显高于在雌成虫中的,推测这与雄成虫在飞行中识别环境中的气味、寻找配偶、交配等行为有关(贾小俭等, 2019);橘小实蝇的BdorOBP19在雌成虫触角中大量表达,该基因在其产卵和定位寄主植物过程中发挥重要作用(Wuetal., 2015)。本研究发现,CchiOBP1在绿豆象雄成虫各组织中的表达量显著高于雌成虫的,而CchiOBP2-CchiOBP5在雌成虫触角中的表达量显著高于在雄成虫的;除触角外,其他部位的OBP基因表达量在雌雄成虫间也存在一定差异。这些基因可能在雌雄之间交配时,或是与寄主互作的过程中发挥重要作用,后期还需通过荧光竞争结合或RNA干扰等实验进行功能验证。
