副干酪乳杆菌与芽孢杆菌属共培养种间关系对产细菌素的影响
2021-09-05姜雪雍岳元春孙养存高冬妮平文祥葛菁萍
姜雪雍,岳元春,孙养存,高冬妮,平文祥,葛菁萍
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨150080;2微生物黑龙江省高校重点实验室/黑龙江大学生命科学学院,哈尔滨150500)
0 引言
刺激次生代谢产物生物合成的一种方法是用生物胁迫来挑战给定的微生物,该胁迫可以通过与其他微生物共培养来实现[1]。共培养可以提高菌株活性,也可以在基础水平上提高代谢物的产量[2]。然而在自然环境中,微生物在共培养状态下的生态学关系繁杂多变,微生物之间的协同代谢、互惠共生、相互竞争、代谢物中的信号分子等的相互作用,都对共培养体系中目标产物产量和新物质的产生有影响[3]。在一定条件下,微生物共培养时的代谢活动会偏利于其中一方或二者互惠共生,从而提高目的产物的产量[4]。以乳酸菌和芽孢杆菌的共培养来说,分泌细菌素和产生芽孢都是争夺营养及空间的有效方式[5-6],乳酸菌和芽孢杆菌种类的不同、共培养中菌群密度的改变,在某种程度上会影响二者的生态关系[6-7]。研究证明,枯草芽孢杆菌(Bacillus subtilis)BN会促进乳酸杆菌的生长,二者共培养具有互利共生的关系[8]。当纳豆芽孢杆菌与干酪乳杆菌的接种比例为1:2时,关系为偏利共生,代谢产物纳豆激酶(NK)活力及吡咯喹啉醌(PQQ)含量得到显著提升[9]。将蜡样芽孢杆菌(Bacillus cereus)NVH 45与干酪乳杆菌(Lactobacillus casei)2756进行共培养时,B.cereus的生长被抑制并且无芽孢形成,体现对其偏害的生态关系,但与嗜酸乳杆菌(Lactobacillus acidophilus)NCFB 1748共培养时B.cereus仅略有减少并有芽孢形成,体现互利共生的生态关系,其中乳酸菌的接种量(107cfu/mL)远高于B.cereus(102cfu/mL)[10]。将青春双歧杆菌(Bifidobacterium adolescentis)ATCC 15703与B.cereus ATCC 9634共培养,当B.adolescentis的接种量远高于B.cereus时,B.adolescentis的生长速率远高于纯培养对照,而B.cereus的菌数显著下降,此时二者形成的是对B.adolescentis偏利而对B.cereus偏害的生态关系[11]。将保加利亚乳杆菌(Lactobacillus bulgaricus)接入培养至48 h的枯草芽孢杆菌(Bacillus subtilis)中,L.bulgaricus的生长受到抑制,在这种条件下是对L.bulgaricus偏害的生态关系,然而将同等比例的L.bulgaricus和B.subtilis同时接种,二者均可进入稳定生长期,并能提高代谢产物红豆抗氧剂的浓度[12]。
副干酪乳杆菌(Lactobacillus paracasei)HD1.7可以产生细菌素Paracin1.7,其抑菌能力比Nisin更广泛,具有抑菌谱广等特点,是一种极具应用潜力的天然防腐剂[13-14]。L.paracasei HD1.7与B.subtilis以1:1(%,v/v)的接种比例共培养时,B.subtilis能促进L.paracasei HD1.7的生长、细菌素Paracin 1.7产量增加与群体感应相关基因基因luxS、prcK和prcR的上调表达,然而L.paracasei HD1.7则抑制B.subtilis的生长、芽孢形成及芽孢形成相关基因spo0A、sigE、sigF和sigG的表达[15]。此条件下L.paracasei HD1.7对B.subtilis偏害,而B.subtilis对L.paracasei HD1.7偏利。为了促成B.subtilis与L.paracasei HD1.7协同合作的种间关系,以及确定芽孢杆菌属微生物分泌的信号物质对L.paracasei HD1.7产细菌素的促进作用是否具有普遍性,本文旨在探究芽孢杆菌初始接种比例和种类的不同对于共培养体系中种间关系稳定以及对L.paracasei HD1.7产细菌素的影响,通过提高芽孢杆菌的初始接种量,探究在此条件下二者的生态学关系。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 副干酪乳杆菌(Lactobacillus paracasei)HD1.7是从东北酸菜发酵液中分离得到的菌株[14],用作实验菌种。枯草芽孢杆菌(Bacillus subtilis)(ATCC 11774)为共培养实验菌种以及抑菌试验指示菌,地衣芽孢杆菌(Bacillus licheniformis)、短小芽孢杆菌(Bacillus pumilus)、蜡样芽孢杆菌(Bacillus cereus)、侧孢芽孢杆菌(Bacillus laterosporus)以及苏云金芽孢杆菌(Bacillus thuringiensis)为共培养实验菌种,探究芽孢杆菌属与L.paracasei HD1.7种间关系。以上菌种均保藏于黑龙江大学微生物重点实验室。
1.1.2 培养基 MRS(De Man,Rogosa and Sharp)培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母浸粉5 g,磷酸氢二钾2 g,柠檬酸铵2 g,无水亚硫酸钠0.1 g,硫酸镁0.2 g,硫酸锰0.05 g,无水乙酸钠5 g,吐温-80 1 mL,补蒸馏水至1000 mL,pH 5.5,108℃高压灭菌20 min,用于L.paracasei HD1.7的活化。在MRS固体培养基(含2%琼脂的液体培养基)上培养48 h,得到菌落计数。
BP(Beef Extract Peptone)培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,加蒸馏水至1000 mL,pH 7.0,121℃高压灭菌15 min,作为芽孢杆菌属的种子液培养基。在BP固体培养基(含2%琼脂的液体培养基)上测定菌落数和芽孢数。在抑菌试验中,使用BP半固体培养基(含0.75%琼脂的液体培养基)为上层培养基,下层为水琼脂培养基:琼脂20 g,补蒸馏水至1000 mL,pH自然,121℃灭菌15 min。
CO培养基:酵母提取物10 g,葡萄糖20 g,磷酸二氢钾2.5 g,硫酸镁0.2 g,1 mol/L硝酸钙1 mL,0.1 mol/L氯化锰1 mL,1 mmol/L硫酸亚铁1 mL,pH 6.5,加蒸馏水至 1000 mL,108℃灭菌 20 min,作为 L.paracasei HD1.7与芽孢杆菌属共培养的发酵培养基。
1.1.3 扩增引物 荧光定量PCR试验所用引物由Invitrogen技术有限公司合成,群体感应相关基因引物序列:luxS-up:5′-ATGGCAAAAGTT GAAAGTTTCA C-3′和 luxS-down:5′-CTAGACAACCTGACGCGT GTACG-3′;prcK-up:5′-AAGATGGTATTTGGATGTC GGC-3′和 prcK-down,5′-GCTCGTCGTGATTCATTG GTG-3′;prcR-up:5′-AGGGATGTCAATGTCCAGC AG-3′和 prcR-down:5′-GCCGAAATCAAATTCACC ACTC-3′。芽孢形成相关基因引物序列:spo0A-up:5′-ATGGAAGTGATCGGCGTTGC-3′和 spo0A-down:5′-CTTCCTGCCCAAAGGCTGTC-3′;sigE-up:5′-CTGC TGATGAAACTTGGGCTG-3′和 sigE-down:5′-CGG GAGGCATAGGTAGCAAGC-3′;sigF-up:5′-CCAAA ATGGCGACCAGCAG-3′和 sigF-down:5′-CGCGC CGGATTTTGTTTC-3′;sigG-up:5′-CTTGTAAACG GGAACTTGCG-3′和 sigG-down:5′-CGGCTCCTTG CTTGTCTCAC-3′。
1.2 菌体及芽孢计数
取0.5 mL各发酵时期的L.paracasei HD1.7和B.subtilis接触共培养的发酵液于4.5 mL无菌水中进行梯度稀释后,取0.1 mL涂布于BP及MRS固体培养基中,置于37℃的恒温培养箱中,分别培养24 h(芽孢杆菌)和 48 h(L.paracasei HD1.7),进行菌落计数[16-17]。取不同时期发酵液1.5 mL置于2 mL离心管中,80℃水浴锅中加热20 min(确保将营养体全部杀死),稀释涂布于BP固体培养基中,置于37℃培养箱中培养24 h,进行芽孢计数。
1.3 细菌素Paracin 1.7粗制液的制备
将取得的发酵液样品于12000 r/min、4℃离心10 min,去除沉淀并将上清液用0.22 μm细菌滤器进行过滤除菌,所得的发酵上清液即为含有Paracin 1.7的粗制液[18-20]。使用杯碟法检测发酵上清液的抑菌活性[21],其中细菌素Paracin 1.7对指示菌B.subtilis抑菌圈直径差值(x)与细菌素效价对数值(y)之间的标准曲线(1)[22]。

1.4 共培养实验
首先,将B.subtilis与L.paracasei HD1.7的初始接种比例调整为3:1、5:1和5:2(%),分别接种于100 mL的CO培养基中,接触性共培养60 h,37℃、160 r/min,每隔4 h进行取样,以接种量为1%和2%单培养的L.paracasei HD1.7以及3%和5%单培养的B.subtilis为对照,检测各组分发酵液pH、活菌数、产芽孢数以及细菌素的抑菌活性,在发酵培养36 h时,采用qRT-RCR检测L.paracasei HD1.7群体感应相关基因luxS、prcK和prcR以及B.subtilis芽孢形成相关基因sigE,sigF,sigG和spo0A的基因表达差异情况。确定最佳的接种比例后,将该比例应用于L.paracasei HD1.7与芽孢杆菌属微生物的共培养中,进而验证二者在调整比例后的生态学关系。
1.5 荧光定量PCR检测基因转录水平变化
使用RNA prep Pure细菌总RNA提取试剂盒提取菌液RNA,通过Nanodrop 2000核算分析仪检测RNA样本的纯度和浓度。利用BioRT cDNA第一链合成试剂盒反转录合成cDNA。以2种菌株单独培养为对照组,共培养为实验组,每组取适量cDNA作为模板,添加特异性引物、SYBR Solution/RealMasterMix和去离子水,扩增群体感应相关基因luxS、prcK和prcR以及芽孢形成相关基因spo0A、sigE、sigF和sigG。获得各样品的CT值以相对定量2-△△CT法进行分析,以内参基因16S rRNA校正[23]。
1.6 试验数据的统计学分析
利用SPSS(StatisticalProductandService Solutions)软件对试验数据进行统计学分析,以X±SD表示。采用T-TEST对试验数据进行差异显著性分析,当P<0.05为差异显著,用*表示;当P<0.01为差异极显著,用**表示。利用Canoco 5(version 5.0)进行理化因子与微生物的相关性分析。
2 结果与分析
2.1 B.subtilis接种率对共培养体系的影响
L.paracasei HD1.7单培养以及与B.subtilis共培养时,各组pH表现出一致的变化规律,均在0~24 h呈现下降趋势,24~60 h趋于平稳,最后都达到了3.2~3.8之间,其中当B.subtilis与L.paracasei HD1.7的接种比例为5%:1%时,pH的降低被延缓,最终为3.79。当B.subtilis单培养时,pH的趋势为先下降后上升再下降(图1A)。说明随着B.subtilis接种比例提高可能消耗部分乳酸,减缓共培养体系内pH的降低[24]。
从B.subtilis的活菌数来看(图1B),不同比例共培养相对于其各自单培养而言,其活菌数均下降,并且3%:1%和5%:2%均在36 h后检测不到菌体。然而,接种量比例为5%:1%时,在60 h依然有活菌的存在,为1.70±0.31 log10(CFU/mL),说明该比例条件可以有效的延长芽孢杆菌的存活时间。
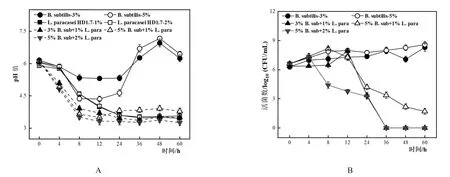
图1 不同接种比例单培养以及共培养体系中pH的变化(A)和B.subtilis活菌数(B)
对于L.paracaseiHD1.7而言(图2A),5%:1%共培养的比例下其活菌数从6.30±0.08 log10(CFU/mL)开始上升至12 h后出现缓慢下降并于36 h达到稳定,为8.00±0.09 log10(CFU/mL),而3%:1%和5%:2%共培养的比例下,活菌数均先上升至24 h后下降,在60 h时活菌数分别为8.32±0.16 log10(CFU/mL)和8.43±0.13 log10(CFU/mL)。说明此接种比例提高会抑制共培养体系内L.paracaseiHD1.7的生长,促使其活菌数减少。
3%:1%、5%:1%和5%:2%三种不同比例的共培养相对于单培养而言,细菌素的产生时间均从12 h提前到8 h,并且均在36 h达到稳定,其产量相对于单培养而言分别提高了1.18、1.21和1.34倍,差异均极显著(图2B)。与此同时,对于3种不同比例共培养后B.subtilis产芽孢量均出现提高,分别为其单培养的3.68、5.95和4.88倍(表1)。

表1 不同接种比例共培养与单培养中B.subtilis产芽孢数之比
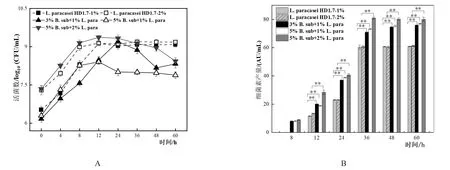
图2 不同接种比例单培养以及共培养体系中L.paracasei HD1.7活菌数(A)及其抑菌活性(B)
由共培养体系中物种与环境变量相关关系的冗余分析(RDA()图3)可知,细菌素的产生与发酵时间、芽孢数、L.paracaseiHD1.7活菌数呈正相关,与B.subtilis活菌数、pH及B.subtilis比L.paracaseiHD1.7的接种比例呈负相关关系。从投影长度来看,发酵时间、B.subtilis活菌数以及芽孢数对L.paracaseiHD1.7产细菌素的相关性最高。
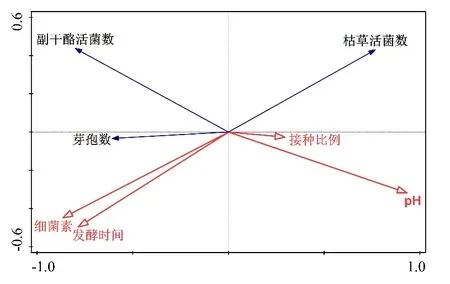
图3 L.paracasei HD1.7与B.subtilis共培养体系中物种与环境变量相关关系的冗余分析(RDA)
综合以上结果可知,共培养体系中B.subtilis营养体及芽孢的存在都对L.paracaseiHD1.7产细菌素有刺激作用。当调整二者的接种比例后,随着B.subtilis促进L.paracaseiHD1.7产细菌素的同时,其自身也形成更多的芽孢来回避细菌素的攻击,形成协同合作的种间关系,最适比例为5%:1%。
2.2 不同比例下群体感应及芽孢形成相关基因mRNA的表达
2.2.1L.paracaseiHD1.7群体感应相关基因检测 由图4A可知,5%:1%和3%:1%共培养的接种比例下,其luxS、prcK和prcR基因的转录水平均高于1%单培养的L.paracaseiHD1.7,其中luxS表达水平分别提高3.14倍和2.91倍,prcK表达水平提高4.98和4.03倍,prcR表达水平提高5.41和4.90倍。而5%:2%共培养的接种比例下相对于2%单培养的L.paracaseiHD1.7而言,其luxS、prcK和prcR基因的转录水平分别提高了3.19、5.06和5.46倍,其相对于各自的对照组而言均差异极显著。
2.2.2B.subtilis芽孢形成相关基因检测 由图4B可知,5%:1%和5%:2%共培养的接种比例下,B.subtilis芽孢形成相关基因spo0A、sigE、sigF和sigG基因的转录水平均高于5%单独培养的B.subtilis,其中spo0A转录水平提高2.37倍和2.17倍,sigE基因的转录水平提高2.71倍和2.35倍,sigF基因的转录水平提高3.15倍和3.03倍,sigG基因的转录水平提高2.56倍和2.13倍。而3%:1%共培养的接种比例下相对于3%单培养的B.subtilis而言,其spo0A、sigE、sigF和sigG基因的转录水平分别提高了2.02、1.43、2.47和2.08倍。
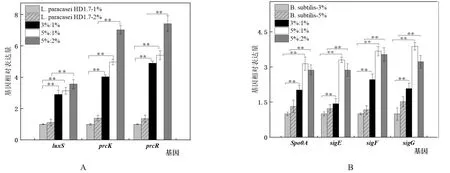
图4 不同比例下L.paracasei HD1.7群体感应相关基因luxS、prcK和prcR(A)以及B.subtilis芽孢形成基因spo0A、sigE、sigF和sigG(B)相对表达量的差异
结果表明,将L.paracaseiHD1.7与B.subtilis的接种比例调整为3%:1%、5%:1%和5%:2%三种不同的接种比例后,相对于单培养而言L.paracaseiHD1.7群体感应相关基因均上调,并且B.subtilis芽孢形成相关基因也均上调,与2.1中发酵试验结果一致,由此可以说明:在此条件下L.paracaseiHD1.7与B.subtilis共培养时,既提高了细菌素产量,B.subtilis也通过形成更多的芽孢回避细菌素的攻击,协同合作最佳的接种比例是B.subtilis:L.paracaseiHD1.7为5%:1%,将此接种比例应用于芽孢杆菌属中,探究在此比例下,二者的协同合作关系在芽孢杆菌属中是否为普遍现象。
2.3 芽孢杆菌属与L.paracasei HD1.7以5%:1%比例共培养
将6种芽孢杆菌属5%的接种量单培养于CO培养基中,除B.pumilus发酵液pH从最初的大约6.07下降到24 h(pH为4.65)随后迅速上升至6.65外,其余5株芽孢杆菌的发酵液pH的总趋势均下降且B.cereus、B.megaterium、B.laterosporus、B.licheniformis和B.thuringiensis等发酵液pH 分别降至4.76、4.61、4.63、4.65和4.54(图5A)。当芽孢杆菌属与L.paracaseiHD1.7接种比例为5%:1%时,其发酵液的pH随着时间的推移而下降,其中B.cereus、B.megaterium、B.pumilus、B.laterosporus、B.licheniformis和B.thuringiensis分别下降至3.67、3.74、3.17、3.81、4.09和4.12,由于引入产酸的L.paracaseiHD1.7因此共培养的发酵液pH均低于其5%单培养(图5B)。
将6种芽孢杆菌属以5%的接种量单培养于CO培养基中,在8 h前,各体系活菌数均上升,B.pumilus于36 h后又出现缓慢上升的趋势直至48 h后稳定,其余芽孢杆菌均降至大约36 h后趋于稳定(图6A)。共培养体系中,各芽孢杆菌活菌数也与其单培养一样出现先上升后下降的趋势,并且培养至60 h时,B.licheniformis、B.megaterium和B.pumilus仍然有活菌的存在,而B.cereus、B.thuringiensis和B.laterosporus分别在36、48和60 h检测不到活菌(图6B),同时其共培养情况下产芽孢量相对于单培养而言也无显著提升(表2)。芽孢杆菌属在共培养中,B.pumilus芽孢的产生量相对于单培养而言提升最多,在60 h其共培养的产孢量约是单培养的4.88倍。
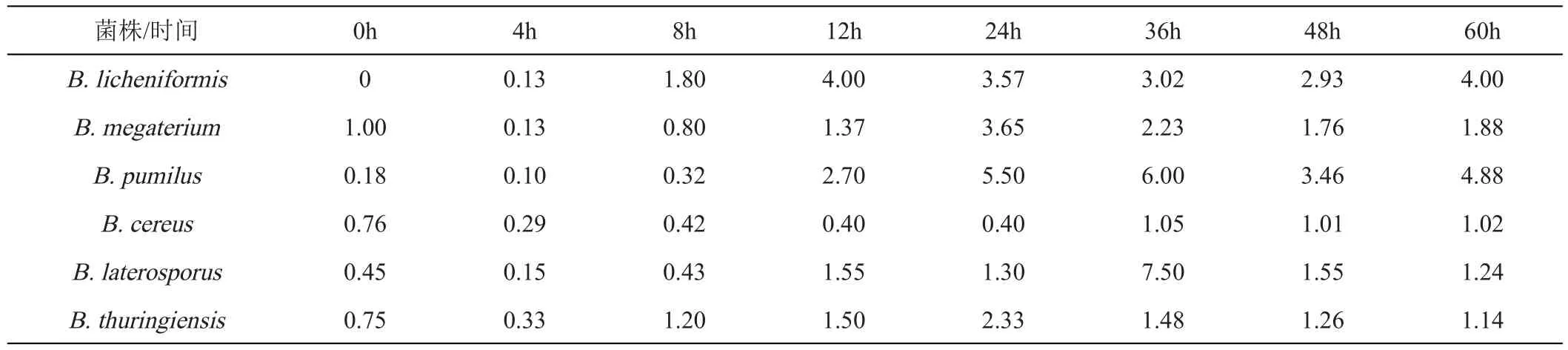
表2 芽孢杆菌属产芽孢共培养与单培养之比
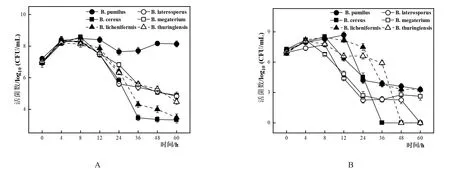
图6 6种芽孢杆菌5%接种量单培养(A)及与L.paracasei HD1.7以5%:1%的比例共培养(B)菌体生长变化情况
当6种芽孢杆菌与L.paracaseiHD1.7以5%:1%的比例进行共培养时,与B.cereus和B.pumilus共培养的L.paracaseiHD1.7的活菌数分别上升至9.08±0.21 log10(CFU/mL)和 9.46±0.19 log10(CFU/mL)后趋于稳定 ,而 与B.megaterium、B.laterosporus、B.licheniformis和B.thuringiensis等芽孢杆菌共培养的L.paracaseiHD1.7活菌数均先上升至8~12 h后下降(图7A)。
L.paracaseiHD1.7与6种芽孢杆菌以5%:1%共培养时,与B.pumilus共培养的L.paracaseiHD1.7所产细菌素随时间的增加而扩大,在60 h其细菌素产量达到最大,为77.46±0.38 AU/mL是单培养的1.27倍,而与其他芽孢杆菌共培养时细菌素产量均下降(图7B),并且与B.licheniformis和B.thuringiensis共培养时,其细菌素的产生被抑制。
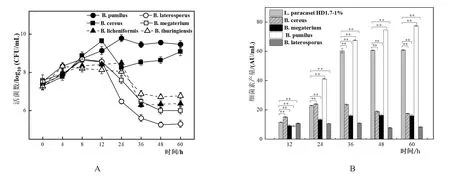
图7 L.paracasei HD1.7与6种芽孢杆菌以5:1的比例共培养L.paracasei HD1.7菌体生长情况以及产细菌素情况
当6种芽孢杆菌属微生物与L.paracaseiHD1.7以5%:1%的比例共培养时,B.pumilus与L.paracaseiHD1.7的共培养组中,细菌素产量提升的同时B.pumilus也形成更多的芽孢,二者之间形成的是协同合作关系。B.licheniformis和B.thuringiensis与L.paracaseiHD1.7共培养时,芽孢的产量仅略有提升,但却完全抑制了细菌素的产生,它们形成的是对L.paracaseiHD1.7偏害的生态关系。B.cereus、B.megaterium和B.laterosporus而言,芽孢杆菌产孢量提升,细菌素的产量减少,形成的是对B.cereus、B.megaterium和B.laterosporus偏利并对L.paracaseiHD1.7偏害的生态关系。
3 讨论与结论
代谢产物的合成需要产生菌达到一定的菌体密度时才能合成[25]。Mehdi等[26]将乳酸乳球菌(Lactococcus lactis)与解脂耶氏酵母(Yarrowia lipolytica)以不同接种比例共培养,接种比例为1:1的条件下,可获得最高的乳酸链球菌素产量。当Y.lipolytica与L.lactis的接种比例大于1时,Y.lipolytica的生长速度和底物的利用率降低。Zhu等[27]证明共培养体系中巨大芽孢杆菌(Bacillus megaterium)孢子形成和孢子稳定性是促进普通生酮基古龙酸菌(Ketogulonigenium Vulgare)生长以及合成2-酮-L-古洛糖酸(2-KLG)的重要因素。可以见得,接种比例和产芽孢量的不同都会对共培养下的菌群结构造成影响。本实验中调整L.paracasei HD1.7与B.subtilis共培养的比例,二者的生态关系确实随之改变。当B.subtilis:L.paracasei HD1.7为5%:1%时,形成了协同合作的生态关系,细菌素的产生为单培养的1.21倍,芽孢的产生为单培养的5.95倍,提高了二者在种群间的竞争力,维系了产细菌素的L.paracasei HD1.7与B.subtilis间的稳定,使二者处于相互平衡的生态关系。
接种比例相同但菌种不同会产生不同的生态关系,Bertrand等[28]发现,将酿酒酵母(Saccharomyces cerevisiae)与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)04BBA15共培养时出现了对S.cerevisiae偏利的共生关系以及与发酵乳杆菌(Lactobacillus fermentum)04BBA19进行共培养时,体现为互利共生关系。与同一属中的不同种细菌进行共培养时,生态关系也不尽相同。Tremonte等[29-30]指出将清酒乳杆菌(Lactobacillus sakei)与两种凝固酶阴性葡萄球菌:木糖葡萄球菌(Staphylococcus xylosus)和变异微球菌(Kocuria varians)进行共培养时,每二者之间均形成了协同合作的关系,且前者促进了后者的蛋白水解活性。本文研究结果说明,L.paracasei HD1.7与芽孢杆菌属的共培养中,在同一条件下与不同种的芽孢杆菌之间形成的生态关系也是不相同的,既有与之共培养后对L.paracasei HD1.7偏利的芽孢杆菌,同样也存在对其偏害的芽孢杆菌。
