饲料DHA/EPA比例对虎龙斑幼鱼生长、肌肉脂肪酸组成和肝脏脂肪代谢的影响
2021-09-04王垂瑾高煜杰
■郑 智 王垂瑾 王 尧 高煜杰
(海南大学海洋学院,海南海口 570228)
二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)是动物体内具有重要生理功能的n-3系长链多不饱和脂肪酸(LC-PUFA),参与动物体细胞膜物质运输、基因表达调控和渗透压调节等重要生理过程[1-2]。然而大多数海洋性鱼类合成LC-PUFA的能力有限[3],因此饲料中需要添加足量LC-PUFA以满足其对此类必需脂肪酸的需求。当饲料中必需脂肪酸缺乏时会严重损害鱼体肝脏正常生理机能、破坏细胞膜完整性、引起转氨酶等指标升高,甚至出现脂肪肝症状[4-5]。此外,研究还表明饲料中DHA/EPA比例也会影响鱼体正常生长,且适宜DHA/EPA比例有助于提高鱼体脂肪代谢能力和免疫性能,从而维持机体健康[6]。但研究发现,不同种属鱼类对饲料中最适DHA/EPA比例要求存在较大差异。对斜带石斑鱼中的研究发现,当饲料中DHA/EPA比例为1或2时,鱼体生长及健康达到最佳状态[7]。而对点带石斑鱼(Epinephelus mala⁃baricus)的研究发现DHA是其较适宜的LC-PUFA类型,当DHA/EPA比例为3∶1时,鱼体生长得到显著提高[8]。
虎龙斑(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)是由鞍带石斑鱼(Epinephelus lanceolatu)和棕点石斑鱼(Epinephelus fuscoguttatus)杂交而来,不仅具有“虎斑头、龙胆尾”的体型,且具备父本生长速度快、母本抗病能力强的优势,目前逐步成为石斑鱼养殖的主要品种,具有较大发展潜力[9]。前期研究发现,虎龙斑饲料中脂肪最适添加水平为7%~14%[10-11],但有关虎龙斑多不饱和脂肪酸营养需求特点的研究仍十分匮乏,且不同鱼类对LC-PUFA需求特点(如最适DHA/EPA比例)存在较大差异。因此,本文拟通过养殖实验探究饲料中最适DHA/EPA比例对虎龙斑幼鱼生长的影响,同时通过分析肌肉脂肪酸组成、肝脏脂肪沉积以及脂肪代谢基因表达情况,研究DHA/EPA比例对鱼体生理生化的影响,以期为虎龙斑脂类营养提供理论依据,对饲料中脂类选择及添加提供参考依据。
1 材料与方法
1.1 实验饲料
实验设计6种等氮(53%)、等脂(7%)饲料,通过添加不同水平DHA和EPA纯化油(陕西冠晨生物有限公司)以设置6组DHA/EPA比例梯度,即0.54、0.97、1.51、2.01、2.41和2.85。实验饲料配方及营养水平见表1,饲料脂肪酸组成(干重)见表2。实验饲料制作时,将所有原料进行粉碎,逐一准确称量,放入搅拌机中混合30 min,随后加入豆油和纯化油脂并不断搅拌,最后加入一定量蒸馏水,搅拌均匀后用双螺杆挤压机(华南理工大学化学工程学院,广州)制成3 mm粒径颗粒,并于室内风干,-20℃贮藏备用。
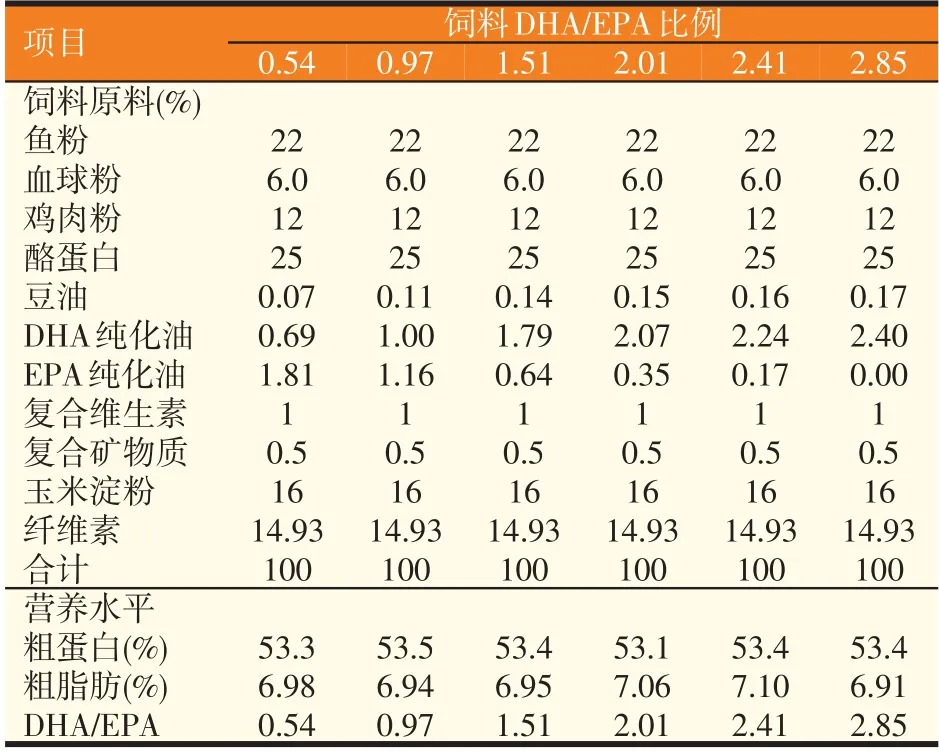
表1 实验饲料配方及营养水平
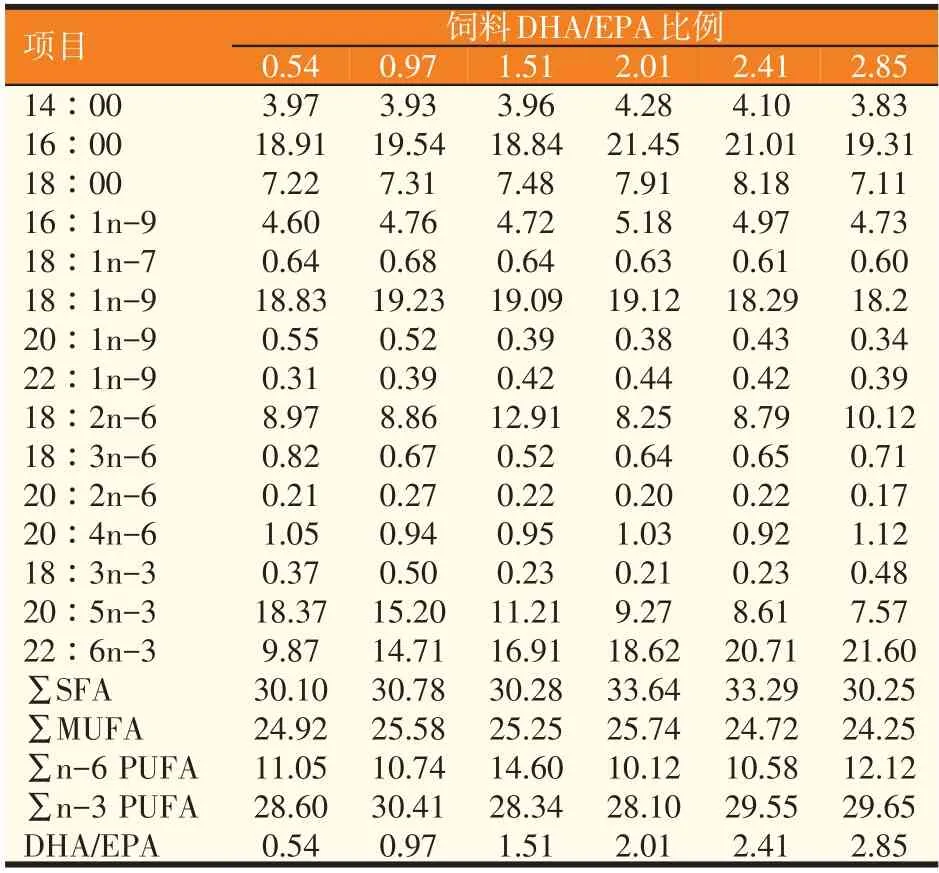
表2 实验饲料脂肪酸组成(%)
1.2 实验鱼苗及养殖过程
实验所用虎龙斑幼鱼购自海南省海口市桂林洋一育苗场。鱼苗运输至室内循环水系统后用自制饲料驯化1周。随后随机挑选216尾规格均一[(20.8±0.03)g]、健康个体分配至18个玻璃缸(60 cm×45 cm×50 cm)中,每种饲料设置3个平行。每日饱食投喂2次(8:00和16:30)。实验期间海水盐度为30 g/L,水温(29±0.5)℃,溶解氧(5.9±0.1)mg/L,氨氮0~0.20 mg/L,养殖周期为42 d。
1.3 样品采集
42 d养殖实验结束时实验鱼饥饿24 h后开始取样,取样前对每缸实验鱼进行计数和称重。每缸取5尾鱼用MS222进行麻醉,取其中2尾鱼置于-20℃用于全鱼组织成分分析;3尾鱼解剖后收集肌肉组织用于常规组分和脂肪酸含量分析,取肝脏中间部分(1 cm3)置于液氮中用于油红冷冻切片分析,肝脏其余部位置于液氮中用于后续RNA提取及荧光定量PCR检测。
1.4 指标测定及方法
1.4.1 生长性能计算
增重率(WGR,%)=100×(Wt-W0)/W0
特定生长率(SGR,%/d)=100×(lnWt-lnW0)/t
饲料系数(FCR)=摄食量/增重
成活率(SR,%)=100×(实验末鱼尾数/实验初鱼尾数)
式中:t——实验天数(d);
Wt——实验结束时平均体重(g);
W0——实验开始时平均体重(g)。
1.4.2 肌肉脂肪酸测定
取50 mg肌肉组织样品,加入1 mL 0.37 mol/L氯化钾溶液匀浆后加入4 mL Folch液(氯仿∶甲醇=2∶1)斡旋混匀,加入500μL Folch液使其溶解,转入10 mL棕色甲酯化玻璃瓶,并加入500μL、1 mg/mL十九烷酸(溶于正己烷,上海安谱实验科技股份有限公司),氮吹干燥后加入2 mL 14%三氟化硼-甲醇溶液(GC级,Sigma,美国),在水浴锅中100℃水浴30 min,冷却至室温,加入2 mL甲醇(GC级,Sigma,美国),100℃水浴20 min,冷却至室温将液体转移至10 mL离心管中,加入1 mL正己烷(GC级,Sigma,美国)和1 mL蒸馏水,斡旋混匀后2 000 r/min离心5 min,吸取1 mL上清移至上样瓶中。气象色谱仪(安捷伦6890N,美国):色谱柱柱温为140℃保持5 min,以4℃/min速度升温至240℃后保持30 min,进样量1μL,脂肪酸成分的计算用峰面积归一化法。
1.4.3 肝脏油红染色切片
肝脏组织在冷冻切片机(CRYOSTAR NX50,Ther⁃mo,上海)中切片,用10%福尔马林固定,蒸馏水冲洗后60%异丙醇浸泡;油红溶液染色后60%异丙醇溶液冲洗切片,蒸馏水润洗后进行光学显微镜观察(奥林巴斯,IX71)。采集图像后用Image-Pro Plus 6.0软件对油红染色区域中脂滴区域进行统计计算。
1.4.4 肝脏脂肪代谢相关基因表达分析
利用Trizol试剂法(Invitrogen,美国)提取肝脏总RNA,1.0%琼脂糖凝胶电泳检验RNA完整性,参照反转录试剂盒(PrimeScript RT Master Mix,TaKaRa,日本)说明将RNA反转录为cDNA。在荧光定量PCR仪(Quant⁃Studio 6 Flex,Applied Biosystems,新加坡)上进行实时荧光定量PCR测定,该实验反应总体系为10μL,包括5μL TB Green Premix Ex Taq(TaKaRa,日本),各0.2μL正反引物(10μmol/L),4.1μL无核酶DEPC水和0.5μL cDNA。Q-PCR反应程序如下:95℃、10 min,95℃、15 s,56℃、60 s,40个循环;70℃、20 s。引物序列根据本实验室转录组数据库获得并通过测序验证(见表3),扩增效率为E=10(-1/slope)-1,目的基因表达为2-△△Ct。

表3 实时荧光定量PCR基因引物序列
1.5 数据统计分析
数据用”平均值±标准误”表示,SPSS 20.0软件进行单因素方差分析和Tukey’s多重检验,P<0.05表示差异显著。
2 结果与分析
2.1 饲料DHA/EPA比例对虎龙斑幼鱼生长及饲料利用的影响(见表4)

表4 饲料DHA/EPA比例对虎龙斑幼鱼生长及饲料利用的影响
如表4所示,42 d养殖实验结束后,虎龙斑幼鱼生长及饲料利用并未受到饲料中DHA/EPA比例的影响(P>0.05)。当DHA/EPA比例为0.54时鱼体增重率和特定生长率最低,而最高组出现在DHA/EPA比例为1.51时。同样,饲料系数及成活率在各实验组间也无显著性差异(P>0.05)。
2.2 饲料DHA/EPA比例对虎龙斑幼鱼肌肉脂肪酸组成的影响(见表5)

表5 饲料DHA/EPA比例对虎龙斑幼鱼肌肉脂肪酸组成的影响(%)
由表5可知,饲料DHA/EPA比例影响虎龙斑幼鱼肌肉脂肪酸组成,其中饱和脂肪酸含量随着DHA/EPA比例升高而总体呈现下降趋势,而Σn-6 PUFA则总体呈现上升的趋势。实验鱼DHA/EPA比例与饲料中DHA/EPA比例呈现正相关,其比例随饲料中DHA/EPA比例升高而升高。
2.3 饲料DHA/EPA比例对虎龙斑幼鱼肝脏脂肪沉积的影响(见图1)
如图1油红染色切片所示,饲料DHA/EPA比例影响虎龙斑幼鱼肝脏脂肪沉积。由图1(g)可知,摄食较低DHA/EPA比例(0.54、0.97)饲料的实验组鱼体肝脏脂滴沉积显著高于其他各实验组(P<0.05),而DHA/EPA比例由1.51升高到2.85时,并未对肝脏脂滴沉积产生显著影响(P>0.05)。

图1 摄食不同DHA/EPA比例饲料虎龙斑幼鱼肝脏油红染色切片[目镜10×,物镜40×,脂滴:红色,细胞核:蓝色),数值以“平均值±标准误”(n=6)表示]
2.4 饲料DHA/EPA比例对虎龙斑幼鱼肝脏脂肪代谢相关基因表达的影响(见图2)
如图2所示,脂肪合成代谢相关基因FAS和ACC受饲料DHA/EPA比例影响。其中较低比例(0.54、0.97)实验组鱼体肝脏FAS基因表达量显著高于1.51、2.01和2.85实验组(P<0.05);同样,较低比例(0.54、0.97)实验组鱼体肝脏ACC基因表达量显著高于其他各实验组(P<0.05),而2.41实验组ACC基因表达量最低,显著低于除2.85实验组外的其他各实验组(P<0.05)。SREBP1和CPT1α基因在各实验组鱼体肝脏中表达差异不显著(P>0.05)。PPARα基因表达量在较低DHA/EPA比例(0.54、0.97)实验组显著下调(P<0.05),而DHA/EPA比例1.51~2.85实验组间差异不显著(P>0.05)。饲料DHA/EPA比例为1.51和2.01实验组虎龙斑幼鱼肝脏HSL基因表达量显著高于其他各实验组(P<0.05),而DHA/EPA比例为0.54实验组鱼体肝脏HSL基因表达最低,且与除0.97实验组外的其他各实验组间有显著性差异(P<0.05)。

图2 饲料不同DHA/EPA比例对虎龙斑幼鱼肝脏脂肪合成(a)与分解(b)相关基因表达的影响
3 讨论
3.1 饲料DHA/EPA比例对虎龙斑幼鱼生长性能的影响
海水肉食性鱼类生长所需n-3 PUFA通常由食物摄入,且适宜水平DHA和EPA对于维持鱼体生长及正常生理功能至关重要[12]。本实验结果表明,饲料中最低DHA/EPA比例(0.54)实验组虎龙斑幼鱼增重率最低,但各组间差异不显著。同样在军曹鱼(Rachycen⁃tron canadum)[13]和黑鲷(Acanthopagrus schlegelii)[14]研究结果中也显示饲料DHA/EPA比例对鱼体生长并未产生显著影响。斜带石斑鱼中的研究显示DHA/EPA比例为1或者2时,鱼体生长最佳,优于较低比例组[10];而点带石斑鱼的研究表明,鱼体生长随着饲料DHA/EPA比例升高而不断增加,比例为3.0时增重最高[11]。
3.2 饲料DHA/EPA比例对虎龙斑幼鱼肌肉脂肪酸组成的影响
海水鱼类是人类重要的多不饱和脂肪酸来源,而鱼体肌肉脂肪酸组成通常受到饲料脂肪酸组成的影响[15]。本实验结果显示鱼体肌肉脂肪酸中饱和脂肪酸和单不饱和脂肪酸较好地反映了饲料中这两种脂肪酸的组成和含量,在斜带石斑鱼[16]和驼背鲈(Crom⁃ileptes altivelis)[17]的研究中也呈现出类似的实验结果。然而鱼体肌肉中n-6 PUFA含量要高于饲料中相应脂肪酸量,同时肌肉n-3脂肪酸含量低于饲料中n-3 PUFA含量,其中亚油酸(LA)和亚麻酸(ALA)在肌肉中的含量比饲料中的高,表明此种脂肪酸在肌肉中得到了沉积和保留。不同实验组肌肉中DHA和EPA含量变化趋势与饲料中DHA和EPA添加水平密切相关,但肌肉中DHA和EPA含量均低于饲料中含量。有研究表明,EPA由于与线粒体中的β氧化过程密切相关,从而易于在肌肉中氧化分解,而饲料中DHA含量过高时也倾向于氧化供能[18]。与尖吻鲈(Lateo⁃labrax japonicus)[19]中的实验结果类似,本实验中鱼体肌肉DHA/EPA比例也高于饲料中DHA/EPA比例。
3.3 饲料DHA/EPA比例对肝脏脂肪代谢相关基因表达的影响
肝脏是鱼类脂质代谢的重要器官,能够维持动物体能量平衡,但异常的脂质沉积会危害鱼体健康[20]。虽然研究显示DHA和EPA在动物体脂质代谢中发挥着重要作用[21],但有关DHA/EPA比例对鱼类脂质代谢影响的研究仍然十分有限。实验研究结果表明,摄食较低DHA/EPA比例(0.54和0.97)饲料鱼体肝脏中脂质积累显著高于其他实验组,这与在牙鲆(Platichthys stellatus)中的研究结果一致[22];在黑鲷中的报道同样发现摄食较低DHA/EPA比例饲料实验鱼体肝体比显著高于其他实验组[14]。然而在舌鳎(Lateolabrax japonicus)中的研究结果表明,适宜DHA/EPA比例增加了脂肪在肝脏中的沉积,但未对鱼体生长和健康造成不利影响[19]。Shang等[23]研究表明DHA/EPA通过调节脂肪酸氧化及脂肪合成相关基因从而影响动物体内脂质积累。本实验结果显示,摄食较低DHA/EPA比例(0.54和0.97)饲料实验鱼肝脏脂肪合成关键酶FAS和ACC基因表达显著上调,而脂肪分解相关基因PPARα显著下调,同时HSL基因在摄食最低DHA/EPA比例(0.54)饲料实验鱼中显著下调。在草鱼的研究中也发现摄食较低DHA/EPA比例饲料时鱼体肝脏PPARα基因表达量降低[24]。然而,在对黑鲷的研究中显示,摄食较低DHA/EPA比例饲料实验组(0.54和0.97)ACC基因表达下调。另外在舌鳎研究中显示,饲料适宜水平DHA/EPA比例显著上调ACC和FAS基因表达。以上研究结果表明对于虎龙斑幼鱼而言,DHA含量较少时,抑制脂肪分解以及促进脂肪生成,DHA对于抑制肝脏脂肪过度沉积发挥着重要作用。
4 结论
本实验条件下饲料DHA/EPA比例(0.54~2.85)对虎龙斑幼鱼生长性能没有显著影响。但当DHA/EPA比例较低时(0.54),虎龙斑幼鱼肝脏脂质代谢(脂质生成和脂质分解)相关基因表达受到显著影响,从而促进了脂肪在肝脏的沉积。
