基于超声联合血清学指标的列线图模型早期预测乳腺癌术后化疗患者心脏毒性风险
2021-09-04李英华蒋金全崔文婷笪应芬
李英华 郭 强 蒋金全 曾 军 崔文婷 刘 怡 笪应芬
蒽环类化疗药物在发挥高效抗肿瘤作用的同时也带来了较严重的心脏毒性。化疗药物引起的心脏毒性具有进展性和不可逆性,因此早期监测和调整化疗方案能够减少心脏毒性事件发生[1]。已有指南[2]将左室射血分数(LVEF)减少超过10%作为诊断化疗相关心脏毒性的截断值。但实际上LVEF用于早期诊断心脏毒性常不敏感,化疗药物导致的左室舒张功能受损、左室顺应性减低及僵硬度增加往往早于LVEF变化[3-4]。目前有研究[5-7]基于组织多普勒、心肌MRI、三维超声心动图、血清学指标检测等检查手段提出了多项用于监测心脏毒性的指标,如心肌做功指数、心肌细胞外容积、左房容积、N末端B型利钠肽前体(NT-proBNP)等。然而这些检测方法由于准确性有限或难以大范围普及等原因均存在一定的局限性。为探索一种能够及早发现心脏毒性发生的方法,本研究拟基于常规超声心动图及血清学检测指标建立列线图预测模型,旨在早期预测乳腺癌患者化疗期间出现心脏毒性的风险。
资料与方法
一、研究对象
选取2017年8月至2019年8月在我院乳腺外科经术后病理确诊为乳腺癌,且在我院接受蒽环类药物化疗的女性患者148例,年龄25~65岁,平均(47.83±7.29)岁;病理类型均为浸润性导管癌。纳入标准:①25岁以上女性乳腺癌患者;②同期未接受放射治疗;③患者化疗前常规心脏超声及心功能评价未见异常,且预计其生存期>24个月;④东部肿瘤协作组(ECOG)评分≤2分;⑤临床资料完整。排除标准:①既往有其他肿瘤病史或接受过其他抗肿瘤治疗;②既往有高血压病及糖尿病等病史;③患有胸廓及脊柱畸形、呼吸系统疾病等影响超声图像质量者。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.超声心动图检查:使用GE Vivid E 95、E 9彩色多普勒超声诊断仪,M5SC相控阵探头,频率1.4~4.6 MHz。患者取左侧卧位,平静呼吸。获取胸骨旁左室长轴标准切面M型超声心动图像,测量左室舒张期内径(LVDd)、左室收缩期内径(LVDs)、左房内径(LAd)。调整探头,获取标准心尖四腔心切面和两腔心切面,记录二尖瓣舒张早晚期峰值流速比值(E/A)、双平面Simpson法记录LVEF、E与二尖瓣环侧壁组织运动速度(e’)比值、左室短轴缩短率(LVFS)。在常规超声心动图的基础上连接心电图,连续采集左室心尖四腔心、两腔心和三腔心切面至少3个心动周期的动态图像,通过二维斑点追踪(2D-STI)及EchoPAC工作站对患者心内膜进行描记,获得左室收缩期整体纵向峰值应变(GLS)及应变率(GLSR)。以上操作均由两名具有10年以上工作经验的超声医师共同协商完成。
2.血清学指标测定:患者抽取空腹肘静脉血于4℃下按10 000 r/min离心5 min,取上清液用于检测。采用西门子ADVIA Centaur CP全自动化学发光免疫分析仪及配套试剂检测肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、B型利钠肽(BNP)、高敏感性心肌肌钙蛋白I(hs-cTnI)、NT-proBNP水平。检测流程严格按照仪器及试剂盒说明书。
3.治疗方案:所有患者在我院行乳腺癌根治术,术后2周开始接受以蒽环类药物为主的联合化疗方案。其中蒽环类药物(盐酸多柔比星,辉瑞制药有限公司,国药准字:H20000496)用药剂量为50 mg/m2,每次化疗间隔21 d,均完成4个化疗周期。根据以往文献[7-8]报道,接受化疗的患者血清学指标及影像学指标多于化疗第3周期开始出现有统计学意义的差异。因此本研究记录化疗前及化疗第3周期后的血清学及超声心动图指标,计算化疗前后的差值(ΔCK、ΔCK-MB、ΔBNP、Δhs-cTnI、ΔNT-proBNP、ΔLVEF、ΔLAd、ΔLVDd、ΔLVDs、ΔLVFS、ΔE/e’、ΔE/A、ΔGLS、ΔGLSR),并进行分析,以预测潜在的心脏毒性。
4.随访:在4个周期化疗全部结束后,所有患者每隔3个月进行一次门诊随访,共随访1年。随访时,使用超声心动图检测患者LVEF,终点事件定义为随访期间发现ΔLVEF>10%(ΔLVEF=化疗前LVEF-化疗后LVEF),则纳入毒性组,若患者随访结束时仍然ΔLVEF≤10%则纳入无毒性组。分析两组的基线资料、血清学指标、常规超声心动图及2D-STI指标的差异。
三、统计学处理
结 果
直至随访结束,148例患者中共失访2例,其中128例至随访结束仍然未发生终点事件,平均LVEF为(62.72±4.29)%,纳入无毒性组;18例出现终点事件,平均LVEF为(55.25±5.83)%,纳入毒性组。Kaplan-Meier生存曲线显示,随着时间延长,全体患者中ΔLVEF>10%的出现例数增多,在随访的第6个月和9个月发生心脏毒性的例数增长较为明显,其总体出现心脏毒性的概率为12.3%。见图1。
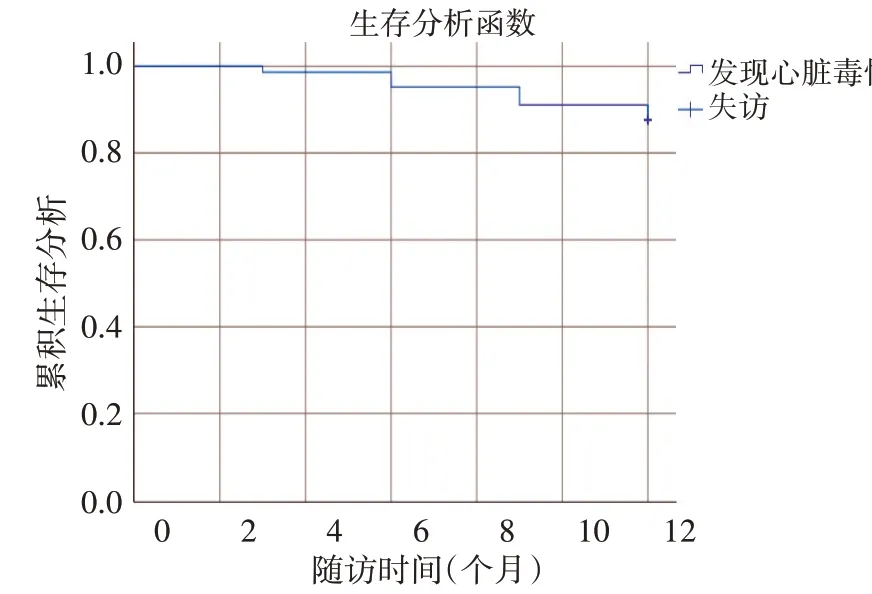
图1 患者心脏毒性发生情况(Kaplan-Meier法)
一、两组患者基线资料、血清学指标、超声心动图指标比较
毒性组患者除年龄水平明显高于非毒性组,差异有统计学意义(P=0.048)外,其余资料比较差异均无统计学意义。化疗前两组患者血清学及超声心动图指标比较差异均无统计学意义。化疗第3周期后,两组ΔNT-proBNP、Δhs-cTnI、ΔGLS比较差异均有统计学意义(均P<0.05)。见表1~3和图2。
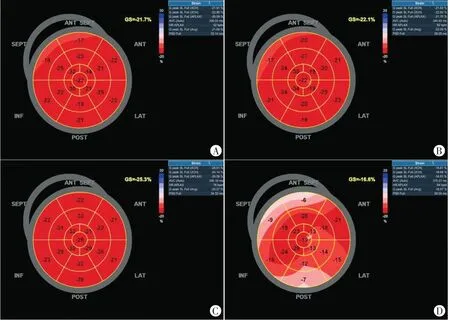
图2 无毒性组和毒性组患者2D-STI图像
表1 无毒性组与毒性组患者基线资料比较(±s)
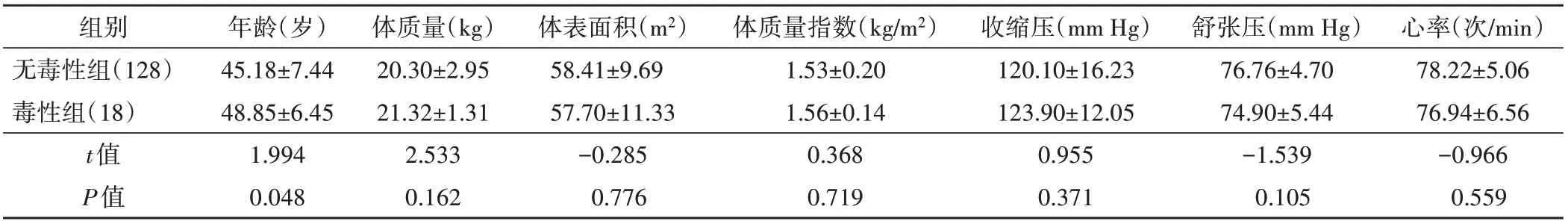
表1 无毒性组与毒性组患者基线资料比较(±s)
1 mm Hg=0.133 kPa
组别无毒性组(128)毒性组(18)t值P值体质量指数(kg/m2)1.53±0.20 1.56±0.14 0.368 0.719体表面积(m2)58.41±9.69 57.70±11.33-0.285 0.776心率(次/min)78.22±5.06 76.94±6.56-0.966 0.559年龄(岁)45.18±7.44 48.85±6.45 1.994 0.048体质量(kg)20.30±2.95 21.32±1.31 2.533 0.162收缩压(mm Hg)120.10±16.23 123.90±12.05 0.955 0.371舒张压(mm Hg)76.76±4.70 74.90±5.44-1.539 0.105
二、提示早期心脏毒性的潜在指标分析
表2 无毒性组与毒性组患者化疗前血清学及超声心动图指标比较(±s)

表2 无毒性组与毒性组患者化疗前血清学及超声心动图指标比较(±s)
CK:肌酸激酶;CK-MB:肌酸激酶同工酶;BNP:B型利钠肽;hs-cTnI:高敏感性心肌肌钙蛋白I;NT-proBNP:N末端B型利钠肽前体;LVEF:左室射血分数;LAd:左房内径;LVDd:左室舒张期内径;LVFS:左室短轴缩短率;E/e’:二尖瓣舒张早期峰值流速与二尖瓣环侧壁组织运动速度比值;E/A:二尖瓣舒张早、晚期峰值流速比值;GLS:整体纵向峰值应变;GLSR:整体纵向峰值应变率
血清学指标超声心动图指标组别E/e’6.56±0.84 6.60±0.77 E/A 1.51±0.57 1.45±0.32 CK-MB(U/L)11.95±2.09 12.26±1.90 GLS(%)-21.52±1.45-21.18±1.49 GLSR(s-1)-1.39±0.21-1.38±0.20 BNP(ρg/ml)49.58±29.89 53.68±29.37 CK(U/L)38.95±4.56 40.48±4.35 hs-c TnI(ρg/ml)11.22±2.32 10.97±3.13 NT-proBNP(ng/ml)25.85±2.12 24.54±3.15 LVEF(%)66.15±6.21 64.37±4.94 LAd(mm)3.33±0.61 3.24±0.43 LVDd(mm)4.86±0.71 4.59±0.85 LVDs(mm)25.34±5.48 25.34±5.99 LVFS(%)33.71±3.68 36.39±3.86无毒性组毒性组
表3 无毒性组与毒性组患者化疗前与化疗3周期血清学及超声心动图指标差值比较(±s)
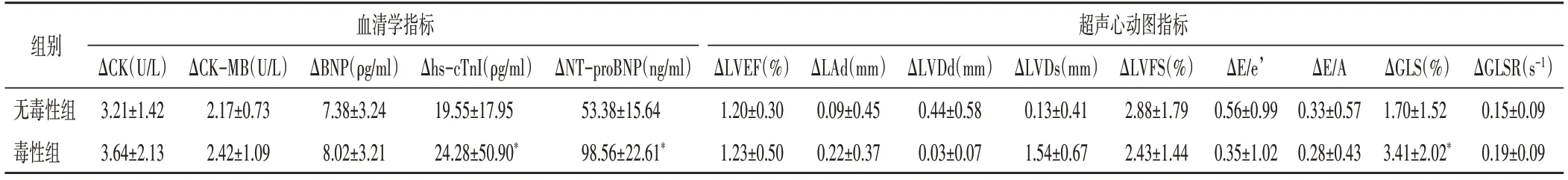
表3 无毒性组与毒性组患者化疗前与化疗3周期血清学及超声心动图指标差值比较(±s)
与无毒性组比较,*P<0.05。ΔCK:肌酸激酶差值;ΔCK-MB:肌酸激酶同工酶差值;ΔBNP:B型利钠肽差值;Δhs-cTnI:高敏感性心肌肌钙蛋白I差值;ΔNT-proBNP:N末端B型利钠肽前体差值;ΔLVEF:左室射血分数差值;ΔLAd:左房内径差值;ΔLVDd:左室舒张期内径差值;ΔLVFS:左室短轴缩短率差值;ΔE/e’:二尖瓣舒张早期峰值流速与二尖瓣环侧壁组织运动速度比值差值;ΔE/A:二尖瓣舒张早、晚期峰值流速比值差值;ΔGLS:整体纵向峰值应变差值;ΔGLSR:整体纵向峰值应变率差值
血清学指标超声心动图指标组别ΔCK-MB(U/L)2.17±0.73 2.42±1.09 ΔE/e’0.56±0.99 0.35±1.02 ΔE/A 0.33±0.57 0.28±0.43 ΔGLS(%)1.70±1.52 3.41±2.02*ΔBNP(ρg/ml)7.38±3.24 8.02±3.21 Δhs-c TnI(ρg/ml)19.55±17.95 24.28±50.90*ΔNT-proBNP(ng/ml)53.38±15.64 98.56±22.61*ΔLVEF(%)1.20±0.30 1.23±0.50 ΔLAd(mm)0.09±0.45 0.22±0.37 ΔLVDd(mm)0.44±0.58 0.03±0.07 ΔLVDs(mm)0.13±0.41 1.54±0.67 ΔLVFS(%)2.88±1.79 2.43±1.44 ΔGLSR(s-1)0.15±0.09 0.19±0.09无毒性组毒性组ΔCK(U/L)3.21±1.42 3.64±2.13
通过单因素COX回归分析发现,年龄、ΔNT-proBNP、Δhs-cTnI、ΔGLR 4项指标是筛选早期心脏毒性的潜在指标(P<0.1)。对以上潜在指标进行进一步的多因素COX回归分析发现,Δhs-cTnI、ΔNTproBNP和ΔGLS可独立提示接受化疗的乳腺癌患者出现心脏毒性的风险。见表4。

表4 提示患者发生心脏毒性风险的潜在指标
三、列线图预测模型的建立与评价
基于多因素分析结果建立用于预测心脏毒性风险的列线图,见图3。将各指标在图中对应的轴上找到对应的点,然后通过该点做垂直于横轴的直线,该直线在评分标尺上的交点读数即为该指标的分数。将各指标的分数相加即为总分,按照同样的方法,总分在风险值上的交点读数即为该患者发 生心脏毒性的概率。列线图的C-index为0.904,显示出良好的辨别力(>0.75),且校准测试表明无明显的偏离(χ2=8.170,P=0.417,Hosmer-Lemeshow检验)。
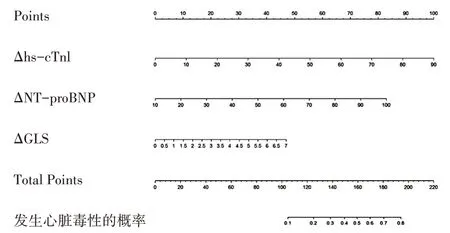
图3 提示患者发生心脏毒性风险的列线图
四、ROC曲线分析
ROC曲线分析显示,列线图预测心脏毒性的曲线下面积(0.904)显著高于ΔGLS、ΔNT-proBNP及ΔhscTnI单独诊断的曲线下面积(0.864、0.709、0.704),差异均有统计学意义(均P<0.05)。见图4。

图4 ΔGLS、Δhs-cTnI、ΔNT-proBNP及列线图预测早期心脏毒性风险的ROC曲线图
讨 论
化疗药物导致的心脏毒性严重影响乳腺癌患者的预后。早期的心脏毒性往往是可逆的,及早对心脏毒性进行准确预测,采取干预措施对于减轻心脏损伤有重要意义。心内膜活检是目前评估化疗药物所致心脏毒性敏感性和特异性最高的方法,但由于其为有创检查,临床应用率低[9]。血清心肌标志物虽敏感性较高,但特异性不高,诊断价值有限。组织多普勒虽然较常规超声心动图更敏感,但其存在角度依赖性,重复性欠佳,能否进一步应用于临床诊断心脏毒性仍需进一步探究。三维超声心动图、三维斑点追踪技术等尽管能克服以上缺点,但其在各级医院普及程度不高,临床推广价值有限。2D-STI是一项能够量化心肌功能的技术,无角度依赖性、可重复性好被广泛应用于心脏功能的评估。本研究采用ΔGLS评估早期心脏功能改变,并联合Δhs-cTnI、ΔNT-proBNP的列线图预测接受化疗的乳腺癌患者发生心脏毒性风险,以期及早发现并干预化疗药物导致的心脏损伤。
早期化疗药物导致的心肌损伤轻微,由于心脏强大的代偿机制,往往难以检测出心脏受损后产生的细微差异。为了能够及时发现这些变化,早期预测化疗药物导致的心脏毒性,根据患者发生心脏毒性的概率及时调整化疗方案,本研究通过多因素COX回归分析结果显示ΔNT-proBNP、Δhs-cTnI及ΔGLS是提示患者早期出现心脏毒性的独立风险指标。而临床其他常用的评估心脏功能指标均非独立风险指标,难以用于早期心脏毒性的诊断,这亦反映出目前临床早期评估心脏毒性具有困难性。
多因素分析结果提示化疗第3个周期后ΔNTproBNP、Δhs-cTnI水平升高可以作为预测心脏毒性的有效指标。与BNP相比,NT-proBNP半衰期更长,稳定性更好,敏感性更高,更适合于临床应用[10]。Kara等[11]研究表明,NT-proBNP在发现无症状性左室功能异常,以及诊断轻微的收缩或舒张期心力衰竭方面,较常规超声学指标更有优势。hs-cTnI在预测接受蒽环类药物化疗的乳腺癌患者心脏毒性中也具有较高价值[12-13]。Cardinale等[14]以80 ng/L作为hs-cTnI检测阈值,经过为期3年的随访发现,接受化疗期间hs-cTnI升高的患者中心力衰竭等心脏毒性症状发生率为44%,而hs-cTnI未明显升高的患者中,发生率仅为0.1%。这也提醒临床医师在化疗期间需密切关注患者血清NT-proBNP、hs-cTnI,对于保护患者的心脏功能,以及提高患者预后有的重要指导意义。
本研究使用2D-STI技术对左室心肌进行定量分析,发现化疗第3周期毒性组患者ΔGLS值较无毒性组显著下降(P<0.05)。欧洲心脏病学会在2016版指南中推荐,将ΔGLS>15%作为提示化疗所致心脏毒性的指标[15]。目前多推荐将GLS≥-19%作为正常的截断值[16]。本研究认为,患者本身可能存在基础的心血管系统疾病,对GLS会造成一定影响。若仅依靠GLS≥-19%作为正常的截断值来预测患者是否会发生心脏毒性并不准确。通过对比化疗前后GLS下降幅度,以患者自身为参照不受基础疾病的影响,预测蒽环类药物所致心脏毒性更准确,更适合于临床应用。
本研究基于统计分析所得独立风险指标,首次构建预测化疗药物所致心脏毒性风险的列线图,其预测早期心脏毒性风险的准确性出色(C-index=0.904),且与实际发生情况一致性较好。Chang等[17]和Florescu等[18]使用分层斑点追踪技术发现患者最早于化疗的第3周期发现心内膜纵向应变发生明显改变,敏感性和特异性均较高,可以作为预测早期心脏毒性的指标。同样是在化疗的第3周期,Fatima等[19]通过99mTC多门控扫描测量发现,ΔLVEF为5%即可提示患者发生心脏毒性。尽管以上方法均可在化疗早期发现心脏毒性,但是由于技术要求高,在基层医院无法开展,且对于患者而言重复检查价格昂贵,以上方法均未作为首选或常规检查方案。Dranitsaris等[20]根据患者累积化疗周期数、患者年龄和体质量等资料建立了评估发生心脏毒性风险的预测模型,ROC的曲线下面积为0.84。相较传统预测模型,列线图可以联合多个临床上常用且易于开展的常规检查指标,量化为心脏毒性发生率,为临床医师提供简易且较准确的诊断工具。如当患者Δhs-cTnI为50ρg/ml、ΔNT-proBNP为70 ng/ml、ΔGLS为6%时,列线图的总分约为150分,提示该患者发生心脏毒性的概率约40%。临床医师可以据此选择适当的治疗方式,有助于临床及早干预、及时调整治疗方案,避免或降低不可逆性心脏损伤的可能性。
综上所述,ΔGLS联合ΔNT-proBNP及Δhs-cTnI绘制的列线图有助于早期评估使用化疗药物患者发生心脏毒性的风险,有望帮助临床及时准确诊断及干预化疗药物所致的可逆性心脏损伤。后期尚需前瞻性、大样本、多中心研究对列线图的准确性和可靠性进一步验证。
