超微血流成像半定量分级在前列腺癌检出中的应用价值
2021-09-04洪睿霞冉海涛
洪睿霞 李 芳 周 航 冉海涛
我国前列腺癌的发病率居男性恶性肿瘤第6位,死亡率居第7位[1]。随着生活水平的提高及人口老龄化等因素的影响,其发病率及死亡率逐年上升。及早检出前列腺癌,改善患者诊治状况,提高前列腺癌的疗效,是目前临床亟需解决的问题。前列腺癌的生长依赖于肿瘤血管的生成,其组织内微血管的数量显著高于前列腺良性组织增生[2-3],超声超微血流成像(superb microvascular imaging,SMI)是一种全新的血管成像方式,能清晰显示病灶内部的低速血流。前列腺特异性抗原(prostate specific antigen,PSA)是前列腺癌筛查和诊断的特异性标志物,已广泛应用于临床。本研究应用SMI技术检测前列腺病灶内微血管的数量,同时联合PSA以期达到提高前列腺癌早期检出率的目的。
资料与方法
一、研究对象
选取2019年1~11月重庆大学附属肿瘤医院行超声引导下前列腺穿刺活检者129例,其中前列腺癌89例(PCa组),年龄56~88岁,平均(71.60±6.30)岁;良性病变40例(非PCa组),年龄48~86岁,平均(66.68±9.70)岁,包括前列腺增生34例、前列腺增生伴前列腺炎5例、前列腺神经鞘瘤1例。排除行前列腺癌化疗、放疗等治疗或前列腺相关手术者。本研究经重庆大学附属肿瘤医院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.仪器:使用东芝Aplio 500彩色多普勒超声诊断仪,PVT-781VT探头,频率4~11 MHz。焦点位于前列腺深面。
2.SMI检查方法及半定量分级标准:患者取左侧卧位,从前列腺尖部至底部依次逐层扫查,保持手法稳定、探头轻放,以便清晰显示前列腺组织内的微细血流情况。记录可疑病灶位置,可疑病灶常规超声表现:①外周带局限性增厚或回声不均;②外周带低回声结节;③内外腺分界不清;④移行带伴或不伴细密钙化的不规则低或等回声区。可疑病灶SMI超声表现为:①不对称血流;②异构丰富血流。所有患者仅选取一个最可疑区域作为SMI评价靶区。采用Adler血流分级[4]及滑膜半定量评分系统(SQSS)的血流占比评价方式[5],将可疑病灶内部微细血流行半定量分级,评级标准:①0级,病灶内未见微细血流;②1级,病灶内探及稀疏1~2个点状血流信号;③2级,病灶内部探及3~4条短线状血流、分布占比未超过病灶最大截面的50%;④3级,病灶内探及4条以上血流、分布占比超过病灶最大截面的50%。由5年以上前列腺疾病超声诊断经验的医师在不知道病理结果的情况下评估病灶内部血流,并按标准行SMI半定量分级。
3.实验室指标检测:在前列腺超声检查前抽取患者血液,检测总前列腺特异性抗原(tPSA)、游离前列腺特异性抗原(fPSA)。
三、统计学处理
结 果
一、两组一般资料及SMI半定量分级分布比较
两组年龄、tPSA、fPSA及SMI半定量分级分布比较,差异均有统计学意义(均P<0.05)。见表1。各级SMI声像图见图1~4。

图1 前列腺增生患者(62岁)常规超声图像(A)及SMI图像(B),常规超声未发现可疑病灶,SMI 0级。tPSA为7.90 ng/ml,fPSA为0.84 ng/ml
表1 两组一般资料及SMI半定量分级分布比较(±s)
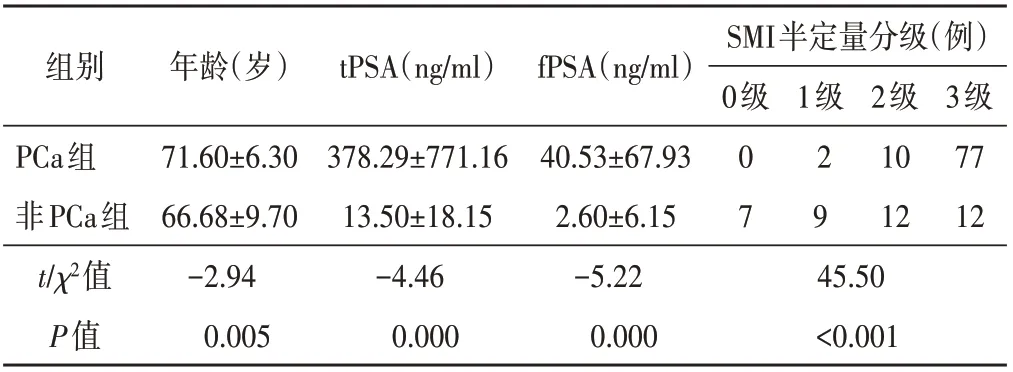
表1 两组一般资料及SMI半定量分级分布比较(±s)
tPSA:总前列腺特异性抗原;fPSA:游离前列腺特异性抗原
组别年龄(岁)t PSA(ng/ml)fPSA(ng/ml)SMI半定量分级(例)0级1级PCa组非PCa组t/χ2值P值71.60±6.30 66.68±9.70-2.94 0.005 378.29±771.16 13.50±18.15-4.46 0.000 40.53±67.93 2.60±6.15-5.22 0.000 0 7 2 9 2级10 12 3级77 12 45.50<0.001

图2 前列腺增生患者(78岁)常规超声图像(A)及SMI图像(B),常规超声显示左侧叶体部外周带局限性回声减低,SMI 1级。tPSA为4.45 ng/ml,fPSA为1.02 ng/ml

图3 前列腺癌患者(68岁)常规超声图像(A)及SMI图像(B),常规超声未发现可疑病灶,SMI扫查时发现非对称血流,SMI 2级,Gleason评分3+4=7分。t PSA为8.08 ng/ml,fPSA为0.78 ng/ml
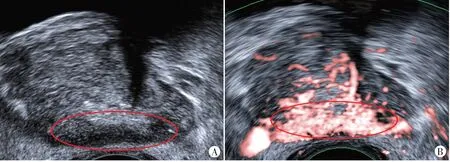
图4 前列腺癌患者(85岁)常规超声图像(A)及SMI图像(B),常规超声显示前列腺外周带增厚、回声减低、内外腺分界不清,SMI 3级,Gleason评分5+5=10分。tPSA为56.00 ng/ml,fPSA为16.00 ng/ml
二、Logistic回归分析结果
经逐步Logistic回归分析,tPSA、fPSA及SMI半定量分级均对前列腺癌的诊断密切相关(P<0.05),Logit(P)=1.489*tPSA+1.666*fPSA+1.515*SMI半 定 量 分级-4.449。见表2。
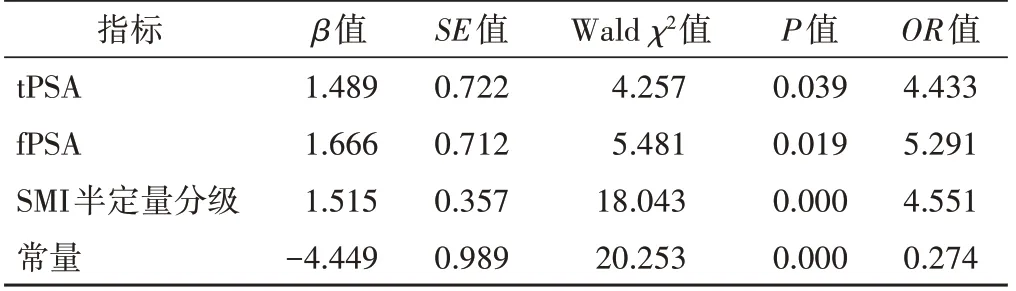
表2 tPSA、f PSA、SMI半定量分级的Logistic回归分析结果
三、t PSA、fPSA、SMI半定量分级单独及联合诊断预测前列腺癌的诊断效能
tPSA、fPSA、SMI半定量分级诊断前列腺癌的敏感性分别为80.9%、83.1%、86.5%,特异性分别为82.5%、75.0%、70.0%,曲线下面积分别为0.880、0.855、0.804;三者联合诊断的敏感性和特异性为82.0%、90.0%,曲线下面积为0.913,均高于单独指标诊断效能。见表3和图5。
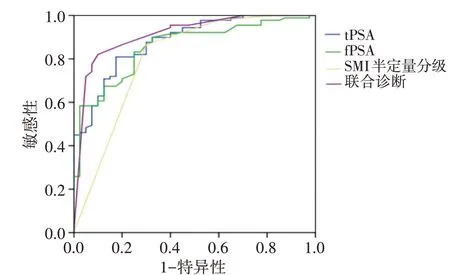
图5 tPSA、fPSA、SMI半定量分级及联合诊断预测前列腺癌的ROC曲线图
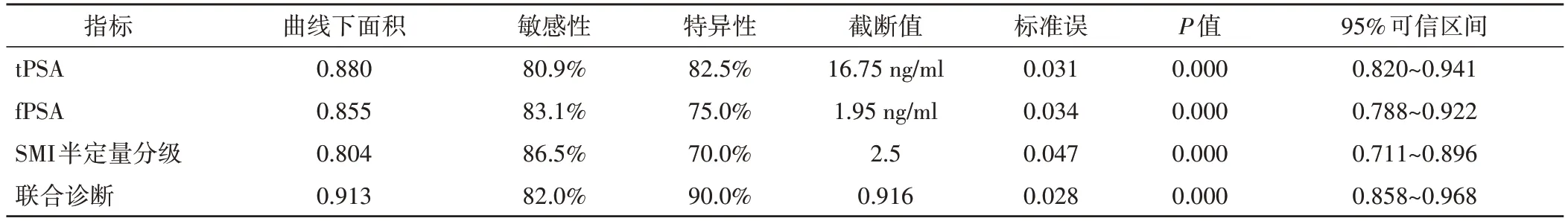
表3 tPSA、f PSA、SMI半定量分级和联合诊断预测前列腺癌的诊断效能
讨 论
前列腺穿刺活检是目前诊断前列腺癌的金标准,穿刺活检的适应证又是基于直肠指检、PSA及影像学检查的指导,前列腺穿刺中国专家共识[6]推荐其中任一指标阳性即可采取穿刺活检获得病理确诊,因此术前PSA及影像学检查至关重要。由于前列腺增生及前列腺炎等良性疾病也可导致PSA升高,另外MRI检查对设备要求高且费用昂贵,目前临床亟需一种方便且准确率高的检查手段来指导临床,避免漏诊前列腺癌。经直肠超声检查由于探头贴近前列腺,不受患者体型及肠道胀气等的影响,且不同个体之间成像效果差异较小,已广泛用于前列腺病变的常规超声检查及引导穿刺活检。但前列腺癌具有多灶性及分散性等特点,导致超声图像缺乏特征性,故常规超声难以高效地检出前列腺癌[7]。基于癌灶内部细胞密度与微血管密度的增加、组织内部动静脉短路,从而造成组织内出现异构血管等病理改变,CDFI可检出这类异构血管,但对微小低速血流的显示不及SMI[8]。SMI技术是基于多普勒原理发展起来的一种高分辨率血流显像技术,无需使用造影剂即可清晰、敏感地显示微血管低速血流信号[9]。本研究通过比较PCa组与非PCa组的SMI半定量分级发现,前列腺癌以SMI 3级表现为主,单独SMI诊断前列腺癌的曲线下面积为0.804,敏感性及特异性分别为86.5%及70.0%,这也再次印证了前列腺癌病灶内部由于新生血管密度的增加导致微细血流信号增多的病理改变。
临床上常将PSA用于前列腺癌的诊断、指导穿刺活检及风险预测等。刘毅豪等[10]通过绘制tPSA、前列腺特异性抗原密度、高迁移率族蛋白单独及联合诊断前列腺癌的ROC曲线,结果表明单独tPSA诊断前列腺癌的曲线下面积为0.911,联合诊断的曲线下面积为0.984。陈文颖等[11]将tPSA用于指导穿刺活检方式的选择,当患者tPSA为4~10 ng/ml时,可任一选择经会阴系统穿刺或与多参数磁共振认知融合穿刺方式;当tPSA≥10 ng/ml时,选择与多参数磁共振认知融合穿刺方式的效能更高。温健男等[12]纳入PSA及Gleason评分2个转移风险预测因素构建回归模型,该模型对转移风险的预测准确率达81.2%(69/85)。刘凤玲等[13]通过对健康体检者行PSA筛查前列腺癌,研究表明tPSA及fPSA与患者年龄相关,建议对40岁以上男性常规行tPSA及fPSA筛查。本研究应用Logistic回归分析,建立临床常用指标tPSA、fPSA及SMI半定量分级联合诊断模型,研究结果表明三者联合诊断的敏感性和特异性为82.0%、90.0%,曲线下面积为0.913,均高于单独指标诊断效能。
本研究的不足:①仅对病灶行SMI半定量分级,而未进一步评价病灶内血管架构及分布情况,由于部分前列腺癌生长过快,病灶内部出现出血及坏死等表现,SMI分级被低估而导致漏诊;②未分析外周带及移行区病灶的SMI表现差异,待扩大样本量进一步研究。
综上所述,在二维超声的基础上,SMI半定量分级在鉴别前列腺良恶性病灶上有一定应用价值,前列腺癌多表现为SMI 3级,良性病灶则表现多样。由于该技术的成熟性及操作简便性,可联合血PSA用于前列腺癌的早期筛查及诊断中。
