苦糖果愈伤组织诱导与不定芽分化研究
2021-09-03赵莹陈甘牛路兆军马旭升苗杰
赵莹 陈甘牛 路兆军 马旭升 苗杰
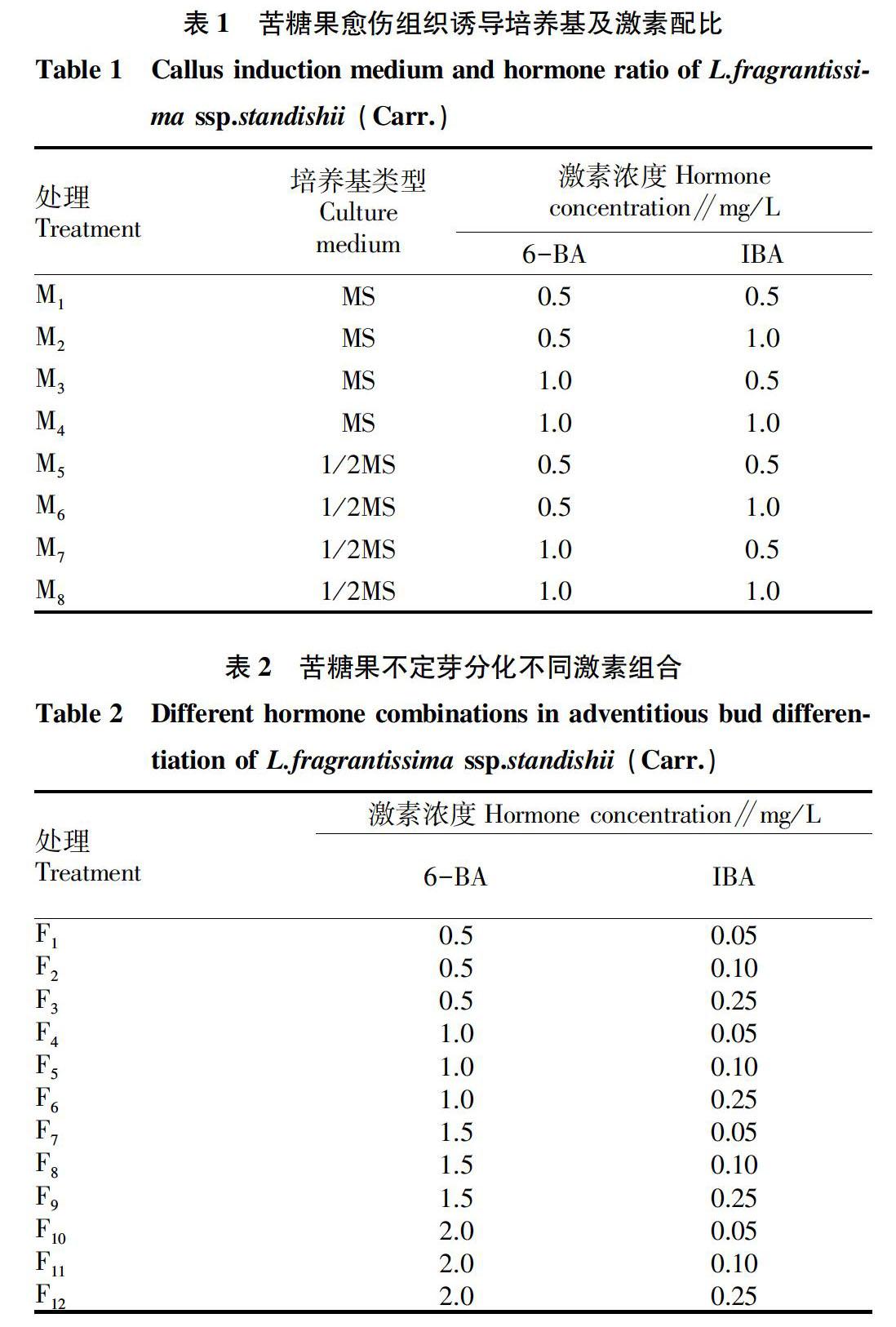
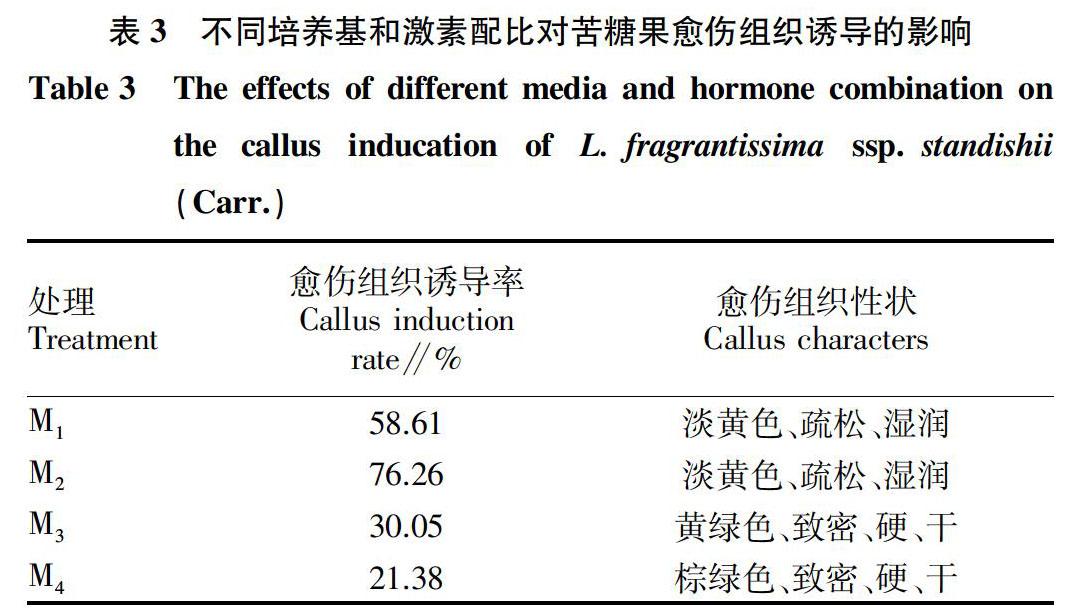
摘要 [目的]建立苦糖果再生体系,保存种质资源。[方法]以苦糖果种子诱导的幼嫩茎段为外植体,接种在附加6-BA、IBA等不同浓度植物激素和营养物质的培养基上,研究不同培养条件对愈伤组织诱导及不定芽分化的影响。[结果]在不同的培养基、激素种类和激素浓度条件下,愈伤组织的诱导形成有很大差异。相同浓度激素条件下,以MS为基本培养基可诱导出苦糖果愈伤组织,最佳配方为MS+6-BA 0.5 mg/L +IBA 1.0 mg/L,诱导率为76.26%,而1/2MS培养基上无愈伤组织出现。经过愈伤组织的增殖和分化培养,最佳分化培养基为MS+6-BA 1.0 mg/L +IBA 0.05 mg/L,芽分化率达67.40%。[结论]该研究实现了苦糖果愈伤组织诱导并获得再生植株,初步建立起苦糖果植株再生体系。
关键词 苦糖果;茎段;愈伤组织;不定芽;分化
中图分类号 S 723 文献标识码 A
文章编号 0517-6611(2021)14-0098-03
Abstract [Objective]To establish the regeneration system of L.fragrantissima ssp. standishii (Carr.) and preserve the germplasm resources.[Method]The young and tender stem segments induced from the seed of L.fragrantissima ssp. standishii (Carr.) were used as explants and cultured on medium supplemented with different kinds of plant hormones and nutrients.The effect of 6-BA,IBA and culture conditions for callus induction and adventitious bud differentiation were described respectively.[Result]Under the condition of the same concentration of hormone,MS as the basic medium could induce callus.The best formula was MS + 6-BA 0.5 mg/L + IBA 1.0 mg/L,the induction rate was 76.26%.However,there was no callus appeared when 1/2MS medium was used.After callus proliferation and differentiation culture,the best differentiation medium was MS + 6-BA 1.0 mg/L + IBA 0.05 mg/L,and the bud differentiation rate reached 67.40%.[Conclusion]In this study,callus induction and plant regeneration of L.fragrantissima ssp. standishii (Carr.) were achieved,and plant regeneration system was established.
Key words L.fragrantissima ssp. standishii (Carr.);Stem;Callus;Adventitious bud;Differentiation
基金項目 山东省重点研发计划(2018GNC113005)。
作者简介 赵莹(1989—),女,山东东营人,助理工程师,硕士,从事林业植物生理研究。*通信作者,工程师,硕士,从事森林培育和林木遗传育种研究。
收稿日期 2020-10-23
苦糖果[ Lonicera fragrantissima ssp. standishii (Carr.) Hsu et H.J.Wang],又名羊奶子、衩八果、裤裆果、驴驮布袋,忍冬科 (Caprifoliaceae) 忍冬属郁香忍冬的亚种[1]。该植物果实富含糖[1],色红汁甜,嫩枝叶还可入药,祛风除湿,清热止痛[2],还是优良的水土保持树种[3]。苦糖果在我国广泛分布,多生长于海拔100~2 000 m向阳坡地内或溪涧旁,现存植株大部分为野生种,人工集中种植较少,目前仅上海、杭州、武汉等地有零星栽培[4],致使其繁育的植物材料极其有限。为了保存苦糖果优良种质资源和尽早实现野生资源的开发和利用,采用组织培养进行有性繁殖,具有繁殖速度快,生长周期短,不受季节影响,保存量成数量级增长等优点,是短时间内解决资源短缺的有效途径之一[5]。目前,有关于苦糖果愈伤组织诱导及分化方面的研究国内鲜见报道,该研究利用苦糖果离体茎段进行愈伤组织诱导、增殖及分化,初步建立苦糖果植株再生体系,旨在为苦糖果野生种质资源保存和开发利用提供科学依据。
1 材料与方法
1.1 材料 供试材料取自烟台市林业科学研究所莱山曲村苗圃。
1.2 方法
1.2.1 种子灭菌和接种。种子脱毒根据朱建华等[6]的方法,取成熟饱满种子300粒浸泡24 h后置于超净工作台上用无菌滤纸吸干水分,70%乙醇浸泡30 s,再用0.2% HgCl2浸泡9 min,期间翻动材料,然后用无菌水冲洗4次,每次1 min左右,后将种子置于无菌滤纸上吸干水分。接种在MS空白培养基上,调节pH 为5.8,含蔗糖3%,琼脂0.7%,每瓶接种10粒种子,共25瓶。培养条件:光照强度1 500 lx,12 h光照,温度(25±1) ℃,约56 d后可长成4~5 cm的苗。
1.2.2 愈伤组织诱导。
将种苗切去叶片和根部,留取中间部分,切成0.3~0.5 cm的茎段,水平放置在培养基表面上,以1/2MS、MS为基本培养基,附加不同浓度6-BA与IBA组合,采用完全随机设计,设计不同培养基和激素浓度配比的培养基(表1),每瓶接种3个外植体,每组10瓶,调节pH为5.8,含蔗糖3%,琼脂0.7%,光照强度2 000~3 000 lx,12 h光照,温度(25±1) ℃,光照培养箱中培养。每7 d观察1次生长状况并作记录,21 d后统计愈伤组织外植体块数,统计愈伤组织诱导率。
愈伤组织诱导率=(产生愈伤组织外植体数/接入外植体数)×100%
1.2.3 分化培养基筛选及分化培养。
根据苦糖果愈伤组织诱导结果进行一次继代,设计愈伤组织分化培养基。以MS为基本培养基,附加不同浓度的6-BA及IBA,培养条件同“1.2.2”,各种浓度设置见表2。将继代的愈伤组织切成5 mm×5 mm,接入分化培养基,每瓶接种3块,每处理10瓶。每7 d 观察1次分化状况并作记录,50 d时统计各处理愈伤组织出芽情况。
愈伤组织分化率=(出芽的愈伤组织数/愈伤组织总数)×100%
2 结果与分析
2.1 苦糖果愈伤组织的诱导
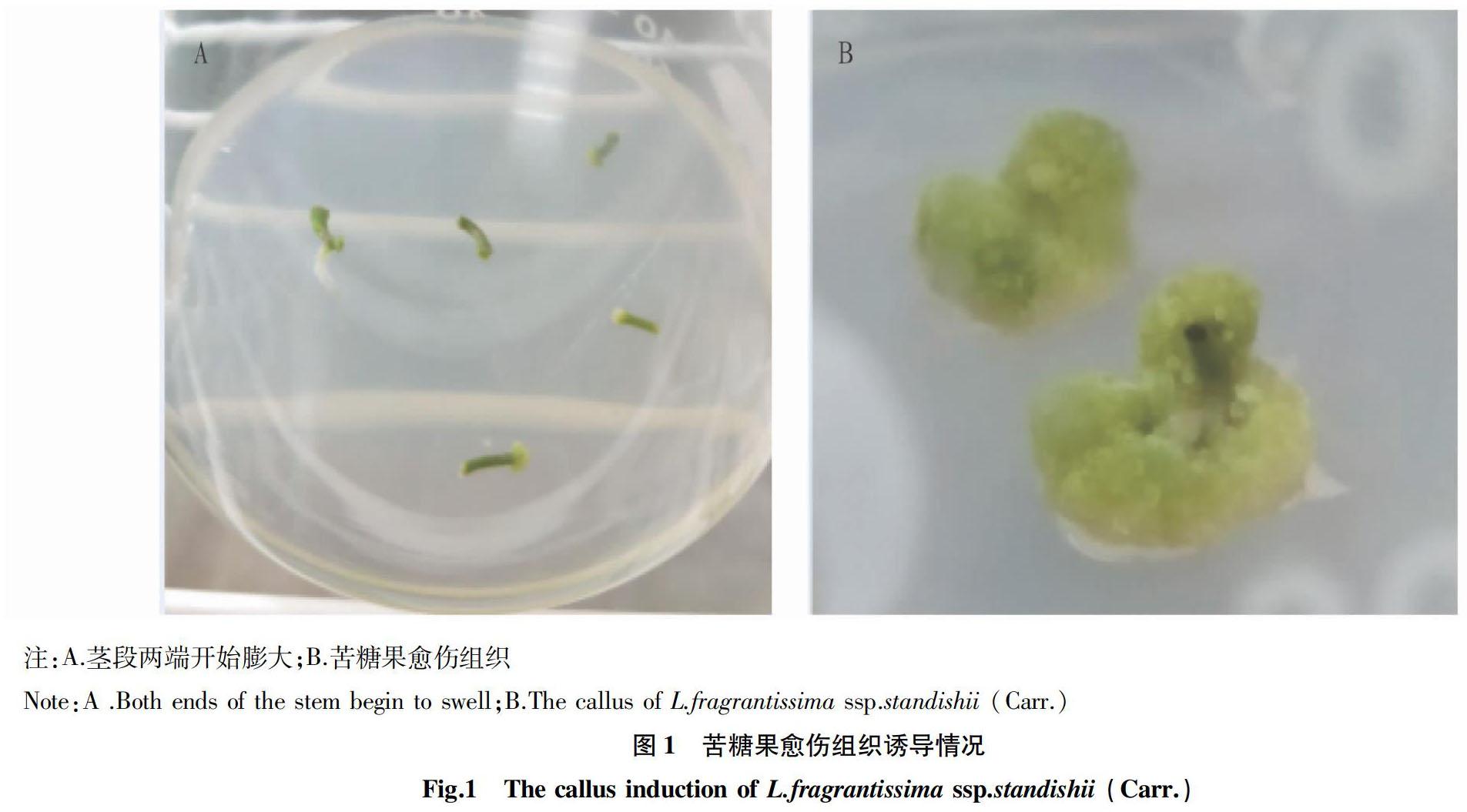
将茎段接种到8种培养基中进行愈伤组织诱导,培养42 d后,发现只有MS培养基可以诱导出愈伤组织,而1/2MS培养基上并未发现愈伤组织。培养14 d后,可以明显看到M2处理茎段两头开始出现透明膨大细胞(图1A),比较疏松,呈黄绿色,培养到第6周时,可以看到茎段形成明显的愈伤组织(图1B)。
由表3可知,不同浓度激素培养基上愈伤组织诱导率不同,M2处理诱导率最高,达76.26%;其次为M1处理,为58.61%,M4处理最低,仅21.38%。4种培养基产生的愈伤组织质量也不同,M1、M2处理的愈伤组织颜色呈淡黄色、颗粒状且质地紧密;而M3处理愈伤组织颜色较深,质地较硬,较干燥;M4处理愈伤组织玻璃化现象比较严重,呈半透明状,质量较差,愈伤组织上有根毛和芽的出現。M2处理诱导的愈伤组织适宜作为愈伤组织分化材料,因此选取M2处理诱导的愈伤组织进行分化试验。
2.2 苦糖果愈伤组织的分化
将M2处理诱导的愈伤组织进行芽的分化培养。经过约70 d的分化,愈伤组织上产生不定芽(图2)。表4结果显示,不同处理对愈伤组织芽分化影响明显。含有6-BA和IBA植物激素的处理中均有芽的出现,但是不同浓度诱导芽的分化率不同。以F4处理芽的分化率最高,达67.40%,其经过42 d的分化培养,分化出芽时间最快,质量最好,同时在附加1.0 mg/L 6-BA的培养基上(F4、F5、F6处理),芽的分化率普遍较高,数量较多,生长健壮,叶片呈现绿色;在附加0.5、2.0 mg/L 6-BA培养基上(F1、F2、F3和F10、F11、F12)的愈伤组织诱导率较低,但是在0.1 mg/L IBA浓度下(F2、F5、F8、F11处理)诱导的不定芽生长健壮,叶片较大,愈伤组织上少有不定根的产生,说明一定浓度的生长素可以提高愈伤组织不定芽的质量;附加2.0 mg/L 6-BA培养基的分生不定芽数量偏少,叶片细小且未展开,说明质量较差,这可能与细胞分裂素浓度较高有关。综合愈伤组织芽分化质量及分化率的高低确定适宜的分化培养基为MS+6-BA 1.0 mg/L +IBA 0.05 mg/L。
3 讨论
该研究采用苦糖果茎段诱导出愈伤组织,并从愈伤组织中分化出芽,成功获得了再生苗,为苦糖果种质资源保存、扩大及栽培推广奠定基础。
有关于忍冬科组织培养与快繁的报道已有不少,但外植体多以顶芽、腋芽、叶片等为主[7]。该试验以无菌苗的茎段为外植体,从培养基和植物激素2方面研究了苦糖果愈伤组织诱导及分化的影响因素。苦糖果愈伤组织诱导率及愈伤组织质量受不同培养基的影响,该试验采用1/2MS、MS培养基附加不同浓度植物激素诱导愈伤组织,发现只有在MS培养基上产生愈伤组织,说明大量元素减半并不适用于苦糖果愈伤组织诱导,这与蕊帽忍冬芽的诱导不同,即采用1/2MS为基本培养基附加激素即可诱导不定芽的产生[8],而采用MS诱导的愈伤组织结构疏松、分裂速度快、生长湿润,质量较好,有利于苦糖果不定芽的诱导[9]。在诱导愈伤组织过程发现,茎段不仅长出愈伤组织,而且在M1、M3培养上长出根毛且M1培养基根的数量偏多,这可能是由于接种茎段受种子内自带激素相互作用且生长素浓度较高。
在组织培养过程中,植物生长调节剂对细胞生长和组织分化有明显的调节作用[10]。刘志红[11]利用带腋芽的茎段,采用MS+6-BA 2.0 mg/L +NAA 0.2 mg/L诱导获得健壮的芽,杨培君等[12]以蒙花忍冬茎段为外植体成功获得了再生植株。该研究采用不同浓度6-BA、IBA进行苦糖果不定芽的诱导,结果表明,随着细胞分裂素浓度的升高,不定芽分化率随之增大,但是浓度越大,不定芽质量越差,生长缓慢,有不定根形成,这可能是由于细胞分裂素浓度过高,抑制了维管组织的分化,从而阻碍不定芽的分化。低浓度细胞分裂素条件下有不定芽的发生,但是不定芽生长细弱,叶片伸展不良,愈伤组织后期变黑变褐。只有适当浓度的6-BA和IBA才能诱导不定芽的产生,该试验结果得出,当6-BA浓度为1.0 mg/L,IBA浓度为0.05 mg/L为苦糖果不定芽诱导的最佳培养基。
参考文献
[1] 晁无疾,王志刚.杈杷果资源及其研究[J].中国野生植物,1989(4):18-20.
[2] 姚方,郭振锋,陈涛,等.苦糖果苗木繁育技术[J].绿色科技,2011(12):90-91.
[3] 薛新权,阎腾飞.苦糖果繁育技术及应用价值开发[J].信阳农林学院学报,2015,25(4):106-108.
[4] 中国科学院中国植物志编辑委员会.中国植物志:第72卷[M].北京:科学出版社,1988.
[5] 李浚明,朱登云,译.植物组织培养教程[M].3版.北京:中国农业大学出版社,2005.
[6] 朱建华,彭士勇.植物组织培养实用技术[M].北京:中国计量出版社,2002.
[7] 路俊仙,林慧彬.忍冬组织培养研究进展[J].辽宁中医药大学学报,2013,15(12):90-92.
[8] 孙朝晖,尹会荣.蕊帽忍冬的组织培养和快速繁殖[J].植物生理学通讯,2008,44(1):125-126.
[9] 周宜君,周生闯,刘玉,等.植物生长调节剂对植物愈伤组织的诱导与分化的影响[J].中央民族大学学报(自然科学版),2007,16(1):23-28.
[10] 倪德祥.植物生长调节剂在组织培养中的调控作用[J].自然杂志,1987,10(1):35-39.
[11] 刘志红.接骨木组织培养技术研究[D].杨凌:西北农林科技大学,2008.
[12] 杨培君,陈德经,赵桦,等.蒙花忍冬的组织培养与快速繁殖研究[J].西北植物学报,2003,23(7):1304-1307.
