猕猴桃果酒酿造专用酵母菌株的筛选
2021-09-03舒学香唐贤华
舒学香,周 文,2 ,吴 霞,隋 明,唐贤华
(1.四川工商职业技术学院 酒类与食品工程系,四川 都江堰 611830;2.四川大学 轻工科学与工程学院,四川 成都 610065)
猕猴桃也称藤梨、奇异果、毛梨等。因其独特的风味,富含维生素C,被誉为“水果之王”[1],中国是猕猴桃属植物的原产地,猕猴桃资源极其丰富[1],截至2018年3月,中国猕猴桃种植面积共24.2万hm2,结果面积15.8万hm2,产量243万t,产量和种植面积均居世界第一[2]。其中四川省的猕猴桃种植面积达到2.97万hm2,年产值达11亿元,位列全国第二名。四川都江堰由于土壤、气候环境和水源等条件非常适合种植猕猴桃,使都江堰成为了全国最早引种猕猴桃成功的地区,并且都江堰猕猴桃获得国家地理标志产品保护[3]。目前猕猴桃销售方式仍以鲜销为主,然而由于贮藏技术水平不高,导致大量积压、腐烂,给产地猕猴桃销售造成困境,加之每年有大量次果鲜销困难,因此,加大果实加工产品的开发,对于猕猴桃资源的利用有很大的意义和前景。
猕猴桃果酒是以猕猴桃果汁(浆)为原料,经完全或部分发酵而酿制成的发酵酒[4]。开发猕猴桃果酒顺应了现代酒类的4大转变方向,即粮食酒向果酒转变,高度酒向低度酒转变,低档酒向高档酒转变,蒸馏酒向发酵酒转变,具有较好的发展前景。目前,已有很多关于猕猴桃酒酿造工艺的研究[5-7],都江堰青城山道家也有采用传统工艺酿制的猕猴桃酒,因其在天下第五洞天中酿制,取名为洞天乳酒,誉为“青城四绝”之一[3]。但是这些使用天然酵母或葡萄酒酿造酵母酿造猕猴桃酒会导致其香味不突出、猕猴桃风味不典型,严重影响了猕猴桃酒的品质,限制了猕猴桃酒产业的发展[8]。因此,筛选猕猴桃果酒酿造专用酵母势在必行,近年来已有研究团队开展了相关研究,开发了几种筛选方法并筛选到了一些猕猴桃酒酿造专用酵母,通过应用研究发现其发酵能力较强,并能较好的保留猕猴桃的风味[9-11],但猕猴桃品种众多,全世界猕猴桃属植物共有54个种,21个变种[1],已筛出的这些酵母不一定适合所有品种猕猴桃酒的酿造。本研究以都江堰红阳猕猴桃为试验原料,以发酵能力为主要指标,从富含酵母的果皮、果园土壤中筛选猕猴桃果酒酿造专用酵母,以期深化红阳猕猴桃加工应用,提高产品附加值,解决鲜果挤压、滞销、腐烂、损坏等问题。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
红阳猕猴桃:都江堰市聚源镇市售;猕猴桃果园土壤:都江堰市聚源镇;偏重亚硫酸氢钾、碳酸钙(分析纯):成都金山化学试剂有限公司;果胶酶(30 000 U/g)、明胶(生化试剂):成都市科龙化工试剂厂;安琪葡萄酒高活性干酵母BV818:安琪酵母股份有限公司。
1.1.2 培养基
富集培养基(猕猴桃果汁培养基):成熟的猕猴桃分选、洗净、去皮,挤出浆汁,加入果胶酶100 mg/L,密封室温酶解12 h。酶解结束后用4层纱布过滤,滤液中加入偏重亚硫酸钾160 mg/L,放入4 ℃冰箱,备用。
豆芽琼脂培养基:称取一定量的黄豆芽,加入10倍的水,煮沸后小火熬煮30 min,用纱布滤掉豆芽渣,补足蒸发的水分,制得浓度10%的豆芽汁。在豆芽汁中加入5%的葡萄糖,2%的琼脂粉,加热并缓慢搅拌使琼脂粉融化。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
DHP-9162型电热恒温培养箱、TH2-98A型恒温摇床:上海齐欣科学仪器有限公司;LH129425型手持糖度仪:成都市青羊联合光学仪器成套部;pH/Ion510酸度计:赛飞(中国)有限公司;Nikon E100型数码显微镜:江南永新有限公司;2720 thermal cycler型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;UV-5100型紫外-可见分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 酵母菌的富集
称取5 g猕猴桃果园土壤或猕猴桃果皮于50 mL无菌生理盐水中混匀制成样品稀释液。按照无菌操作的要求,将2 mL样品稀释液接种到50 mL富集培养基中,28 ℃摇床培养2~3 d,制得酵母富集液。富集过程中,每隔6 h用分光光度计测其在波长600 nm下的吸光度值。
1.3.2 酵母菌株的分离
按照无菌操作的要求,将酵母菌富集液用无菌生理盐水逐级进行10倍梯度稀释,取10-6、10-7、10-8三个梯度稀释液各0.1 mL,分别涂布于豆芽琼脂培养基平板,28 ℃恒温培养箱培养2~3 d。
1.3.3 酵母菌株的初筛
待分离平板上菌落长出后,根据菌落形态挑取不同菌落特征的单菌落划线接种于豆芽琼脂培养基上,28 ℃恒温培养箱培养2~3 d,待菌落长出后,观察细胞形态,将符合酵母特性的初筛菌株试管斜面放入4 ℃冰箱保藏。
1.3.4 酵母菌株的复筛
将初筛得到的菌株挑取2环接种于10 mL豆芽汁培养基,28 ℃恒温培养至波长600 nm处的吸光度值为0.8。在250 mL三角瓶中装入200 mL猕猴桃果汁,接入10 mL初筛菌株培养液,用止回阀封口,28 ℃恒温培养箱静置发酵,发酵的过程中观察发酵液起泡产生情况、果渣分离情况,并测定发酵液糖度、酒精度、CO2质量损失的变化,结合感官评定,筛选优良的菌种。
1.3.5 猕猴桃果酒的酿造与主要指标的检测方法
参考文献[13]方法,进行猕猴桃果酒的酿造,主要指标的测定方法如下:
糖度:使用糖度仪,按照其使用说明进行检测。
CO2质量损失:称量接种时发酵液的质量(M0),在发酵过程中称量发酵液的质量(Mn),CO2质量损失(g)=M0-Mn。
酒精度、感官评定参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》[12]进行。
1.3.6 感官评分标准
感官评分由5名评分人员参照参考文献[13]中的标准进行。
1.3.7 菌株的鉴定
形态及生理生化鉴定:根据《酵母菌的特征与鉴定手册》[14]对筛选出的优势菌株进行形态学观察,选择合适的指标进行生理生化鉴定。
分子生物学鉴定:采用Ezup柱式真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒,按照其说明书提取菌株的总DNA,以其作为模板采用NL1、NL4通用引物PCR扩增菌株26S rDNA D1/D2区。扩增产物用1%的琼脂糖凝胶电泳,位置正确的条带切胶后用SanPrep柱式DNA胶回收试剂盒纯化,纯化后的PCR扩增产物委托上海生工生物工程公司进行测序。测序结果提交到美国国家生物信息中心(national center for biotechnology information,NCBI),运用基本局部比对搜索工具(basic local alignment search tool,BLAST)在GenBank数据库中进行同源序列搜索。通过搜索比对,选取相似度较高的菌株,下载其26S rDNA D1/D2区序列,与筛出的菌株序列一起用MEGA-X软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.8 猕猴桃酒的香气成分分析
将菌株T-13用于猕猴桃酒的发酵,并以未接种酵母的猕猴桃果汁和接种市售葡萄酒专用酵母发酵的猕猴桃原酒作为参照,采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)法结合气相色谱质谱联用(gas chromatograph-massspectrometer,GC-MS)仪分析其香气成分。发酵方法和HS-SPME-GC-MS条件按照参考文献[13]进行。
2 结果与分析
2.1 富集过程微生物数量的变化
将猕猴桃果皮和猕猴桃果园土壤分别制成稀释液,添加到猕猴桃果汁中富集培养,培养过程中测其OD600nm值,以监测微生物数量变化,分析结果见图1。
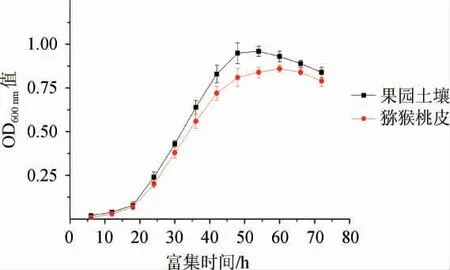
图1 富集培养过程中的微生物生长曲线Fig.1 Growth curve of microorganisms during enrichment culture
由图1可知,猕猴桃果皮和猕猴桃果园土壤微生物富集过程中,微生物数量的变化规律一致。18 h以内是延滞期,微生物在适应新的培养环境为快速繁殖做准备,因此这一时期微生物数量增长缓慢;18~48 h为对数生长期,此时微生物数量快速增长,同时培养基中的营养物质被快速消耗;48 h以后,由于营养物质的减少,微生物的生长进入平稳期和衰亡期,微生物细胞活力减弱,死亡数不断增加。为了更多、更好地筛选到强壮的酵母,选择处于对数期(富集42~48 h)的富集培养液开展后续工作。
2.2 菌株初筛
富集培养液稀释涂布于分离平板上,待菌落长出后,根据菌落特征挑选出28株可能是酵母的菌株。将它们划线培养后观察菌落特征和细胞形态,发现4株符合酵母菌落和形态特征[15]的菌株T-8、T-11、T-13、P-12,其菌落特征和细胞形态结果如表1所示。

表1 初筛菌株的菌落特征和细胞形态Table1 Colony characteristics and cell morphology of primary screening strains
2.3 菌株复筛
2.3.1 不同菌株对发酵过程糖度变化的影响
降糖速度是指示菌株发酵性能的重要指标,在同等条件下,希望菌株的降糖速度更快,这标志着菌株发酵速度更快,发酵启动时间更短。快速发酵有利于防止发酵过程中感染杂菌,对保障猕猴桃酒的稳定性有较大的作用。由图2可知,筛选出的T-8、T-11、T-13三株菌降糖速度较快,优于菌株P-12,且筛选出的4株菌降糖速度都快于市售果酒酵母,说明猕猴桃果园环境中的天然酵母可能更适合猕猴桃果汁的发酵。从最终糖度来看,筛出的4株菌及市售果酒酵母都在发酵开始约48 h时将糖度降至6°Bx左右,之后糖度几乎不再下降,说明这几株菌在最终发酵度方面基本没有区别,总糖都降了10°Bx左右,都能够满足猕猴桃酒发酵的需求。

图2 发酵过程中的糖度变化Fig.2 Changes of sugar degree during fermentation process
2.3.2 不同菌株对发酵过程CO2质量损失的影响
CO2质量损失也是评价菌株发酵力的重要指标[16],酵母在发酵猕猴桃汁中的糖分产生酒精的同时也会产生CO2,CO2通过止回阀排出三角瓶,因此CO2质量损失越大说明酵母利用的糖越多,发酵力越强。从图3可以看出,筛选到的4株菌发酵猕猴桃汁的能力都强于市售果酒酵母,同时发现测定CO2质量损失反应出的各菌株发酵能力规律与测定糖度反应出的规律是一致的,这进一步证实了猕猴桃果园环境中的天然酵母可能更适合猕猴桃果汁的发酵的结论。通过CO2质量损失分析还可以更清晰地看到菌株T-13的发酵能力是筛选出的4株菌中最强的,CO2质量损失为13 g(6.13%),发酵速度最快且最终发酵度也更高。

图3 发酵过程中CO2质量损失的变化Fig.3 Changes of CO2 mass lost during fermentation process
2.3.3 不同菌株对发酵过程酒精度变化的影响
从图4可以看出,猕猴桃果汁发酵过程中,酒精度的变化规律与糖度变化、CO2质量损失变化的规律完全一致。说明从三个评价菌株发酵力的主要指标都能看出,筛选出的4个菌株相对于市售果酒酵母都更适合于猕猴桃果汁的发酵,且筛选出的菌株T-13的发酵能力是最强的,发酵72 h后所产猕猴桃果酒酒精度可以达到9.8%vol。

图4 发酵过程中酒精度的变化Fig.4 Changes of alcohol content during fermentation process
2.4 感官评价
将筛选出的4株菌与市售果酒专用酵母发酵试验获得的原酒按照感官评分标准进行感官评价,其结果如表2所示。

表2 不同菌株发酵猕猴桃酒感官评价结果Table2 Results of sensory evaluation of kiwi fruit wine fermented by different strains
通过感官评价结果发现,菌株T-8、T-11、P-12及市售果酒酵母发酵所得的原酒在澄清度、颜色、香气、口感等各个方面都较为相似,而菌株T-13在各方面的评价要优于其他菌株。通过感官评分可以分析出菌株T-11和P-12发酵的猕猴桃原酒感官质量较差,菌株T-8与市售果酒酵母接近,发酵的猕猴桃原酒感官质量一般,菌株T-13发酵的猕猴桃原酒感官质量最好。说明筛选到的菌株T-13最适合用于酿造猕猴桃酒,能较好地保留猕猴桃独特的香气和滋味,发酵出的原酒具有典型的猕猴桃香气。
2.5 菌株T-13的鉴定
2.5.1 形态学观察
前期发酵力测试和发酵试验感官评分均表明菌株T-13最适合用于猕猴桃果汁的发酵,因此开展了菌株T-13的鉴定工作。将T-13菌株在豆芽琼脂固体平板培养基上划线,28 ℃培养48 h后观察其菌落形态,菌株T-13的菌落形态、细胞形态、美兰染色结果见图5。
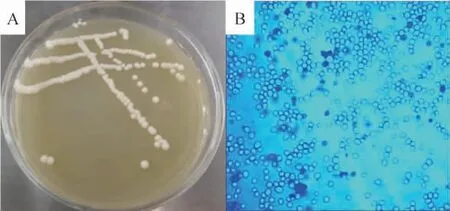
图5 菌株T-13的菌落形态(A)和细胞形态(B)Fig.5 Colony (A) and cell (B) morphology of strain T-13
由图5A可知,菌落呈白色,表面光滑湿润不透明,单个菌落呈较规则的圆形并突出于培养基生长,单菌落中心有白色凸起,边缘整齐,易挑取,符合酵母菌的典型菌落形态特征[17-18]。由图5B可知,菌株T-13培养48 h后进行美兰染色在光学显微镜下观察细胞形态,发现细胞呈卵圆形,无菌丝,同样是酵母的典型细胞形态[18],通过美兰染色还可以看出,培养48 h的酵母细胞活性较强,绝大多数细胞是活细胞。
2.5.2 生理生化鉴定
菌株T-13的生理生化测试结果见表3。根据生理生化鉴定结果,结合菌株的菌落形态和细胞形态,查阅《酵母菌的特征与鉴定手册》[14],初步判定菌株T-13为酿酒酵母(Saccharomyces cerevisiae)。

表3 菌株T-13的生理生化鉴定结果Table3 Results of physiological and biochemical identification of strain T-13
2.5.3 分子生物学鉴定
提取菌株T-13的基因组DNA,以其为模板用NL1、NL4通用引物进行26S rDNA D1/D2区扩增,扩增产物用1%琼脂糖凝胶电泳进行检测,结果如图6。
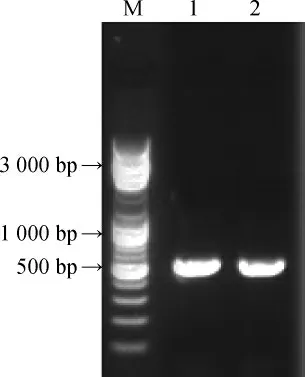
图6 菌株T-13 26S rRNA PCR扩增产物琼脂糖凝胶电泳结果Fig.6 Results of agarose gel electrophoresis of 26S rDNA PCR amplification product of strain T-13
PCR扩增产物纯化后委托上海生工生物工程公司进行测序。测序结果提交NCBI,运用BLAST工具在GenBank数据库中进行同源序列比对,选取相似度较高的菌株,下载其26S rDNA D1/D2区基因序列,用MEGA-X软件中的NJ法构建系统发育树,结果如图7所示。由图7可知,菌株T-13与酿酒酵母(Saccharomyces cerevisiae)聚到一支,它们的亲缘关系最近,序列相似度为100%。结合形态观察和生理生化鉴定,确定菌株T-13为酿酒酵母(Saccharomyces cerevisiae)。

图7 基于26S rDNA序列菌株T-13的系统发育树Fig.7 Phylogenetic tree of strain T-13 based on 26S rDNA gene sequences
2.6 猕猴桃酒的香气成分分析
采用HS-SPME-GC-MS技术分析菌株T-13发酵的猕猴桃原酒、市售果酒酿造专用酵母发酵的猕猴桃原酒以及猕猴桃果汁中的香气成分,其GC-MS分析总离子流色谱图见图8。
从图8可知,菌株T-13发酵的猕猴桃原酒与猕猴桃果汁的香气成分极其相似,出峰位置几乎完全一样,说明菌株T-13发酵能更好地保持猕猴桃果汁原有的风味特征。相比较而言,市售果酒酵母在发酵过程中产生了一些新的代谢产物,也有一些猕猴桃汁中存在的香气成分消失,说明发酵作用带来了一些风味上的改变。采用面积归一化法,定量分析检测到的主要香气成分对应峰面积计算相对含量,其结果如表4所示。
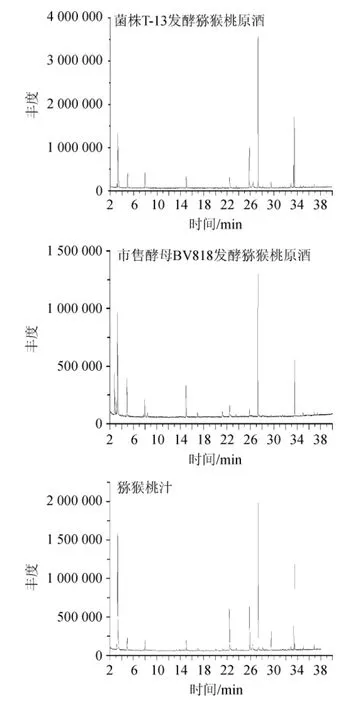
图8 酵猕猴桃汁及猕猴桃酒的香气成分的GC-MS总离子流色谱图Fig.8 Total ion flow chromatography of aroma components in kiwi fruit juice and kiwi fruit wine analyzed by GC-MS
由表4可知,相对于市售果酒酵母,菌株T-13发酵制得的猕猴桃原酒中香气成分组成与猕猴桃汁基本相同,说明其保留了猕猴桃原有的风味特征。但是经过菌株T-13发酵后各香气成分的占比发生了一定的变化,主要表现在3-甲基-1-丁醇、乙酸苯乙酯的大量减少,以及丁酸乙酯、苯乙醇、乙基9-癸烯酸酯的大量增加。3-甲基-1-丁醇俗称异戊醇,是杂醇油的重要组成部分[19],过多的杂醇油是造成饮酒上头的重要原因[20],所以3-甲基-1-丁醇的减少对酒质有一定益处。乙酸苯乙酯是常见的风味物质,具有花香、蜜香、果香气味[21-22],可以看到菌株T-13发酵会导致猕猴桃酒中来自于乙酸苯乙酯的香气减少。丁酸乙酯具有强烈的果香味,对猕猴桃香气的贡献最大[23],说明菌株T-13的发酵作用能够使酒中的猕猴桃香气更加突出。苯乙醇是酵母发酵猕猴桃酒的重要香气成分,能够赋予猕猴桃酒独特的花香[24],经菌株T-13发酵后猕猴桃酒中苯乙醇含量显著增加,说明该菌对猕猴桃酒的风味形成有一定的好处。乙基9-癸烯酸酯也是发酵果酒中含量较高的一种酯类[25],但目前少有见到其风味特征的有关报道,因此尚无法判断其对猕猴桃酒香气影响的利弊。
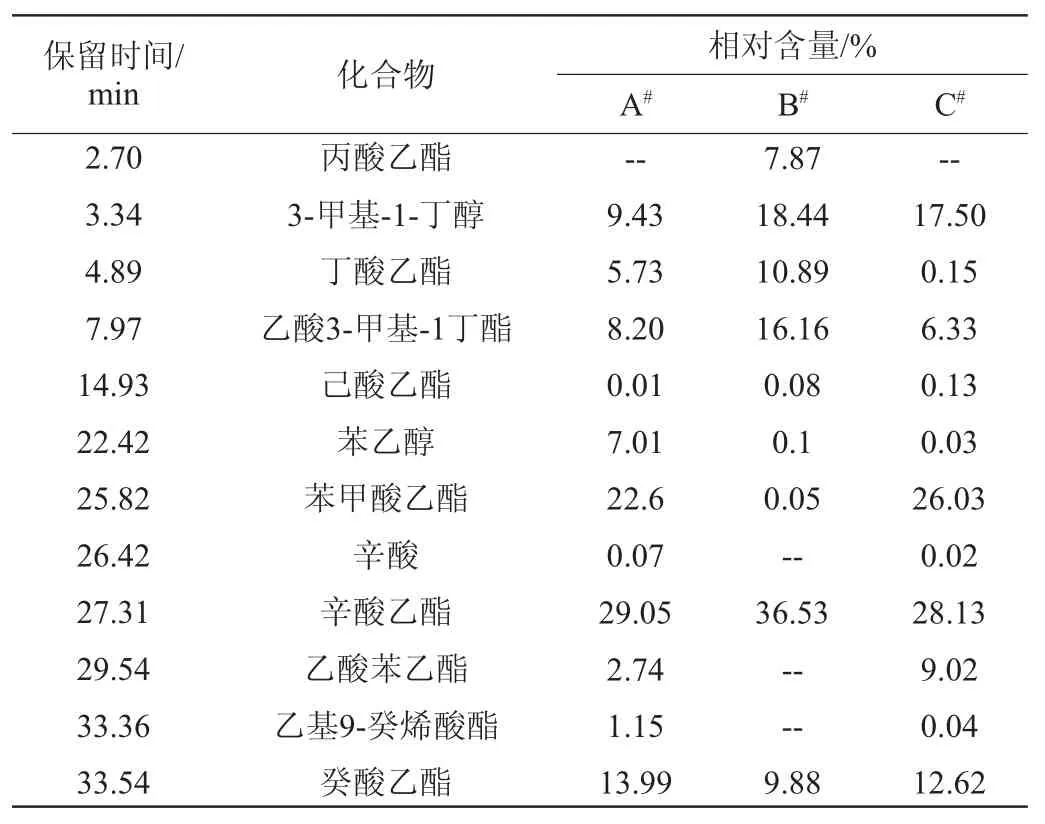
表4 酵猕猴桃汁及猕猴桃酒的香气成分对照Table4 Comparison of aroma components in kiwi fruit juice and kiwi fruit wine fermented with different yeasts
3 结论
经过富集培养、初筛和复筛,从猕猴桃果园土壤中筛选到了一株非常适合猕猴桃果汁发酵生产猕猴桃发酵酒的酵母,命名为T-13。通过降糖能力、CO2质量损失和产酒精能力测试发现该菌株具有很强的发酵能力,在用于猕猴桃果汁的发酵时,其发酵性能明显优于市售果酒酵母酿造酵母。结合形态学鉴定、生理生化鉴定和分子学鉴定,证实该菌株属于酿酒酵母(Saccharomyces cerevisiae)。将菌株T-13用于发酵试验,对获得的猕猴桃原酒进行感官评价和香气成分分析,发现经菌株T-13发酵产生的猕猴桃原酒质量较优,具有典型的猕猴桃香气,是适合于猕猴桃酒酿造的专用酵母。
